下呼吸道感染患者铜绿假单胞菌分离株氨基糖苷类耐药相关基因分析
毕 玲,葛庚芝,赖雁平,于树云,司 进,李 彬,张贵生
(天津医科大学第二医院,天津300211)
铜绿假单胞菌(PAE)广泛分布于自然界及健康人的皮肤、肠道和呼吸道,当人体免疫力降低、严重创伤或进行创伤性医疗操作时容易引起内源性感染[1],是下呼吸道感染的重要病原体[2]。氨基糖苷类药物为广谱抗生素,一直与β-内酰胺类合用作为治疗PAE感染的一线药物[3]。随着氨基糖苷类药物的长期使用,PAE对这类药物的耐药率明显升高。研究发现,其耐药机制主要是产生AMEs、16S rRNA甲基化酶和氨基糖苷类药物作用靶位16S rRNA基因突变,以产生AMEs为常见[4]。16S rRNA甲基化酶首次发现于产氨基糖苷的放线菌中,近年来在人类致病菌中亦相继报道了这一机制介导的高水平氨基糖苷类耐药[5]。为调查对氨基糖苷类耐药的PAE下呼吸道感染分离株中与耐药相关的氨基糖苷类修饰酶(AMEs)基因和16S rRNA甲基化酶基因(以下简称甲基化酶基因)的存在状况,2009~2010年,我们收集了从下呼吸道感染患者合格痰标本中分离的对临床常用氨基糖苷类药物耐药的52株PAE,检测了6种AMEs基因及6种甲基化酶基因,旨在探讨下呼吸道感染分离的PAE对氨基糖苷类药物的耐药机制。
1 材料与方法
1.1 材料 52株PAE分离自下呼吸道感染患者合格痰标本(天津医科大学第二医院32株,天津医科大学总医院20株),经K-B法证实对庆大霉素、妥布霉素、阿米卡星及奈替米星中至少1种药物耐药,结果判读依照美国临床实验室标准化委员会(CLSI)2008年版标准。半数抑菌浓度(MIC50)分别为1 024、128、16和>1 024 mg/L,均以AMS-60全自动微生物分析仪鉴定到种。培养基购自天津金章科技发展有限公司。主要实验仪器有Thermomixer恒温振荡仪、Centrifuge 5415D离心机、PCR仪及微量移液器,DYY-6D型电泳仪,GELDOC-200型凝胶成像系统。主要试剂为Premix Taq、DNA marker (DL 1 000)及6×Loading Buffer(大连TaKaRa生物技术公司),PCR引物由上海生物工程有限公司合成。
1.2 PCR扩增模板制备及耐药基因检测 采用煮沸法制备PCR扩增模板。取1.5 mL离心管加入200 μL、灭菌去离子水,刮取血平板上培养16~18 h的菌落,充分振荡混匀后达到5号麦氏比浊管的浊度,98℃恒温振荡加热10 min,12 000 r/min离心6 min,吸取上清液-20℃保存备用。PCR法检测52株PAE的6种AMEs基因aac(3)-Ⅱ、aac(6')-Ⅰb、aac(6')-Ⅱ、ant(2″)-Ⅰ、ant(3″)-Ⅰ和aph(3')-Ⅵ,并检测其中25株对4种药物全部耐药菌株(泛耐药菌)的甲基化酶基因armA、rmtA、rmtB、rmtC、rmtD和npmA。aac(3)-Ⅱ、aac(6')-Ⅰb、ant(3″)-Ⅰ和npmA基因使用文献[6]的 PCR引物,其他基因的PCR引物使用Primer Premier 5.0软件自行设计,见表1。PCR反应体系:Premix Taq酶12.5 μL,上游引物和下游引物各1 μL,DNA模板2 μL,加灭菌去离子水至25 μL。去离子水为阴性对照。PCR反应热循环参数为:93℃预变性3 min,然后93℃变性30 s→退火30 s→72℃延伸1 min,共30个循环,最后一个72℃延长至5 min。扩增产物以DL 1 000为相对分子质量标准,用1%琼脂糖凝胶在10 V/cm电压下电泳20~30 min,用凝胶成像系统于紫外灯下观察结果,Quantity One软件分析PCR产物并照相保存。

表1 6种AMEs基因和6种16S rRNA甲基化酶基因PCR引物
1.3 阳性产物测序及分析 各种基因的PCR阳性产物各取1株送华大基因科技公司进行双向测序,测序结果用Chromas软件读序后与GenBank中已发布的序列做BLASTn比对,判断其同源性。
2 结果
2.1 耐药基因检出情况 52株PAE的耐药谱及耐药基因分布见表2。52株PAE中aac(3)-Ⅱ、aac (6')-Ⅰb、aac(6')-Ⅱ和ant(2″)-Ⅰ基因检出率分别为53.8%(28/52)、51.9%(27/52)、40.4%(21/ 52)和21.2%(11/52),未检出ant(3″)-Ⅰ和aph (3')-Ⅵ基因。AMEs基因总检出率为92.3%(48/ 52)。其中4株未检出AMEs基因,19株检出一种AMEs基因,19株检出两种AMEs基因,10株检出三种AMEs基因。泛耐药菌株中rmtB基因的检出率为52.0%(13/25),未检出其他甲基化酶基因。aac (3)-Ⅱ基因和aac(6')-Ⅰb基因的PCR产物电泳图分别见图1和图2。
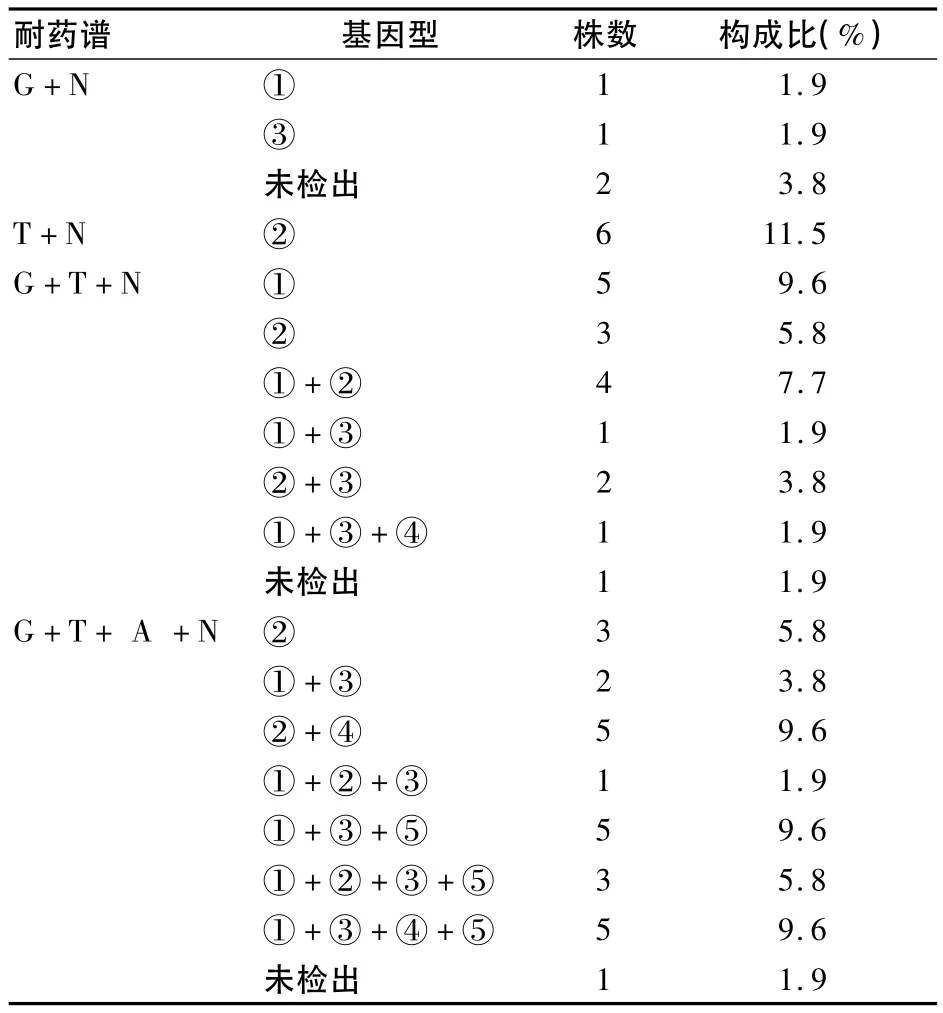
表2 52株PAE的耐药谱及耐药基因分布
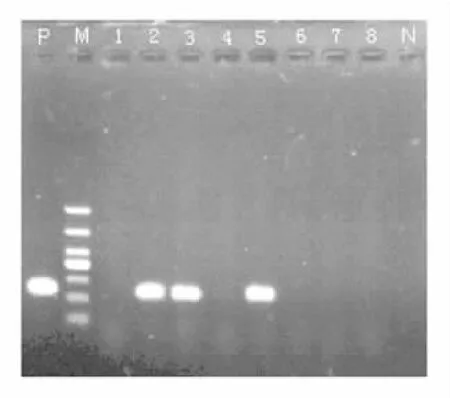
图1 aac(3)-Ⅱ基因PCR产物电泳图
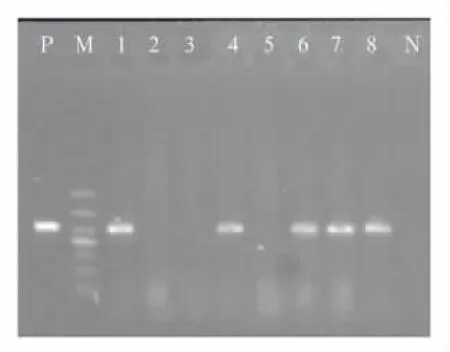
图2 aac(6')-Ⅰb基因PCR产物电泳图
2.2 测序及序列分析结果 aac(6')-Ⅰb、aac(6')-Ⅱ、ant(2″)-Ⅰ和rmtB的阳性产物序列分别与Gen-Bank登录号为HQ705763、HM366563、GU966683和 FJ483516的基因序列具有100% 的同源性;aac(3)-Ⅱ阳性产物序列与GenBank登录号为AF466526的基因序列具有98%的同源性,存在四处碱基置换突变,翻译成氨基酸序列后发现其中两处为错义突变,导致第78位赖氨酸被谷氨酸取代、第84位脯氨酸被亮氨酸取代,另外两处为同义突变,氨基酸序列同源性为97%。aac(6')-Ⅱ基因和rmtB基因的阳性产物测序图分别见图3和图4。

图3 aac(6')-Ⅱ基因阳性产物测序图(部分)
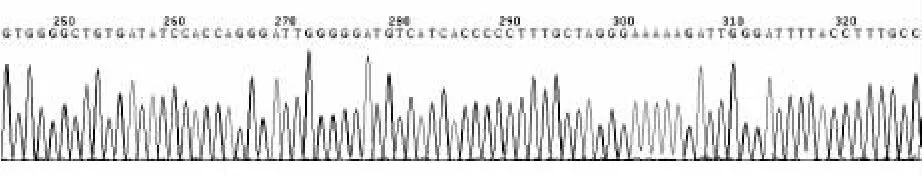
图4 rmtB基因阳性产物测序图(部分)
3 讨论
氨基糖苷类药物通过与细菌30 S核糖体亚基高度保守的A位点不可逆地结合抑制细菌蛋白质的合成从而导致细菌死亡。细菌产生的AMEs能够对氨基糖苷类药物分子中特定的氨基和羟基进行共价修饰使得药物与细菌核糖体的结合能力大大降低[7],从而导致耐药。AMEs按其催化的反应类型可分为乙酰转移酶(AAC)、核苷转移酶(ANT)、磷酸转移酶(APH)三大类,每一类酶中又有许多亚类能修饰不同位置上的氨基或羟基而使细菌产生不同的耐药表型。
AMEs灭活氨基糖苷类药物的机制非常复杂。由于不同的氨基糖苷类药物可具有相同的AMEs作用靶位,因而一种AMEs可以灭活多种氨基糖苷类药物;由于一种氨基糖苷类药物的分子结构中可存在多个AMEs作用靶位,因而不同种类的AMEs又可以灭活同种氨基糖苷类药物。
目前已发现超过50种AMEs,其中已报道在铜绿假单胞菌中存在的有10多种,最常见的是AAC (6')-Ⅱ和ANT(2″)-Ⅰ[8]。本组PAE菌株中AMEs基因的总检出率为92.3%,共检出4种AMEs基因,其中aac(3)-Ⅱ、aac(6')-Ⅰb和aac(6')-Ⅱ为流行基因,与国内文献[1,9,10]报道的流行基因型有一定差别,可能与各地区常用的氨基糖苷类药物不同有关。
本组多数菌株的耐药表型与其基因型相符。值得注意的是,虽然AAC(6')-Ⅰb能修饰阿米卡星药物分子,但本组中除了有3株只携带aac(6')-Ⅰb的菌对阿米卡星耐药之外,9株只携带aac(6')-Ⅰb和6株同时携带另外一种乙酰转移酶基因的菌均对阿米卡星敏感,而5株同时携带核苷转移酶基因和1株同时携带另外两种乙酰转移酶基因的菌均对阿米卡星耐药,提示AAC(6')-Ⅰb往往需要与核苷转移酶或另外两种乙酰转移酶同时作用才能引发对阿米卡星耐药。本组中有6株菌只检出对庆大霉素没有修饰作用的aac(6')-Ⅰb但对庆大霉素耐药,有2株菌只检出对阿米卡星没有修饰作用的aac(3)-Ⅱ和aac(6')-Ⅱ但对阿米卡星耐药,另外还有4株耐药菌未检出测试的AMEs基因,可能是因为菌株携带其他不常见的AMEs基因、药物外排泵表达增强、发生药物作用靶位基因突变或核糖体蛋白编码基因突变等,尚有待进一步研究。
本组aac(3)-Ⅱ阳性产物测序菌株只检出aac (3)-Ⅱ1种耐药基因,但对庆大霉素和奈替米星均呈高水平耐药(MIC值均>1 024 mg/L)。其测序结果翻译成氨基酸序列后与 GenBank登录号为AF466526的基因序列相应的氨基酸序列比对,发现存在两处错义突变,即第78位赖氨酸被谷氨酸取代、第84位脯氨酸被亮氨酸取代。两处突变从单个氨基酸残基上来分析,赖氨酸→谷氨酸可使AAC (3)-Ⅱ修饰酶在相同的pH条件下负电荷数目增多,与带正电荷的氨基糖苷抗生素作用增强,使菌株表现为高水平耐药。而第84位脯氨酸→亮氨酸会改变AAC(3)-Ⅱ修饰酶保守区的二级结构,从而使酶的活性发生变化[11]。
rmtB基因首次发现是分离自日本的一株黏质沙雷菌[12]。本组PAE中只检出rmtB 1种甲基化酶基因,与文献[9,10]报道相同。4种氨基糖苷类药物对所有rmtB阳性菌株的MIC值均>1 024 mg/L,呈现高水平泛耐药。MIC值均>1 024 mg/L的16株高水平泛耐药菌中有13株检出 rmtB基因,占81.3%,提示导致下呼吸道感染的氨基糖苷类耐药PAE对氨基糖苷类高水平泛耐药主要与rmtB有关。
由于AMEs基因和16S rRNA甲基化酶基因大多是由质粒、整合子及转座子等可移动遗传元件介导,易于在细菌之间传播[9],从而造成耐药菌株的播散。加强实验室对细菌耐药的监测和耐药基因的流行病学调查有助于了解耐药菌株的传播规律,对指导临床合理使用抗菌药物、有效控制医院感染、控制耐药菌株的播散以及指导抗菌药物的研发方向均有重要意义。
[1]史伟峰,王玉月,何彩珍,等.铜绿假单胞菌氨基糖苷类药物修饰酶基因研究[J].检验医学,2007,22(1):67-70.
[2]王一兵,李卫光,朱其凤.山东省医院感染控制网下呼吸道感染病原菌分布及耐药分析[J].中华医院感染学杂志,2005,15 (5):490-492.
[3]顾觉奋.抗生素的合理应用[M].上海:上海科学技术出版社,2004:55-67.
[4]Doi Y,Arakawa Y.16S Ribosomal RNA Methylation:Emerging Resistance Mechanism against Aminoglycosides[J].Clin Infect Dis,2007,45(1):88-94.
[5]吴琼,倪语星.一种新的氨基糖苷类耐药决定因子—质粒介导的16S rRNA甲基化酶[J].微生物与感染,2009,4(1):45-48,58.
[6]糜祖煌,陆亚华.氨基糖苷类修饰酶及其基因检测[J].现代实用医学,2004,16(1):13-14.
[7]郑卫.氨基糖苷类抗生素研究的新进展[J].国外医药:抗生素分册,2005,26(3):101-110.
[8]Poole K.Aminoglycoside resistance in pseudomonas aeruginosa[J].Antimicrob Agents Chemother,2005,49(2):479-487.
[9]汪宏良,邹义春,柯俊,等.多药耐药铜绿假单胞菌16S rRNA甲基化酶、氨基糖苷类修饰酶基因研究[J].中华医院感染学杂志,2008,18(11):1505-1508.
[10]糜祖煌,秦玲.泛耐药铜绿假单胞菌16S rRNA甲基化酶、氨基糖苷类修饰酶基因研究[J].中华医院感染学杂志,2008,18 (12):1656-1658.
[11]陈接根,吕建新,楼永良,等.大肠埃希菌氨基糖苷类耐药株aac (3)-Ⅱ基因保守区分析[J].遗传,2004,26(2):202-204.
[12]Doi Y,Yokoyama K,Yamane K,et al.Plasmid-mediated 16S rRNA methylase in Serratia marcescens conferring high-level resistance to aminoglycosides[J].Ant Agents Chem,2004,48(2):491-496.

