Cupriavidus metallidurans CH34中2个苯酚降解基因簇的筛选与功能鉴定
李 莉, 张俊亚, 唐远平, 宋任涛, 朱晨光
(上海大学生命科学学院上海市能源作物育种及应用重点实验室,上海200444)
苯酚是焦化厂及炼油厂污水的主要有机污染物.近30年的研究表明,许多微生物参与此类有机物的降解过程[1],苯酚的生物降解已成为一种经济高效且不会产生二次污染的方法[2].降酚微生物基因组中存在多个与降酚相关的基因,组合形成操作元,一起调控微生物降解苯酚.目前,苯酚的好氧降解途径已被解析,步骤如下:苯酚加氧变为邻苯二酚,再分别由邻位或间位途径环裂解,邻位途径产生β-一酮基己二酸中间产物,间位途径产生α-一酮基己二酸中间物,两种路径都形成丙酮酸,而后进入三羧酸循环.
Cupriavidus metallidurans CH34是从污染废水处理池的沉淀物中分离得到的一种细菌.该细菌具有较好的苯酚降解能力,还可在以甲苯酚、苯甲酸、苯胺等芳香族化合物为唯一碳源和能源的培养基中生长.高振贤等[3]和宋水山等[4]的研究表明,该菌种降解苯酚的速率常数为0.33,最适pH为7.0,最适温度为30℃.CH34基因组的测序工作已于2002年9月完成,其染色体大小为3.9 Mb,含有3个大质粒:Megaplasmid(2.6 Mb),pMOL 28(171 kb)和pMOL 30(234 kb).
本研究利用GenBank数据库,通过比较基因组学分析,发现CH34基因组中存在新颖的苯酚降解基因簇结构.序列注释分析发现,CH34同时具备邻位与间位2种不同开环路径的苯酚降解基因簇,其各自的苯酚羟化酶大亚基(LmPH)氨基酸序列在系统发育地位上存在较大差异,这预示着CH34可能有其独特的苯酚降解机理和调控机制.因此,对该菌株的降酚基因簇展开深入的功能研究,不仅可以对微生物降解苯酚的分子机制起到验证和补足的作用,同时也可以为生物处理污水中的苯酚等污染物提供优良的功能基因.本研究采用pIndigo-BAC 5载体构建了CH34的细菌人工染色体(bacterial artificial chromosome,BAC)基因组文库.根据降酚基因簇LmPH的phlN基因设计引物,用PCR的方法从BAC文库中筛选到了分别含有2个完整苯酚降解基因簇的单克隆,并分别检测了这2个降酚基因簇在大肠杆菌中对苯酚的降解能力,为今后筛选高效的降酚基因簇和研制可应用于环境治理的基因工程菌奠定了理论基础.
1 材料和方法
1.1 材料
菌株C.metallidurans CH34购于美国模式培养物保藏中心(American Type Culture Collection,ATCC),BAC载体pIndigo-BAC 5购于EpiCentre公司,低熔点琼脂糖胶和大肠杆菌(E.coli)感受态细胞DH10B购于Invitrogen公司,脉冲场凝胶电泳用Marker购于 NEB公司,限制性内切酶 NotⅠ,HindⅢ和 XbaⅠ购于 Fermentas公司,Taq DNA Polymerase和dNTP购于TaKaRa公司.
1.2 方法
1.2.1 BAC文库的构建
随着大片段DNA插入技术的发展,科学家们克服了制约BAC文库发展的瓶颈,从而为大规模的文库构建及大基因组文库的构建奠定了基础[5].BAC文库除了插入片段较大外,还具有遗传稳定性好、嵌合现象低等优点[6-7],因此,本研究试图通过构建CH34的BAC文库,来研究其2个苯酚降解基因簇的功能.
首先提取高分子量的CH34基因组DNA,将DNA保存于低熔点琼脂糖制备的胶块中,胶块保存于0.1 mol/L EDTA中,确定最佳酶切条件后,开始正式酶切.取适量的DNA进行酶切,为得到大小更为集中的片段,一般进行两次脉冲场电泳[8].第一次脉冲场电泳的条件为:1%琼脂糖凝胶,0.5×TBE,6 V/cm电压,90 s脉冲时间,14℃电泳16 h以分离酶切的片段.第二次脉冲场电泳的条件为:1%琼脂糖凝胶,0.5×TBE,4 V/cm电压,5 s脉冲时间,14℃电泳5 h.以分子Marker为参照,切下片段大小在100~300 kb的DNA胶块,装入透析袋,电洗脱得到所需的DNA片段[9].与DNA标准浓度梯度比较,确定得到的大片段DNA的浓度.以载体与目的片段摩尔比为5∶1的比例进行连接,连接体系总体积为50 μL,连接反应于16℃进行约10 h,得到的连接产物于65℃处理15 min,以使 T4 DNA连接酶失活[10].对连接产物进行脱盐和浓缩处理以提高转化效率[11],然后电击转化感受态大肠杆菌[12].从得到的转化子中随机挑选96个克隆,LB液体培养后,通过碱裂解法抽取BAC质粒,酶切后进行脉冲场电泳,以确定插入片段的大小.
1.2.2 阳性克隆的筛选
根据CH34的2个苯酚降解基因簇的大亚基分别设计了2对引物,其中用于筛选长簇的引物序列为 ch1f(5'-AACGCACTCAAGGTGTTTATCCAGG-3'),ch1r(5'-GCGAAGGTCTGATGGCTGATGTG-3'),用于筛选短簇的引物序列为ch2f(5'-CCTGTCCGTGCCGAAGTCGTATTT-3'),ch2r(5'-CAGAAGTGGTAGTGCTCGCCGTTG-3').从BAC文库中随机挑选约3 000个克隆,通过碱裂解法抽取BAC质粒,PCR扩增后进行琼脂糖电泳,根据是否出现单一的目的条带来筛选阳性克隆.
1.2.3 完整插入的阳性克隆挑选
对筛选到的5个含有长簇的阳性克隆以及4个含有短簇的阳性克隆分别抽取BAC质粒,用ScaⅠ酶切后进行琼脂糖电泳.根据切开的条带大小,与2个降酚基因簇的酶切图谱进行对照,各自挑选一个完整插入该簇的克隆,用于后续的功能分析.
1.2.4 阳性克隆的功能分析
把2个含有长短降酚基因簇的阳性克隆,分别接种到以苯酚为唯一碳源,且含有不同质量浓度梯度苯酚的无机盐培养基中,其中苯酚的质量浓度分别为50,100,200,500,800 mg/L.每个克隆进行3次平行实验,取平行实验的平均值作为实验数据.每隔24 h取一次样,测菌液的OD600以确定菌体浓度.用改进的4-氨基安替比啉法测定菌液中的苯酚质量浓度[13]:取菌液离心上清液80 μL于10 mL离心管中,加蒸馏水至4 mL,混匀后先后加入80 μL 2%的4-氨基安替比林溶液和80 μL 8%的铁氰化钾溶液,混匀后测定其在500 nm处的吸光值.根据苯酚质量浓度标准曲线获知样品中剩余苯酚的量,计算菌体对苯酚的利用率.当菌体浓度开始下降,即培养基中的苯酚利用殆尽时,终止取样.
2 结果与分析
2.1 文库的构建与鉴定
由于菌株CH34基因组的GC含量较高,NotⅠ酶切后产生的条带较多,不便于文库插入片段大小的鉴定.通过对CH34基因组的分析,为了更方便准确地确定文库插入片段的大小,选用XbaⅠ进行酶切,并对该文库插入片段的大小进行了鉴定,结果如图1所示,其中1~25为样品编号,M为1 kb Marker.鉴定时,随机挑取96个克隆.酶切结果表明,98%的克隆含有插入片段,插入大小分布在20~120 kb之间,平均大小约为30 kb,其中约有61%的克隆插入片段大于50 kb.根据平均插入片段(约30 kb)和文库的总容量(约3万克隆)计算,此文库覆盖了约9 000 Mb的基因组序列.根据CH34基因组7.25 Mb大小估算,此文库约覆盖了CH34基因组的1 240倍.
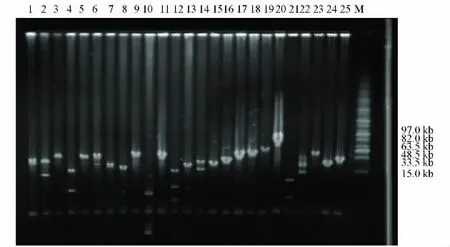
图1 C.metallidurans CH34的25个BAC文库克隆XbaⅠ酶酶切图谱Fig.1 XbaⅠrestriction map of the 25 clones from the BAC library of C.metallidurans CH34
2.2 文库的筛选
从文库中随机挑选3 000个克隆,并最终得到了5个长簇的阳性克隆(见图2,其中1为负对照,2~6为样品编号,7为正对照,M为100 bp Marker)和4个短簇阳性克隆(见图3,其中1~4为样品编号,5为正对照,6为负对照,M为100 bp Marker).对得到的9个阳性克隆携带的苯酚羟化酶基因进行测序分析,发现与NCBI中已收录的C.metallidurans CH34的苯酚羟化酶基因序列完全一致,这说明本实验构建的BAC文库中的克隆,其插入的基因组序列不会发生突变,具有很好的稳定性.
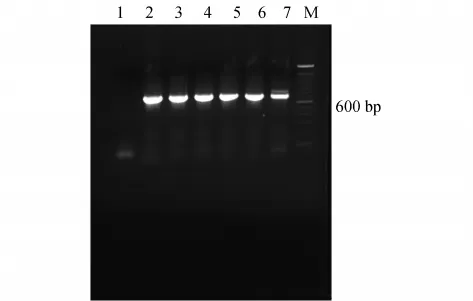
图2 根据长簇的LmPH基因设计引物,筛选到的5个阳性克隆的PCR扩增结果Fig.2 PCR amplification ofthe 5 positive clones according to the LmPH gene on the longer cluster
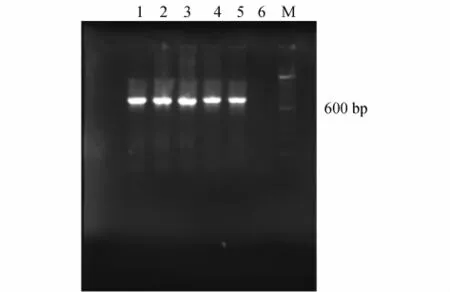
图3 根据短簇的LmPH基因设计引物,筛选到的4个阳性克隆的PCR扩增结果Fig.3 PCR amplification of the 4 positive clones according to the LmPH gene on the shorter cluster
2.3 阳性克隆的选取
9个阳性克隆BAC质粒DNA经ScaⅠ酶切后的电泳结果如图4所示,其中1~5为含有长簇的阳性克隆,6~9为含有短簇的阳性克隆,M为1 kb Marker.CH34长短2个苯酚降解基因簇的酶切位点图谱如图5所示.结果显示,长簇的4号克隆和短簇的2号克隆为拥有完整降酚基因簇的克隆.
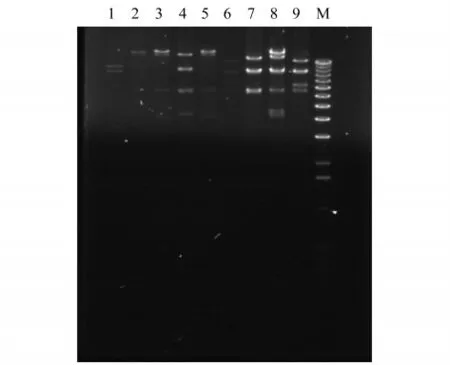
图4 9个阳性克隆经ScaⅠ酶切后的电泳图Fig.4 Electrophoresis of the 9 positive clones digested with ScaⅠ

图5 C.metallidurans CH34长短2个苯酚降解基因簇的酶切位点图谱Fig.5 Restriction map of the 2 phenol-degradating gene clusters from C.metallidurans CH34
2.4 阳性克隆的功能分析
表1为长簇的4号克隆和短簇的2号克隆所转化的大肠杆菌在不同苯酚质量浓度下的生长情况,表2和表3为这2个克隆对苯酚的利用效率.可以看出,2个转化子在苯酚质量浓度较低时生长较好,但当苯酚质量浓度达到800 mg/L时,几乎不生长;在相同苯酚质量浓度下,含有短簇的转化子的生长状况以及苯酚利用情况都优于含有长簇的转化子;2个转化子在苯酚质量浓度较低时,对苯酚的利用率均较高.研究还发现,作为负对照的含有空载BAC质粒的大肠杆菌,在苯酚质量浓度较低时也表现出了一定的苯酚利用率,推测可能大肠杆菌本身就具有一定的苯酚耐受性.
3 结束语
本研究构建的BAC文库覆盖了C.metallidurans CH34基因组约1 240倍,具有很好的覆盖率,适合用于基因簇大片段的克隆和鉴定,为深入研究多套降酚基因簇在大肠杆菌细胞内的表达(例如,存在拮抗还是促进作用)打下了坚实的基础.
从结果上看,含有长簇和短簇的转化子在含有较低质量浓度的苯酚培养基中,降酚能力均较好,但随着苯酚质量浓度的升高,其生长能力及降酚效率都出现了降低,表明CH34苯酚降解基因簇在大肠杆菌中表现为低质量浓度苯酚耐受性.在相同苯酚质量浓度下,短簇转化子的降酚能力强于长簇,可能是由于长簇上存在多个编码反式抑制因子的基因,阻碍了苯酚降解基因的转录.此外,从这2个簇的序列和基因排布上看,它们存在很大的差异,且长簇的一侧重复出现了部分降解基因PLMN等.因此,本研究通过构建BAC文库,克隆到2个完整的苯酚降解基因簇,并研究其在大肠杆菌中对苯酚的利用效率,从而能够较直观地反映两簇的整体降酚能力.今后的研究将深入探讨2个簇之间的互作关系,通过选择合适的载体,把2个苯酚降解基因簇连到同一载体上,比较所得转化子与只含有一个簇的转化子在降酚能力方面的差异,从而确定这2个簇之间是否存在促进或拮抗的相互作用.
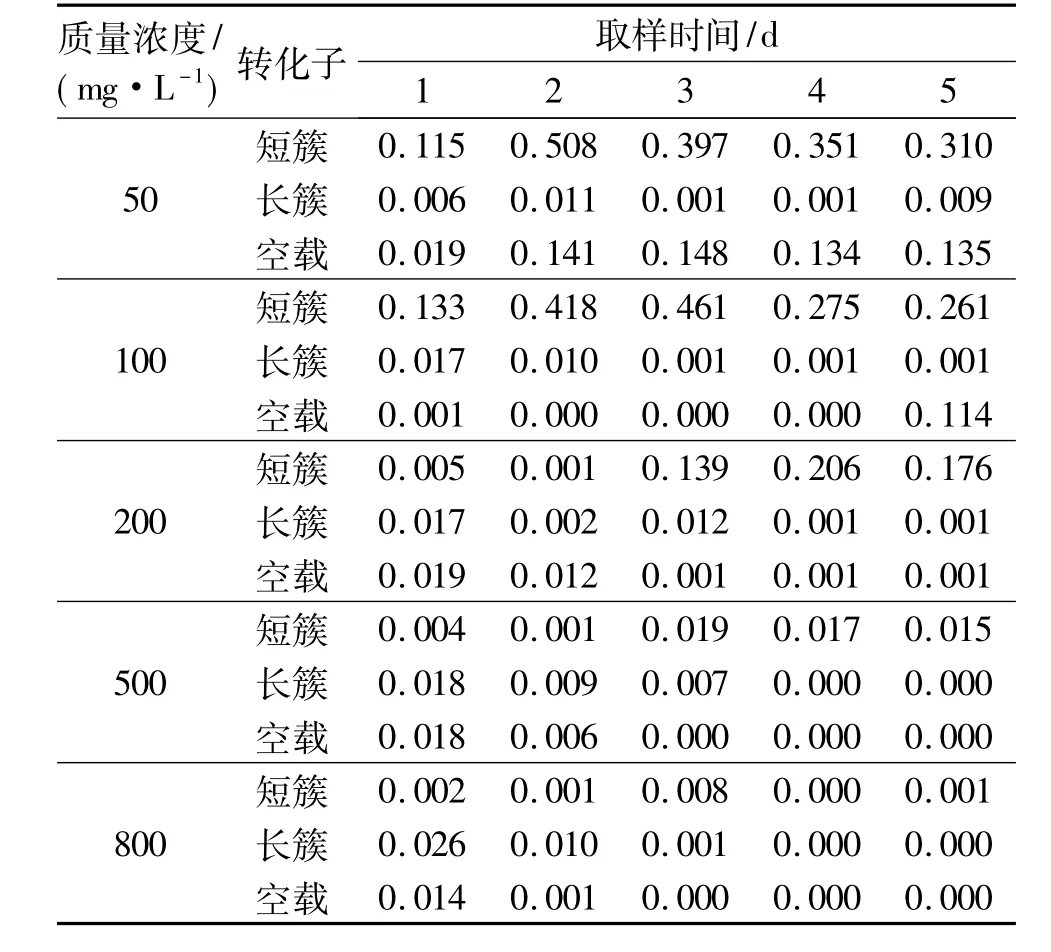
表1 2个阳性克隆在不同苯酚质量浓度下的生长情况(OD600)Table 1 Growth of the 2 positive clones in different phenol concentrations(OD600)
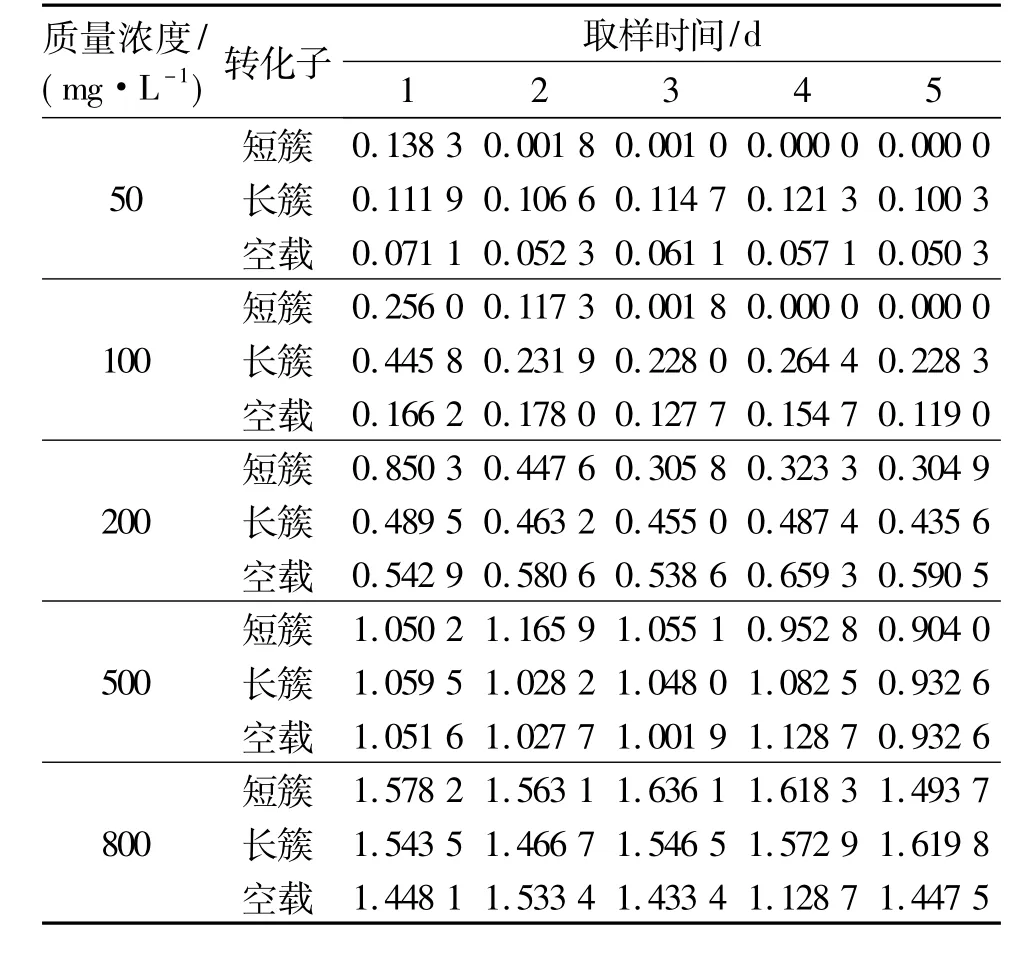
表2 2个阳性克隆在不同苯酚质量浓度下对苯酚的利用情况(OD500)Table 2 Phenol utilization of the 2 positive clones in different phenol concentrations(OD500)
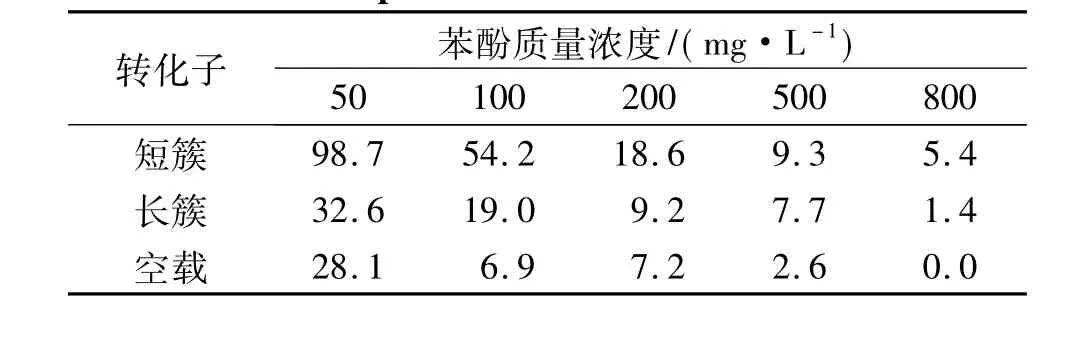
表3 2个阳性克隆在不同苯酚质量浓度下对苯酚的降解效率Table 3 Degradation efficiency of the 2 positive clones in different phenol concentrations %
[1] HARAYAMAS,TIMMISK N.Aerobic biodegradation of aromatic hydrocarbons by bacteria[M]∥SIGELH,SIGELA.Metal ions in biological systems.New York:Marcel Dekker Inc,1992:99-156.
[2] 徐玉泉,张维,陈明,等.醋酸钙不动杆菌PHEA-2的16SrDNA测序及其苯酚降解特性研究[J].高技术通讯,2000,10(3):12-14.
[3] 高振贤,马宏,贾振华.R.metallidurans CH34苯酚降解特性的研究[J].微生物学通报,2005,32(1):42-47.
[4] 宋水山,段普凡,贾振华,等.R.metallidurans CH34苯酚、甲苯降解基因的生物信息学分析[J].河北省科学院学报,2003,20(4):245-251,262.
[5] OSOEQAWAK,WOONP Y,ZHAOB,et al.An improved approach for construction of bacterial artificial chromosome libraries[J].Genomics,1998,52(1):1-8.
[6] KIMU J,SHIZHIYAH,DE JONGP J,et al.Stable propagation of cosmid sized human DNA inserts in an F factor based vector[J].Nucleic Acids Res,1992,20 (5):1083-1085.
[7] SHIZUYAH,BIRRENB,KIMU J,et al.Cloning and stable maintenance of 300-kilobase-pairfragmentof human DNA in Escherchia coli using an F-factor-based vector[J].Proc Natl Acad Sci USA,1992,89(18):8794-8797.
[8] KIMU J,BIRRENB W,SLEPAKT,et al.Construction and characterization ofa human bacterialartificial chromosome library[J].Genomics,1996,34(2):213-218.
[9] LUOM,WINGR.An improved method for plant BAC library construction[M].Totowa,NJ:Humana Press Inc,2003:3-20.
[10] AUSUBELF M,BRENTR,KINGSTONR E,et a1.Short protocols in molecular biology[M].3rd ed.New Jersey:John Wiley&Sons,1995.
[11] XUM L,SONGJ Q,CHENGZ K,et al.A bacterial artificial chromosome(BAC)library of Malus floribunda 821 and conting construction for positional cloning of the apple scab resistance gene VF[J].Genome,2001,44 (6):1104-1113.
[12] ZHANGH B,CHOIS,WOOS,et al.Construction and characterization of two rice bacterial artificial chromosome libraries from the parents of a permanent recombinant mapping population[J].Mol Breed,1996,2(1):11-24.
[13] 国家环保局《水和废水监测分析方法》编委会.水和废水监测分析方法[M].北京:中国环境科学出版社,1997:408-410.

