灵芝黄芪复配物提高环磷酰胺对荷瘤小鼠的疗效
张佳俊, 廖鲜艳, 翁新楚
(上海大学生命科学学院,上海200444)
肿瘤疾病对人类健康的危害日趋严重,如何通过有效措施防治肿瘤已成为全球的热点课题.目前,手术治疗、化学药物治疗及放射治疗仍是肿瘤疾病治疗的主要手段.但是,手术治疗给机体带来的创伤性,放射治疗时射线对机体正常细胞活力的严重损伤以及化学药物对机体造成的免疫系统损害,都限制了肿瘤的治疗效果,也给病患带来了巨大的身体痛楚和精神压力.
鉴于上述肿瘤治疗方法的毒副作用,将有益于机体健康的中草药与之联合的综合治疗手段已受到越来越多地重视.灵芝(Ganoderma lucidum)作为我国具有悠久历史的名贵中草药,在对肿瘤的联合治疗方面效果突出.陈小君等[1]的研究表明,将中药灵芝孢子粉与抗肿瘤西药环磷酰胺联合作用于肝癌荷瘤小鼠,不仅能明显增强环磷酰胺的抑瘤效用,同时可减轻因其造成的小鼠脱毛和松毛现象.张东健等[2]将以灵芝为主要成分的灵芝扶正胶囊运用于食道癌、胃癌、结肠癌、肝癌、肺癌、乳腺癌、恶性淋巴瘤、卵巢癌等癌症患者的临床治疗中,发现该胶囊可改善大部分患者的治疗状况,减轻化疗药物所致的恶心呕吐现象和免疫力降低等副作用,有效提升了患者的生活质量.虽然灵芝具有较佳的辅助化学药物对肿瘤进行治疗的作用,但因其较高的原料价格和较低的提取物得率,使得灵芝提取物的成本昂贵,给使用者带来了巨大的经济负担.因此,获得成本低廉、肿瘤治疗效果与灵芝提取物相当的中药及其复配物就显得尤为重要.
黄芪(Astragalus)性微温、味甘、入脾、归肺经,可补诸虚不足,益元气、壮脾胃、去肌热、排脓止痛、活血生血[3].黄芪因其较佳的滋养补虚功效和较便宜的市场价格深受人们的喜爱.将黄芪和灵芝制成复配物,在达到与等量单味灵芝相近的治疗剂量时,能大大降低单味灵芝的使用成本,具有巨大的经济价值.因此,利用成本低廉的黄芪提取物代替部分灵芝提取物,在提高环磷酰胺对荷瘤小鼠的疗效上能否与单味灵芝相当,灵芝和黄芪两味中药之间是否存在协同效应,是本工作的主要研究内容.本工作将灵芝、黄芪及其复配物分别与抗肿瘤西药共同作用于S180荷瘤小鼠,研究其抗肿瘤作用以及提高机体免疫、减轻化学药物免疫副作用的能力,为灵芝黄芪复配物的辅助肿瘤治疗及复健保健作用提供重要资料.
1 实验部分
1.1 实验材料
实验动物:体重20±2 g昆明种雄性小鼠,体重25±2 g昆明种雌雄性小鼠,S180腹水瘤小鼠均购自上海斯莱克实验动物有限责任公司,许可证号为SCXK(沪)2007-0005.
药品与试剂:灵芝精粉,福州东星生物技术有限公司;黄芪总提取物,实验室自制;环磷酰胺(CTX),江苏恒瑞医药股份有限公司;其他试剂均为分析纯,国药集团化学试剂有限公司.
仪器:KX-21N型血常规分析仪,希森美康医用电子有限公司;CA-920-3型超净工作台,上海上净净化设备有限公司;MP200B电子分析天平,上海亿测电子设备有限公司;DK-S22电热恒温水浴锅,上海精宏试验设备有限公司;RE-85Z旋转蒸发仪,上海青浦沪西仪器厂;SHZ-3循环水真空泵,上海锦旻科学仪器有限公司.
1.2 实验方法
1.2.1 黄芪总提取物的提取
本实验采用95%乙醇索氏提取和水热回流两步提取法.将黄芪加工成粉粒状,过60目筛,以95%乙醇为溶剂,固液比为1∶10,置索氏提取器中提取;待提取溶剂接近于无色后,取出提取液,减压蒸馏挥干溶剂.上述提取残留物用10倍水量热回流提取,提取温度为90℃,分别提取2次,每次提取时间为3.5 h;合并提取液,减压蒸馏回收溶剂.合并95%乙醇和水部位提取物,得到黄芪总提取物,计算得率.
1.2.2 灵芝黄芪复配物的急性毒性实验
遵循《药理实验方法学》[4]的规定,采用急性毒性限量实验法.以10 g/kg小鼠体重的灵芝黄芪复配物灌胃小鼠,记录小鼠2周内的生活、中毒和死亡情况.
1.2.3 S180荷瘤小鼠模型制备
取7~8 d左右的S180腹水瘤小鼠,拉颈椎处死,置于75%乙醇溶液中.在无菌条件下吸取瘤液,无菌生理盐水稀释至2×107后,接种于小鼠右前肢腋窝皮下,剂量为0.1 mL/只,建立S180荷瘤小鼠模型.
1.2.4 动物分组及给药方法
将小鼠随机分为8组:①灵芝+CTX组,②黄芪+CTX组,③灵芝黄芪复配物低剂量+CTX组,④灵芝黄芪复配物中剂量+CTX组,⑤灵芝黄芪复配物高剂量+CTX组,⑥单CTX组,⑦模型组,⑧正常组.每组有8只小鼠,其中①~⑤组于小鼠腋下注瘤24 h后,每日灌胃相应中药.①组、②组和④组的给药剂量皆为500 mg/kg;③组和⑤组的给药剂量分别为250和1 000 mg/kg;⑥组灌胃等剂量生理盐水.除此以外,①~⑦组每日同时腹腔注射CTX,剂量为30 mg/kg.以上各组处理时间相同.
1.2.5 检测指标
14 d后,将小鼠摘眼球取血,测定小鼠外周血白细胞(WBC)数和红细胞(RBC)数.解剖小鼠,取小鼠脾脏和胸腺,测定小鼠脾指数和胸腺指数.剥瘤,记录小鼠肿瘤重量,并计算抑瘤率.各检测指标计算如下:
抑瘤率(%)=(模型组平均瘤重-各药物组平均瘤重)/模型组平均瘤重×100%;
脾指数(mg/g)=小鼠脾重(mg)/小鼠体重(g);
胸腺指数(mg/g)=小鼠胸腺重(mg)/小鼠体重(g).
1.2.6 统计方法
本研究采用mean±SD表示数据,各组数据间用t检验判断其差异显著性,其中若P<0.05,表示有显著性差异;P<0.01,表示有极显著性差异.
1.3 实验结果
1.3.1 黄芪总提取物的提取
经95%乙醇索氏提取和水热回流两步提取法,可得黄芪总提取物的提取率为39.1%.
1.3.2 灵芝黄芪复配物的急性毒性实验
小鼠经灵芝黄芪复配物灌胃后,14 d内体重增长正常,毛色光亮,活动自如,行为、精神状态正常,摄食饮水情况良好,无震颤、扭体及翘尾,鼻、眼、口腔无异常分泌物,未出现其他不良反应、毒性反应和死亡情况.14 d后断颈处死,经解剖和尸检未发现内脏器官异常.以上结果表明,灵芝黄芪复配物在治疗剂量范围内是安全、无毒的.
1.3.3 灵芝黄芪复配物联合CTX对小鼠肿瘤的影响
如表1所示,与模型组相比,各中药联合CTX组及单CTX组皆能显著抑制小鼠移植性S180肉瘤的生长(P<0.01),显示出CTX在抗肿瘤作用中的优势.而与单CTX组74.6%的抑瘤率相比,各灵芝黄芪中药复配物显示出了不同程度的抑瘤增效作用,具有一定的剂量依赖性,其中以灵芝黄芪复配物中、高剂量联合CTX组抑制小鼠S180肉瘤生长的效果较佳,其抑瘤率分别达到了82.0%和84.4% (P<0.01).灵芝素来有抗肿瘤佳品的美称,在本研究中,其辅助CTX对小鼠S180肉瘤的抑瘤率可达至82.4%.等剂量的灵芝黄芪复配物,虽用抗肿瘤效果相对较弱的黄芪代替了部分灵芝,但82.0%的抑瘤率仍与单味灵芝相当,组间无显著性差异.
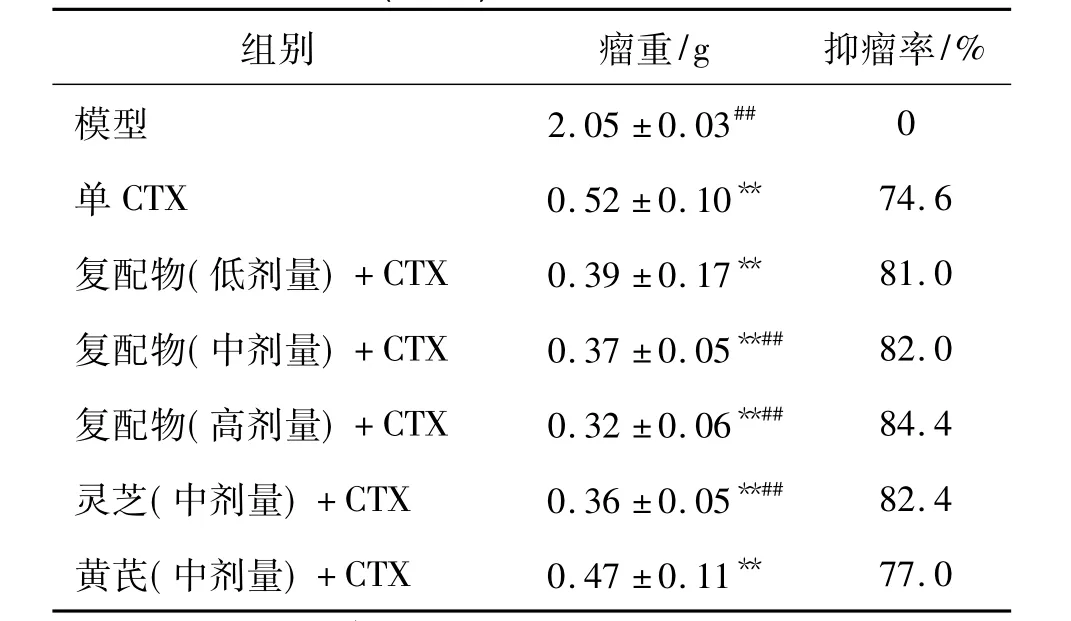
表1 灵芝黄芪复配物协同CTX对小鼠抑瘤率的影响(n=8)Table 1 Effects of the compound of Ganoderma lucidum and Astragalus extracts on tumor of mice cooperated with CTX(n=8)
1.3.4 灵芝黄芪复配物联合CTX对小鼠免疫器官的影响
如表2所示,各中药联合CTX组以及单CTX组的胸腺指数皆低于模型组(P<0.01),证明了CTX的存在所造成的小鼠机体免疫副作用——胸腺萎缩.与单CTX组1.14 mg/g的胸腺指数相比,灵芝黄芪复配物中、高剂量联合CTX组皆可极显著地缓解CTX的副作用,使其胸腺指数分别达到了1.63和1.58 mg/g(P<0.01).此外,由表2还可看到,灵芝黄芪复配物中剂量联合 CTX组的胸腺指数为1.63 mg/g,甚至高于单味灵芝联合 CTX组的1.58 mg/g,体现出了灵芝黄芪复配物在缓解CTX对小鼠胸腺免疫副作用上的优势.
在小鼠脾指数上,CTX的存在同样会造成小鼠的脾脏损伤,使各中药联合CTX组以及单CTX组的脾指数低于模型组(P<0.05).与单CTX组相比,灵芝黄芪复配物联合CTX各组可剂量依赖性地增大小鼠的脾指数,其中灵芝黄芪复配物高剂量联合CTX组的脾指数为 8.63 mg/g,与单 CTX组的6.87 mg/g相比,具有显著差异性(P<0.05),而其他各组则未能明显地表现出对CTX损伤的缓解作用.
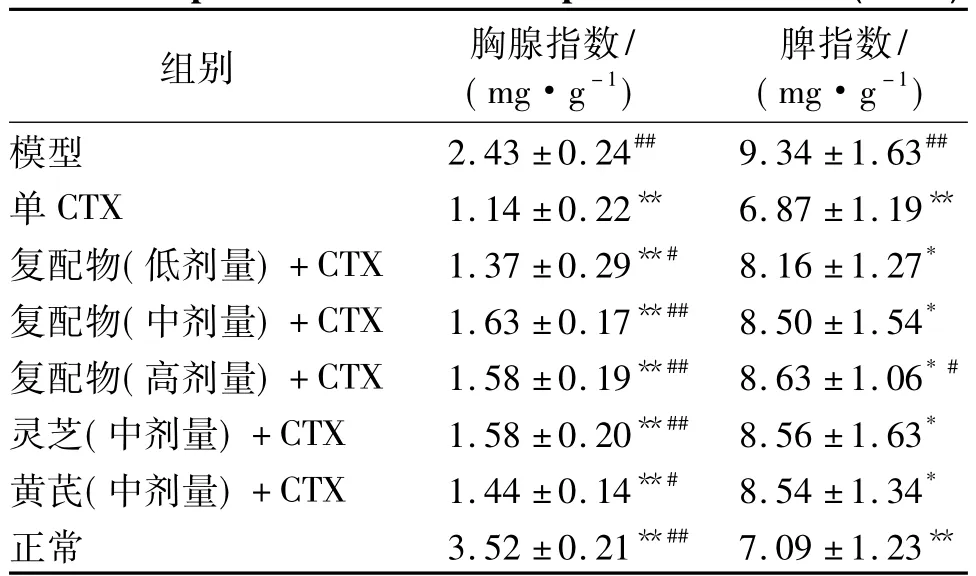
表2 灵芝黄芪复配物协同CTX对小鼠脾指数和胸腺指数的影响(n=8)Table 2 Effects of the compound of Ganoderma lucidum and Astragalus extracts on the thymus index and spleen index of mice cooperated with CTX(n=8)
1.3.5 灵芝黄芪复配物联合CTX对小鼠白细胞数和红细胞数的影响
如表3所示,各中药联合CTX组以及单CTX组均能显著降低小鼠血液的白细胞数(P<0.01)和红细胞数(P<0.05),证明了CTX在治疗过程中会造成机体的白细胞和红细胞减少症.而灵芝黄芪复配物联合CTX组能剂量依赖性地缓解CTX的此种免疫副作用,其高剂量组在增加机体血液白细胞数和红细胞数上皆具有显著性差异(P<0.05).另外,灵芝黄芪复配物中剂量联合 CTX组的白细胞数5.08×109/L和红细胞数6.60×1012/L,均略低于等剂量的单味灵芝联合 CTX组的5.10×109/L和6.61×1012/L,证明了其在减轻由CTX所造成的白细胞和红细胞减少症上可媲美单味灵芝组.
2 讨论
灵芝、黄芪皆为我国名贵中草药,根据其中药特点和市场情况,将二者制成中药复配物,具有药性协同的潜力和巨大的经济效益.基于此目的,本实验室一直致力于灵芝黄芪复配物抗肿瘤和免疫调节的研究.通过前期大量的筛选实验,本实验室选出了实验中灵芝黄芪复配物抗肿瘤和免疫调节的最佳比例,应用于本实验研究中.
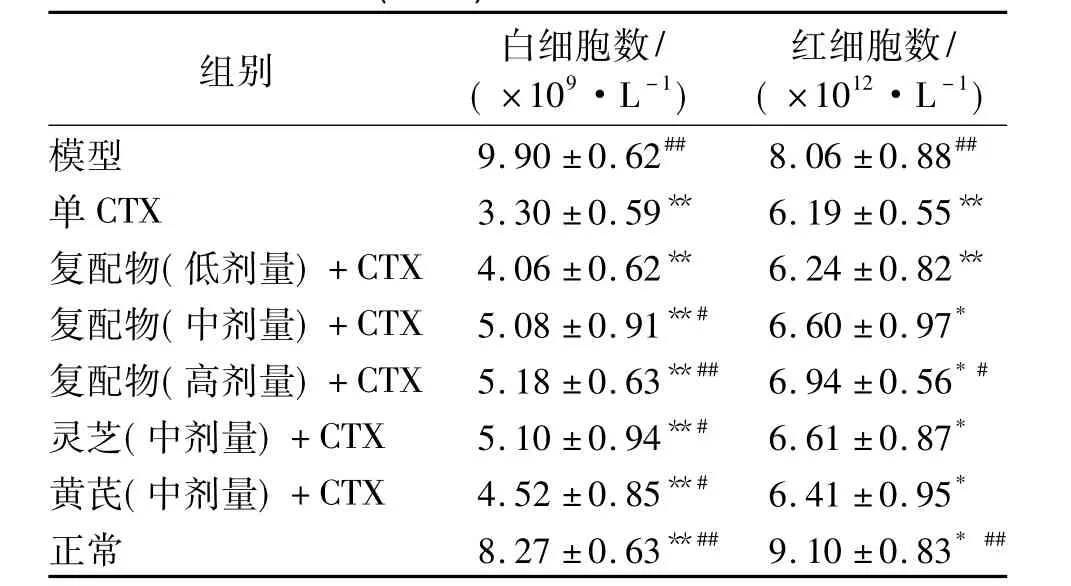
表3 灵芝黄芪复配物协同CTX对小鼠白细胞数和红细胞数的影响(n=8)Table 3 Effects of the compound of Ganoderma lucidum and Astragalus on extracts the amounts of the white blood cells and red blood cells in mice cooperated with CTX(n=8)
脾脏和胸腺是机体两大免疫器官,在机体的免疫调节和免疫因子分泌方面不可获缺.白细胞和红细胞是机体主要的免疫活性细胞,二者共同在抗御病原的入侵和对疾病的免疫方面起着重要作用.本研究表明,灵芝黄芪复配物可不同程度地增加CTX治疗的荷S180肉瘤小鼠的胸腺指数、脾指数、白细胞数和红细胞数等免疫指标,反映出了复配物对机体免疫功能的提升作用.机体免疫功能的增强,为肿瘤的防治以及化疗药物毒副作用的减轻创造了一个较好的内环境.机体正气内存,邪不干正,这也可能是灵芝黄芪复配物具有较佳抑瘤效果的重要因素之一.
此外,本研究证明了单味黄芪组在辅助CTX抗肿瘤及在CTX治疗中,提高小鼠免疫指标的效果皆不如单味灵芝组.但是,将治疗效果较弱的黄芪代替部分灵芝制成灵芝黄芪复配物后,却在上述肿瘤和免疫指标上可媲美同剂量的单味灵芝组,组间无显著性差异,这表明灵芝和黄芪两味中草药之间产生了一定的协同作用.对此,我们推测可能有以下两方面的原因.
首先,此作用可能与灵芝、黄芪两味中药在肿瘤防治和减轻化疗药物毒副作用上具有不同的作用偏向性有关.灵芝在肿瘤治疗中与其三萜类物质的效用密不可分[5].Gonzalez等[6]的研究表明,灵芝中的三萜类物质对肿瘤细胞具有细胞毒性作用,可以直接杀灭肿瘤细胞,是灵芝抑制肿瘤生长的重要因素.黄芪作为一种滋补壮气类中药,充分体现出了中医扶正固本的特点,其主要活性成分皂甙、黄酮和多糖类成分能够促进机体抗体生成和体液免疫细胞增殖,增强单核巨噬细胞的吞噬能力,促进自然杀伤细胞和淋巴细胞相应补体受体的活性,通过诱导干扰素的生成,从多方面地调节机体的免疫能力[7-9],保持机体整体的健康活力.将黄芪和灵芝制成复配物,灵芝偏向“驱邪”,黄芪偏向“扶正”,驱邪扶正,齐头并进,互补互成,从而有效地提高了单味中药抑制肿瘤生长的功效,产生了一定的协同作用.祝绚等[10]将具有免疫活性的云芝糖肽和对多种肿瘤细胞具有细胞毒性的丹参酮ⅡA运用于荷瘤小鼠的肿瘤治疗中,也发现其复配物具有一定的协同作用,且其作用机理与本实验中的灵芝黄芪复配物相似.
其次,王丹花等[11]研究表明,灵芝精粉氯仿提取物能够显著抑制肝癌细胞BEL-7402和胃癌细胞MGC-803的生长,具有较强的抑癌活性.为了追踪灵芝精粉中的抗癌活性物质,陆易等[12]还对灵芝精粉进行了分离纯化,得到了偏脂溶性的单体灵芝萜烯酮醇和麦角甾7-22二烯3β醇.药理研究发现,该化合物不仅能增强抗肿瘤药物顺氯氨铂抵抗BEL-7402细胞的能力,具有正协同作用,还能促进人微血管细胞HMEC的增长,促进人体健康.因此,将黄芪加入到灵芝中,从极性角度考虑,黄芪中的主要成分皂甙和黄酮化合物可能有利于溶解灵芝中的这些具有抗肿瘤效用的脂溶性有效成分,如灵芝三萜醇、灵芝酸等,从而加强了这些成分在机体内的分散和吸收,这可能也是灵芝黄芪复配物具有辅助CTX抗肿瘤疗效的又一原因.
3 结束语
灵芝黄芪复配物对CTX的抑瘤具有显著的增效减毒作用,其抑制小鼠S180肉瘤生长及减轻CTX免疫副作用的效果堪比同剂量的单味灵芝组,这为开发具有辅助作用且价格低廉的抗瘤保健品提供了依据.
[1] 陈小君,史泓浏,冯翠萍,等.灵芝孢子粉与环磷酰胺联合使用抑瘤作用的实验研究[J].现代肿瘤医学,2005,13(1):64-66.
[2] 孙东健,李威,张文高,等.灵芝扶正胶囊对恶性肿瘤放疗及化疗减毒增效作用的临床疗效观察[J].滨州医学院学报,1999,22(2):141-142.
[3] 李时珍.本草纲目[M].昆明:云南教育出版社,2010:300-324.
[4] 徐叔云,卞如濂,陈修.药理实验方法学[M].3版.北京:人民卫生出版社,2002:220-228.
[5] LINS B,LIC H,LEES S,et al.Triterpene-enriched extractsfrom Ganoderma lucidum inhibitgrowth of hepatoma cells via suppressing protein kinase C,activating mitogen-activated protein kinases and G2-phase cell cycle arrest[J].Life Sci,2003,72:2381-2390.
[6] GONZALEZA G,LEONF,RIVERAA,et al.New lanostanoids from the fungus Ganoderma concinna[J].J Nat Prod,2002,65:417-421.
[7] LEEY S,HANO K,PARKC W.Immunomodulatory effects of aqueous-extracted Astragali radix in methotrexate-treated mouse spleen cells [J]. J Ethnopharmacol,2003,84(2):193-198.
[8] 聂紫雯,魏强华.黄芪免疫调节机制及临床应用进展[J].中国中医药信息杂志,2009,16(8):103-104.
[9] 邵佳,骆殊.黄芪对免疫系统的作用研究进展[J].北京中医药,2008,27(4):306-308.
[10] 祝绚,鲍依稀,李进,等.云芝糖肽、丹参酮ⅡA对荷瘤小鼠的抗肿瘤及免疫调节作用[J].中国免疫学杂志,2008(6):526-529.
[11] 王丹花,翁新楚.灵芝抗癌活性及放化疗对HL-7702细胞的保护作用[J].中国中药杂志,2006(19):1618-1622.
[12] 陆易,翁新楚.赤芝中脂溶性化合物的体外抗肿瘤活性[J].精细化工,2007,24(8):772-776.

