载药动脉栓塞微球DC BeadTM研究进展
金雪锋,许 颖,沈晓兰,陈祥峰,宗在伟
1江苏奥赛康药业股份有限公司,南京 211112;2江苏大学药学院药物制剂教研室,镇江 212013
肝细胞癌(Hepatocellular carcinoma,HCC)是最常见的原发性肝癌,是世界第三大癌症死因。2008年,全球约696000名患者死于该症[1]。在我国,HCC发病率及死亡率均居世界前列。目前,手术切除仍是早期HCC首选的治疗手段[2]。但是,HCC早期症状常常不明显,隐匿性较高,绝大多数患者就诊时已临癌症中晚期,失去了手术治疗的最佳时期;此外,受肝功能状况、病变部位及病人全身疾病等因素影响,病人可能无法耐受切除手术。因此,非手术方法,如介入治疗(Interventional treatment),就成为治疗HCC的重要手段[3]。经导管肝动脉化疗栓塞术(Transarterial chemoembolization,TACE)是公认的介入治疗中晚期HCC的有效方法[4]。TACE结合了肝动脉栓塞(Transarterial embolization,TAE)和局部化疗两种治疗技术优势,理想的TACE应使肿瘤部位维持长时间的高药物浓度,同时使体循环中药物浓度降至最低[5]。但传统的TACE常用碘化油与化疗药物混合给药,所用的化疗药物往往为水溶性,其在碘化油中相容性差,经肝动脉给药后,大部分药物从碘化油中迅速释放并进入体循环[6],存在较高的全身不良反应风险;另外,大量的碘化油可导致肝脏薄壁组织或者胆管的损伤[7-8]。载药洗脱微球(Drug-eluting beads,DEB)作为TACE治疗的一种新的药物递送系统克服了传统制剂的不足,其可在肿瘤部位持续而缓慢的释放药物,使药物在病灶部位长时间维持有效的细胞毒浓度,同时可降低全身血药浓度水平。DEB长期以来一直受到国内外研究者的普遍关注,但目前成功上市的载药栓塞微球仅有DC Bead和Hepasphere,两者均可负载阿霉素(Doxorbicin)用于肝癌的治疗(分别为Biocompatibles公司和BioSphere公司产品)。DC Bead-阿霉素是最早获得上市的产品。本文就DC Bead近年来研究内容予以综述,为同类产品的开发提供借鉴。
1 DC Bead制备方法
DC Bead采用反相悬浮自由基聚合法(Inverse suspension free-radical polymerisation)制备[9]。主要过程(图 1)如下:聚乙烯醇[Poly(vinyl alcohol),PVA]经N-丙烯酰-氨基乙醛-二甲基缩醛(N-acryloyl-aminoacetaldehyde dimethylacetal,NAAADA)修饰后的大分子单体与另一单体2-丙烯酰胺基-2-甲基丙磺酸钠 (2-acrylamido-2-methylpropanesulphonate sodium salt,AMPS)的混合水溶液混悬于醋酸丁酯,该W/O体系以醋酸丁酸纤维素(Cellulose acetate butyrate)维持稳定,防止絮凝及沉积。过硫酸钾与四甲基乙烯二胺(Tetramethylethylenediamine,TMEDA)组成氧化-还原引发体系,前者溶于水相,后者在混悬液加热至60℃后加入油相。TMEDA一旦加入,聚合过程即被引发,各单体交联,形成水溶胀型网络结构球体,即DC Bead。制得DC Bead的粒径及分布与稳定剂用量、PVA分子量及浓度有关。稳定剂用量越高,微球粒径越小,分布也较集中;而PVA分子量或浓度越大,微球粒径越大,分布也越宽。控制不同的聚合条件,即可制得不同粒径的DC Bead。Biocompatibles公司的产品有多种不同粒径,分别为700~900 μm(绿色)、500~700 μm(红色)、300~500 μm(蓝色)、100~300 μm(黄色)以及更小的尺寸70~150 μm。
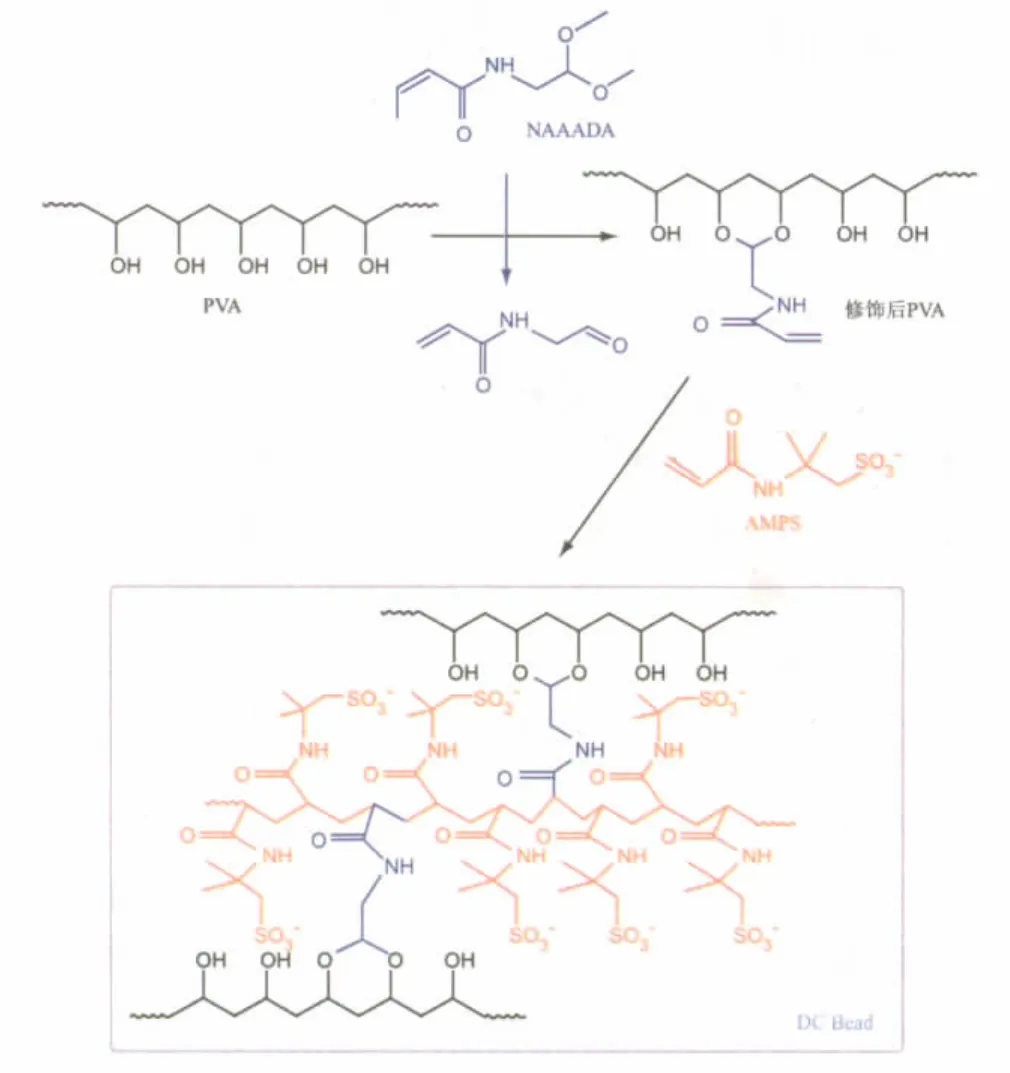
图1 DC Bead合成示意图
2 载药机理与性质特征
DC Bead一般在临用前与药物混合实现载药。DC Bead网络结构中的阴离子型磺酸基团可与荷正电药物通过库仑力相互吸引而结合。可负载的药物有阿霉素[10]、伊立替康(Irinotecan)[11]、拓扑替康(Topotecan)[12]、表柔比星(Epirubicin)[13]等。这些药物的共同特点是分子结构中含亲核基团,可结合H+而荷正电。市售水溶胀后的DC Bead 1 mL最大约可负载40 mg盐酸阿霉素,但超过37.5 mg·mL-1的负载量时,达到99%的包封率所需时间将急剧增加(图2)[10]。临床使用时,DC Bead对盐酸阿霉素的负载量不超过37.5 mg·mL-1,否则,可能因为药物负载不完全导致游离药物浓度过高而增加全身不良反应的风险[14]。不难理解,DC Bead对药物的负载量与交联分子链中磺酸基团的数量有关,同样体积的DC Bead,结构中磺酸基团数目越多,对药物的负载量越高。有研究[10]显示,不同粒径的DC Bead对药物的最大负载量无显著性差异。可见,DC Bead粒径虽有不同,但单位体积的磺酸基团含量基本相同。忽略合成过程中AMPS的损失,1 mL DC Bead约含磺酸基团7.7×10-5mol[15]。

图2 单位体积的Bead中投入阿霉素的质量(阿霉素目标负载量)对实际负载量的影响(□);实现≥99%包封率所需时间(●)(mean,n=6)
DC Bead对药物的最大负载量虽不受粒径大小影响,但负载速度却与粒径有关。相同体积的DC Bead,粒径越小,表面积越大,单位时间内吸附结合药物的几率也越大,达到相同的负载量,所需时间就越短。不同粒径DC Bead每1 mL负载25 mg盐酸阿霉素所需时间见表1[16],所有Bead在2小时内均可完成99%的包封率。

表1 不同粒径DC Bead负载阿霉素速率比较
市售DC Bead保存于磷酸钠缓冲溶液中,使用时用注射器抽取并滤除磷酸盐溶液,随后将其与药物溶液混合。否则,磷酸盐解离后的正负离子将影响磺酸基团与药物的结合,降低药物包封率[10]。
载药后的DC Bead粒径将减小;负载量越大,粒径减小越显著。如规格为700~900 μm的Bead对盐酸伊立替康的负载量为20 mg·mL-1时,粒径减小约8%;当负载量增大为50 mg·mL-1,粒径减小约29%[15]。除100~300 μm的Bead外,其他规格Bead在相同的载药量时粒径减小程度接近[10、15]。有学者认为[10]DC Bead载药过程中将释放出原先结合的钠离子,并且原先在离子基团周围结合的水分也将被置换,同时药物的疏水性强弱,决定置换出水分的多少。当盐酸阿霉素的负载量为40 mg·mL-1时,DC Bead将失去10%的水分。由于水分丧失,球体收缩,从而粒径减小。除此之外,笔者认为,DC Bead与药物结合后其内部离子型磺酸基团数目减少,同电荷斥力减弱,聚合物链伸展程度降低,也会导致球体收缩、粒径减小[17-18]。需要注意的是DC Bead体积减小,致使其弹性模量增大,可压缩性减弱,易在管腔内聚集堵塞,不利于微导管输送。
扫描电子显微镜显示DC Bead表面光滑,内核呈海绵状,外层20 μm厚度范围结构致密。荧光显微镜显示DC Bead表面药物分布均匀。激光共聚焦显微镜及拉曼荧光显微镜均显示药物主要分布在DC Bead外层20 μm厚度的结构中[10]。
3 In vitro释放研究方法
DEB的in vitro释放研究方法有两种:USPⅡ法(桨法)及T-apparatus法[19]。对于盐酸阿霉素,前者采用20%(w/v)的氯化钾溶液与乙醇的混合溶液(体积比30∶70)为释放介质,所有粒径的DEB在4小时内即释药完全。该法于加速条件下评价DEB释药特征,未准确模拟DEB体内释放环境,但可便利地为产品开发及质量保证提供数据,计算药物在Bead中的扩散系数。T-apparatus法原理如图3所示[16],该法良好地模拟了栓塞操作后的体内情形,即药物在静态环境下扩散释放。T-apparatus法与DEB in vivo释放行为具有良好的线性相关性[15、19],可较准确地预测DEB in vivo释放结果。
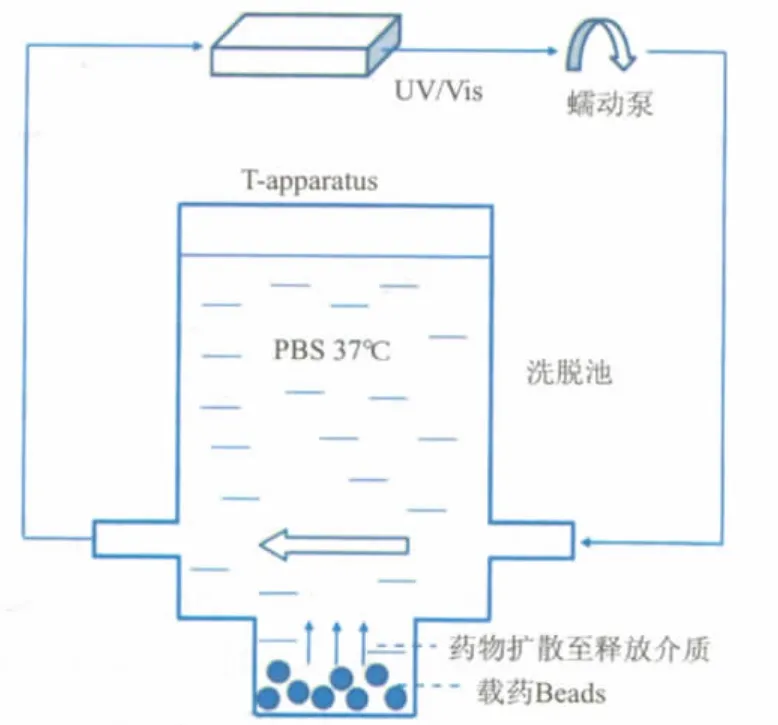
图3 进行载药Bead释放度试验的T-apparatus示意图
DEB通过离子交换机制释放药物[20]。载阿霉素DEB在纯水中基本不释放药物,但随着溶液中离子强度增加(如氯化钠浓度增加),释药速率也逐渐增大。1 mL载25 mg盐酸阿霉素DEB浸润在250 mL 0.45%的氯化钠溶液中,1、5小时分别释放阿霉素约0.22 mg、0.92 mg;而在0.9%的氯化钠溶液中,相同时间分别释放药物约0.45 mg、1.56 mg。USPⅡ法in vitro释放研究结果显示,药物的洗脱常数与Bead粒径相关,同样体积的Bead,粒径越小,表面积越大,释药速率常数越大,药物释放也越快;然而,T-apparatus法研究结果并未显示该规律,其原因在于:USPⅡ法接近漏槽条件,Bead与溶出介质的接触面积成为影响药物释放的重要因素;T-apparatus法使用pH 7.4的磷酸盐缓冲液为溶出介质,体积仅为USPⅡ法的1/4.5,并且Bead周围介质流速较慢,因此药物的溶解度及介质中药物浓度成为影响释放的主要因素[19]。采用T-apparatus法,不同粒径、不同载药量DEB释药速率常数及释药半衰期如表2所示[19]。可见,同样粒径Bead,药物负载量越高,释药速率常数越大,但释药半衰期也大;同样的负载量,100~300 μm的Bead释药半衰期最短,但粒径与释药速率常数及半衰期均无规律性变化关系。
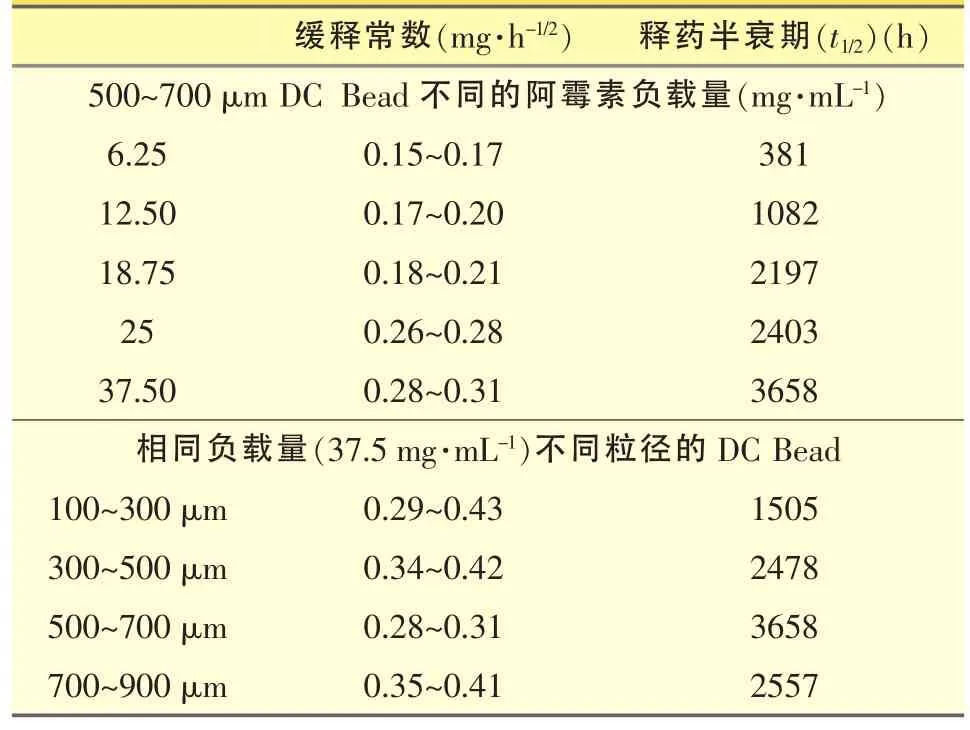
表2 不同负载量或不同粒径载阿霉素DC Bead缓释常数及释药半衰期比较
4 药动学及组织分布
DEB化疗栓塞与传统化疗栓塞法(将阿霉素乳化于碘化油后肝动脉注射,再采用明胶海绵进行栓塞)药动学特征有显著性差异。肝癌患者人体试验显示,DEB化疗栓塞与传统化疗栓塞平均给药剂量分别为(106.4±37.2)mg与(70.0±11.2)mg时,给药5 min之内,两种治疗方法外周血药浓度均达到峰值,但是后者峰浓度为(895.66±653.1)ng·mL-1,前者仅(78.97±38.3)ng·mL-1;给药后7天,传统栓塞AUC (1532.98±295.2)ng·min·mL-1,而 DEB仅(662.6±417.6)ng·min·mL-1。可见,无论外周血峰浓度还是AUC,DEB法均显著低于传统栓塞[6]。由于DEB化疗栓塞法降低了外周血药浓度,从而减少了药物全身不良反应。
DEB在体内具有缓释效应。健康的Yucatan小型猪经阿霉素DEB栓塞后1个月,Bead释放起始负载药量的43%,3个月释放起始药量的89%[21]。在这两个时间点,100~300 μm和700~900 μm不同粒径的Bead释药行为无显著差异,该结论与T-apparatus法体外释放研究结果一致。阿霉素经洗脱后,在离Bead边缘600 μm的范围内进行了浓度检测,距Bead表面越远,组织药物浓度越低。同样的药物负载浓度(37.5 mg·mL-1),不同粒径的Bead周边组织药物浓度也有差异,粒径较小的Bead,由于单一个体药物负载量较小,周边组织药物浓度相应较低。100~300 μm Bead在1、3个月时平均组织药物浓度分别为1.05 μmol·L-1、0.75 μmol·L-1;其显著低于700~900 μm Bead在这两个时间点平均组织浓度(分别为2.05 μmol·L-1、1.25 μmol·L-1)。有资料[22]揭示,肝细胞癌外植体与阿霉素孵育4天,IC50为0.97 μmol·L-1,EC50为3.06 μmol·L-1。以上数据显示不同规格Bead在1个月时周边组织平均阿霉素浓度在此范围。
人肝癌患者进行100~300 μm的阿霉素DEB栓塞后,离体肝脏中Bead周围组织阿霉素含量检测结果显示,药物浸渗到栓塞血管周围至少1.2 mm的直径范围[23]。栓塞后8小时移植离体的肝脏,组织平均药物浓度为5 μmol·L-1;栓塞后9~14天移植离体的肝脏,组织平均阿霉素浓度为2.10 μmol·L-1;而栓塞后1月移植离体的肝脏,阿霉素平均浓度下降至0.65 μmol·L-1。该药物浓度经时变化过程足以对肿瘤细胞产生细胞毒效应[22]。栓塞后8小时离体肝脏检测结果显示,约有42%的栓塞血管存在于瘤内,而肿瘤内外栓塞血管的药物浓度无显著差异。栓塞后9~14天,约37%的栓塞血管出现坏死;32~36天,约40%的血管坏死,可能由于样本量较少(两者病例数依次为3、2名),两者无显著差异 (P= 0.103);然而在32~36天时,坏死组织与非坏死组织相比,药物渗透更深、局部浓度更大(P=0.003)[23]。
5 临床研究评价
临床I/II期的研究证明了阿霉素DEB的安全性及有效性[24]。I期15名患者,每3名为1组,共5组,依次给予阿霉素25 mg、50 mg、75mg、100 mg、150 mg;II期20名患者均给予150 mg。阿霉素剂量高达150 mg,未见剂量限制性毒性。在30天的治疗期内,治疗相关的综合症发生率为11.4%。依据新的肿瘤治疗评价标准,栓塞后1个月,肿瘤部分缓解率63.3%,完全缓解率6.7%。
Song等[25]研究比较了阿霉素DEB-TACE与传统碘化油TACE对亚洲地区肝细胞癌患者的疗效,结果显示前者比后者具有明显优势。治疗组(20例)与对照组 (20例)Child-Pugh分级大部分为A级(34例),少数为B级(6例)。给药后1个月,依据新的实体肿瘤的疗效评价标准,DEB治疗组总缓解率为85%,传统TACE对照组总缓解率30%(P= 0.001)。大肿瘤 (>5 cm)或者多节结型肿瘤采用DEB治疗的缓解率也显著高于传统TACE(P=0.003与P=0.005)。两者大肿瘤治疗缓解率分别为83%、16%,多节结型肿瘤缓解率依次为83%、25%。阿霉素剂量为50 mg,DEB与传统TACE肝脏毒性无显著差异。
一项在欧洲5个国家共计19个中心开展的前瞻性随机对照研究(PRECISION V)[26]中,纳入了212个肝功能为Child-Pugh A或B级的不可切除的肝癌患者,随机接受DEB-TACE治疗(102例)或传统的TACE治疗(110例)。以6个月肿瘤缓解率为主要评估终点,在总体上DEB-TACE虽优于传统的TACE,但差异无统计学意义(P=0.11);然而,在重症患者(Child-Pugh B级、体能评分1分、双叶病灶或复发性癌症)中,DEB-TACE组表现出了更高的完全缓解率 (25.4%比13.9%,P=0.091)、客观缓解率(52.4%比34.7%,P=0.038)及疾病控制率(63.5%比44.4%,P=0.026)。此外,DEB-TACE显著降低了严重肝毒性(P<0.001)及阿霉素相关的不良反应发生率 (P=0.0001)。该项研究结果显示DEB-TACE治疗肝细胞癌安全、有效,对于晚期重症患者更具优势。
DEB-TACE还使患者在生存期上获益[27]。71名患者,其中45例接受DEB化疗,其余26例接受传统化疗栓塞。两组中位存活期分别为610天(351~868)及284天(4~563;P=0.03)。Okuda分级I期患者,两组存活时间分别为501天(421~528)及354天(148~560;P=0.02)。Child-Pugh分级A或B的患者,两组存活时间分别为641天(471~810)及323天(161~485,P=0.002)。CLIP(Cancer of Liver Italian Program)评分≤3的患者,中位生存期依次为469天(358~581)及373天(195~551,P=0.03)。依据NCI CTCAE 3.0毒性评级区分,第5级临床毒性两者相似。最近的一份研究[28]显示,104名患者 (除1名外,其余肝硬化,62.5%丙型肝炎,95% Child-Pugh为A级;癌症分期BCL-A期41名,B期63名)接受DEB-TACE治疗,总体中位存活期为48.6个月,BCLC-A为 54.2个月,BCLC-B为47.7个月。
6 问题与展望
DEB用于不可切除的HCC治疗,6个月的完全缓解率及部分缓解率为44%~80.6%[29],但仍有部分患者未达到预期疗效,其原因可能是多方面的。理论上认为,正常肝组织从门静脉获取约2/3必须的血流供应,其余来自肝动脉;而原发和转移性肝癌的血供几乎全部来自肝动脉,极少由门静脉供血[30],进行肝动脉栓塞,可以阻断或减少肿瘤的主要供血,使肿瘤发生坏死、缩小以至消失,而正常肝组织不会受到严重影响。但是在肿瘤组织及血液中血管内皮生长因子 (vascular endothelial growth factor,VEGF)高表达,其与血管内皮细胞的相应受体结合,刺激血管内皮细胞增殖,进而促进新生毛细血管及侧支循环的形成,从而有助于肿瘤细胞逃脱TACE的打击,增加其存活的机会,使栓塞治疗失败[31]。因此,TACE与其他治疗手段的结合,对减少肿瘤再生或扩散也许更有利。例如将VEGF抑制剂如索拉非尼与阿霉素DEB结合应用可能是一个具有前景的治疗方案,但仍需通过进一步的随机对照研究证实[32]。
DC Bead虽具有良好的生物相容性[33],但不具备生物降解特性,其造成动脉闭塞是永久性的。对于Bead是否应该采用降解性材料,目前观点不一。有观点认为暂时性栓塞比永久性栓塞更有益[34],主要体现在较轻的栓塞后综合症,以及可进行重复操作。但是大量的临床实践证明,选择合适的粒径,可对同一患者进行多次DEB栓塞[29],因此,有学者认为DEB的生物降解性无合理的临床需求依据[35]。
在临床应用时,对DEB粒径的选择同样尚无一致的观点。虽然粒径较大的DEB释药缓慢,可对肿瘤细胞形成持久的细胞毒效应,而粒径较小的DEB释药较快,突释也较明显[15-16],但是有学者认为小粒径DEB为优选[29],原因在于小粒径DEB可滞留于肿瘤内血管末梢,实现瘤组织大量药物的递送。而一些研究者建议,依据病灶部位尺寸、供给动脉的直径以及肿瘤血管分布选择合适的Bead[36]。
DC Bead通过电荷吸附实现载药,目前应用仅局限于正电荷药物,对于非离子型或阴离子型药物的负载存在困难。近期的一份研究[37]揭示,采用二甲基亚砜实现了非离子型、低水溶性的雷帕霉素(rapamycin)的负载,载药量约30 mg·mL-1,但是其载药过程繁琐,临床难以推广。
DEB-TACE栓塞时,通过检测非离子型造影剂顺流性变化监控栓塞过程。当顺流减少,但又无栓塞剂回流导致肝脏外血管阻塞,即为栓塞过程终点。该过程无法反馈DEB或负载药物的具体定位信息。为弥补该不足,有研究者[38-40]开发了可视化Bead,即在Bead多孔性结构中掺入对比剂、或者通过化学修饰在聚合物骨架上连接对比性材料,然后采用磁共振和/或X-射线成像。介入手术过程中,针对具体的患者,可视化Bead实时反馈的分布信息对及时调整介入操作具有重要意义。
前面已阐述阿霉素DEB治疗原发性肝癌可获得良好的效益;除此之外,DC Bead负载伊立替康治疗大肠癌转移肝癌初步证实也是安全、有效的[41];在一些临床前研究[12、42-43]中,DEB还用于脑癌、胰腺癌及腹膜癌治疗,并显示了良好的效果。
总而言之,载药后的DC Bead用于局部肿瘤的治疗可获得良好的收益,虽然一些结论仍需大量的随机对照试验证实。将来DEB发展的技术领域可能包括成像性能的开发、不同类型药物的负载、适合于肿瘤解剖学结构特征的不同粒径的设计。
[1] Ferlay J,Shin HR,Bray F,et al.Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J]. Int J Cancer,2010,127(12):2893-917.
[2] De Lope,C.R.,S.Tremosini,et al.Management of HCC[J].J Hepatol,2012,56(Suppl 1):S75-87.
[3] Lencioni R,Crocetti L,De Simone P,et al.Loco-regional interventional treatment of hepatocellular carcinoma:techniques,outcomes,and future prospects[J]. Transpl Int,2010,23(7):698-703.
[4] Takayasu K.Transarterial chemoembolization for hepatocellular carcinoma over three decades: current progress and perspective[J].Jpn J Clin Oncol,2012,42 (4):247-55.
[5] Lencioni,R.Loco-regional treatment of hepatocellular carcinoma[J].Hepatology,2010,52(2):762-73.
[6] Varela M,Real MI,Burrel M,et al.Chemoembolization of hepatocellular carcinoma with drug eluting beads: efficacy and doxorubicin pharmacokinetics[J].J Hepatol, 2007,46(3):474-81.
[7] Yu JS,Kim KW,Jeong MG,et al.Predisposing factors of bile duct injury after transcatheter arterial chemoembolization(TACE)for hepatic malignancy[J].Cardiovasc Intervent Radiol,2002,25(4):270-4.
[8] ChungJ,Yu JS,ChungJJ,etal.Haemodynamic events and localised parenchymalchanges following transcatheter arterial chemoembolisation for hepatic malignancy:interpretation of imaging findings[J].Br J Radiol,2010,83(985):71-81.
[9] Goupil DW,Hassan H,Holland T,et al.Embolic compositions:US,20090209658Al[P].2009-08-20 [2012-04-18].
[10] Lewis AL,Gonzalez MV,Leppard SW,et al.Doxorubicin eluting beads-1:effects of drug loading on bead characteristics and drug distribution[J].J Mater Sci Mater Med,2007,18(9):1691-9.
[11] Aliberti C,Tilli M,Benea G,et al.Transarterial chemoembolization (TACE)of liver metastases from colorectal cancer using irinotecan-eluting beads:preliminary results[J].Anticancer Res,2006,26(5B): 3793-5.
[12] Forster RE,Small SA,Tang Y,et al.Comparison of DC Bead-irinotecan and DC Bead-topotecan drug eluting beads for use in locoregional drug delivery to treat pancreatic cancer[J].J Mater Sci Mater Med, 2010,21(9):2683-90.
[13] Wiskirchen J,Philippe LP.Using epirubicin-loaded DC Beads® for superselective embolisation of liver tumours-Initial experiences[J].Eur Oncol,2008,4(1): 72-6.
[14]DC Bead(doxorubicin)instructions for use.http://www. biocompatibles.com
[15] Taylor RR,Tang Y,Gonzalez MV,et al.Irinotecan drug eluting beads for use in chemoembolization:in vitro and in vivo evaluation of drug release properties [J].Eur J Pharm Sci,2007,30(1):7-14.
[16]Lewis AL,Gonzalez MV,Lloyd AW,et al.DC bead: in vitro characterization of a drug-delivery device for transarterial chemoembolization[J].J Vasc Interv Radiol,2006,17(2 Pt 1):335-42.
[17]Liu XX,Tong Z,Hu O.Swelling equilibria of hydrogels with sulfonate groups in water and in aqueous salt solutions[J].Macromolecules,1995,28(11):3813-7. [18]Henmei N,Haruma K,Takeshi E,et al.CharacteristicsofpH-sensitive hydrogelmicrosphere ofpoly (acrylamide-co-methacrylic acid)with sharp pH-volume transition[J].Colloid Polym Sci,2007,285(8): 873-9.
[19]Gonzalez MV,Tang Y,Phillips GJ,et al.Doxorubicin eluting beads-2:methods for evaluating drug elution and in-vitro:in-vivo correlation[J].J Mater Sci Mater Med,2008,19(2):767-75.
[20]Biondi M,Fusco S,Lewis AL,et al.New insights into the mechanisms of the interactions between doxorubicin and the ion-exchange hydrogel DC Bead for use in transarterial chemoembolization (TACE)[J].J Biomater Sci Polym Ed,2012,23(1-4):333-54.
[21] Namur J,Wassef M,Millot JM,et al.Drug-eluting beads for liver embolization:concentration of doxorubicin in tissue and in beads in a pig model[J].J Vasc Interv Radiol,2010,21(2):259-67.
[22]Chuu JJ,Liu JM,Tsou MH,et al.Effects of paclitaxel and doxorubicin in histocultures of hepatocelular carcinomas[J].J Biomed Sci,2007,14(2):233-44.
[23] Namur J,Citron SJ,Sellers MT,et al. Embolization of hepatocellular carcinoma with drug-eluting beads: doxorubicin tissue concentration and distribution in patient liver explants[J].J Hepatol,2011,55(6):1332-8. [24]Poon RT,Tso WK,Pang RW,et al.A phase I/II trial of chemoembolization for hepatocellular carcinoma using a novel intra-arterial drug-eluting bead[J].Clin Gastroenterol Hepatol,2007,5(9):1100-8.
[25]Song MJ,Park CH,Kim JD,et al.Drug-eluting bead loaded with doxorubicin versus conventional lipiodolbased transarterial chemoembolization in the treatment of hepatocellular carcinoma:a case-control study of Asian patients[J].Eur J Gastroenterol Hepatol,2011, 23(6):521-7.
[26]Lammer J,Malagari K,Vogl T,et al.Prospective randomized study of doxorubicin-eluting-bead embolization in the treatment of hepatocellular carcinoma:results of the PRECISION V study[J].Cardiovasc Intervent Radiol,2010,33(1):41-52.
[27]Dhanasekaran R,Kooby DA,Staley CA,et al.Comparison of conventional transarterial chemoembolization (TACE)and chemoembolization with doxorubicin drug eluting beads (DEB)for unresectable hepatocelluar carcinoma (HCC)[J].J Surg Oncol,2010,101(6): 476-80.
[28] Burrel M,Reig M,Forner A,et al.Survival of patients with hepatocellular carcinoma treated by transarterial chemoembolisation(TACE)using Drug E-luting Beads.Implications for clinical practice and trial design[J].J Hepatol,2012,in press.
[29] Liapi E, Geschwind JF. Transcatheter arterial chemoembolization for liver cancer:is it time to distinguish conventionalfrom drug-eluting chemoembolization?[J].Cardiovasc Intervent Radiol,2011,34(1): 37-49.
[30] Breedis C,Young G.The blood supply of neoplasms in the liver[J].Am J Pathol,1954,30(5):969-77.
[31] Wang B,Xu H,Gao ZQ,et al.Increased expression of vascular endothelial growth factor in hepatocellular carcinoma after transcatheter arterial chemoembolization [J].Acta Radiol,2008,49(5):523-9.
[32] Pawlik TM,Reyes DK,Cosgrove D,et al.Phase II trial of sorafenib combined with concurrent transarterial chemoembolization with drug-eluting beads for hepatocellular carcinoma[J].J Clin Oncol,2011,29(30): 3960-7.
[33] Malagari K,Chatzimichael K,Alexopoulou E,et al. Transarterial chemoembolization of unresectable hepa-tocellular carcinoma with drug eluting beads:results of an open-label study of 62 patients[J].Cardiovasc Intervent Radiol,2008,31(2):269-80.
[34] Vogl TJ,Zangos S,Eichler K,et al.Colorectal liver metastases: regional chemotherapy via transarterial chemoembolization (TACE)and hepatic chemoperfusion:an update[J].Eur Radiol,2007,17(4):1025-34. [35]Lewis AL,Dreher MR.Locoregional drug delivery using image-guided intra-arterialdrug eluting bead therapy[J].J Control Release,2012,in press.
[36] Malagari K,Alexopoulou E,Chatzimichail K,et al. Transcatheter chemoembolization in the treatment of HCC in patients not eligible for curative treatments: midterm results of doxorubicin-loaded DC bead[J]. Abdom Imaging,2008,33(5):512-9.
[37]Forster RE,Tang Y,Bowyer C,et al.Development of a combination drug-eluting bead:towards enhanced efficacy for locoregional tumour therapies[J].Anticancer Drugs,2012,23(4):355-69.
[38]Sharma KV,Dreher MR,Tang Y,et al.Development of"imageable"beads for transcatheter embolotherapy [J].J Vasc Interv Radiol,2010,21(6):865-76.
[39]Bartling SH,Budjan J,Aviv H,et al.First multimodal embolization particles visible on x-ray/computed tomography and magnetic resonance imaging[J].Invest Radiol,2011,46(3):178-6.
[40] Cilliers R,Song Y,Kohlmeir EK,et al.Modification of embolic-PVA particles with MR contrast agents[J]. Magn Reson Med,2008,59(4):898-902.
[41]Martin RC,Joshi J,Robbins K,et al.Hepatic intraarterial injection of drug-eluting bead,irinotecan(DEBIRI)in unresectable colorectal liver metastases refractory to systemic chemotherapy:results of multi-institutional study[J].Ann Surg Oncol,2011,18(1): 192-8.
[42]Baltes S,Freund I,Lewis AL,et al.Doxorubicin and irinotecan drug-eluting beads for treatment of glioma: a pilot study in a rat model[J].J Mater Sci Mater Med,2010,21(4):1393-402.
[43] Keese M,Gasimova L,Schwenke K,et al.Doxorubicin and mitoxantronedrug eluting beadsforthe treatment of experimental peritoneal carcinomatosis in colorectal cancer[J].Int J Cancer,2009,124(11): 2701-8.

