紫杉醇及其人血浆中代谢物的电喷雾串联质谱研究
钱 隽,王漪璇,郁韵秋
(1.复旦大学药学院药物分析学教研室,上海201203;2.复旦大学附属肿瘤医院化疗科,上海200032)
紫杉醇(paclitaxel)为双萜紫杉烷类抗癌药物,以其独特的抗癌机制和确切疗效,广泛应用于乳腺癌、卵巢癌、肺癌等多种恶性肿瘤的治疗。然而,紫杉醇具有强疏水性,临床使用时需用多种药用溶媒增溶,使药物的疗效和安全性受到影响[1]。开发高效低毒的紫杉醇新型制剂已成为近年来国内外研究的热点[2],由此也引发了对于紫杉醇在定性、定量测定以及代谢物分析等方面的各种需求。
电喷雾串联质谱(ESI-MSn)法是近年来迅速发展并逐步完善起来的一种分析手段,既能通过筛选目标离子而对复杂基质中的化合物进行微量分析,又能提供稳定的准分子离子和丰富的碎片信息,为分析化合物的结构特点及其裂解途径提供充分的依据,在生物样品的定性、定量分析和药物代谢领域的应用日益广泛。本研究利用ESI-MSn技术系统研究了紫杉醇在ESI-MSn中的离子化方式、裂解方式及在人体内的主要代谢物,为紫杉醇的质谱定性和定量分析提供参考,有助于该类药物的药动学研究。
1 仪器和试药
API 3200Qtrap三重四极杆串联线性离子阱质谱仪(美国AB Sciex公司),配有电喷雾电离(ESI)源和大气压化学电离(APCI)源,HARVARD pumpⅡ针泵及操作软件Analyst 1.5。Prominence LC-20AC液相色谱系统,包括LC-20AD梯度泵、SIL-20ACHT自动进样器、CTO-20A柱温箱和DGU-20A3脱气机(日本岛津公司)。Mettler Toledo AB135-S分析天平(瑞士Mettler Toledo公司)。
紫杉醇对照品(纯度99.9%,批号100382-200301,中国食品药品检定研究院);甲醇、甲酸、乙酸、甲酸铵和乙酸铵均为色谱纯(德国Merck公司);水为超纯水。
2 方法和结果
2.1 对照品溶液的配制 精密称取紫杉醇10mg,用甲醇溶解,配成浓度为400μg/ml的对照品储备液。将纯水与甲醇以5∶5的比例混合,并加入适量紫杉醇的对照品储备液,配制成紫杉醇浓度为20μg/ml的对照品溶液。同样,分别以含不同添加剂如甲酸、乙酸、甲酸铵、乙酸铵、氨水等的水溶液替代前述方法中的纯水,与甲醇以5∶5的比例混合,供针泵直接注射进样。
2.2 实验方法
2.2.1 紫杉醇对照品溶液的质谱直接进样分析 采用针泵连续进样方式,紫杉醇对照品溶液直接进入离子源电离后进行一级质谱和二级质谱分析。流速为10μl/min;ESI源正离子扫描;电喷雾电压5 500V;气帘气68.95kPa;雾化气137.9kPa。
2.2.2 人血浆中紫杉醇代谢物的液相色谱-质谱联用分析 取病人用药后0、15、30min的血浆样品各100μl合并,混匀后取200μl的混合血样加入200μl甲醇,涡旋混合30s,2×104×g离心5min,取上清液进样分析。
色谱条件 色谱柱:Agilent ZORBAX SB-C18柱(100mm×3.0mm,3.5μm);流动相:1mmol/L甲酸铵为A相,甲醇为B相,设置梯度洗脱:0~5min,25%B;25min,60%B;25~30min,90%B;32min,25%B;流速:0.4ml/min;柱温:40℃;进样量:10μl。
质谱条件 ESI源正离子检测;建立Qtrap质谱特有的自动关联(IDA)扫描:当增强母离子(EMS)扫描或多反应监测(MRM)扫描信号强于500cps后触发增强子离子(EPI)扫描。EMS扫描范围m/z50~1 000;EPI扫描范围m/z50~1 000,扫描速度4 000Da/s;MRM监测离子对m/z854→286。电喷雾电压5 500V;离子源温度(TEM)550℃;气帘气206.85kPa;雾化气344.75kPa;碰撞气413.7kPa;去簇电压(DP)97V;碰撞电压(CE)25V。
2.3 一级质谱研究 紫杉醇的分子质量为853,在ESI源正离子模式下分别检测到m/z 854的[M+H]+、m/z871的[M+NH4]+和m/z 876的[M+Na]+等准分子离子。负离子模式检测到m/z852的[M-H]-离子。由于正离子模式的响应强度大于负离子模式,所以选择正离子模式进行检测分析。而在APCI源中,正负离子模式扫描均未检测到稳定的准分子离子。紫杉醇及其代谢物的结构式见图1。

图1 紫杉醇及其代谢物的化学结构Figure 1 Chemical structures of paclitaxel and its metabolites
如图2的一级质谱图所示,在50%的甲醇-水溶液中,紫杉醇以m/z876的[M+Na]+丰度最大,而在含1mmol/L甲酸铵的50%甲醇-水溶液中,紫杉醇则以m/z854的[M+H]+为基峰,且丰度较50%甲醇-水溶液中的[M+Na]+高出3倍。经实验,在含有甲酸、乙酸、甲酸铵、乙酸铵或氨水的50%甲醇-水溶液中,紫杉醇均以[M+H]+为基峰。另在含有甲酸铵、乙酸铵和氨水的50%甲醇-水溶液中,尚有[M+NH4]+离子存在,但丰度明显低于[M+H]+和[M+Na]+离子。以上结果表明,紫杉醇的离子化方式及质谱响应明显受到样品溶液组成的影响。
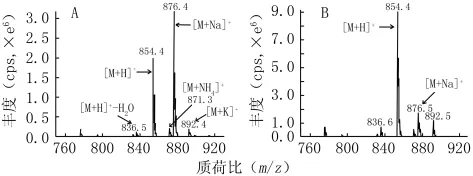
图2 紫杉醇在不同溶液中的一级质谱图Figure 2 MS photograms of paclitaxel in different solutions
通过比较化合物在不同添加剂环境中质谱响应的强度,发现加入甲酸铵时,[M+H]+的丰度更高。推测是由于NH4+的存在促进了[M+H]+的产生,经离子源气化后的紫杉醇质子亲合力大于NH3,从而发生了离子-分子反应或者诱导碰撞解离,使该类化合物从NH4+中获得更多的H+[3]。
2.4 二级质谱研究 紫杉醇在采用针泵直接进样的方式下,分别以[M+H]+、[M+NH4]+和[M+Na]+为母离子进行EPI扫描,发现[M+NH4]+无法产生稳定的子离子,[M+Na]+仅产生少量子离子,而[M+H]+可以产生多个不同的子离子(见图3),主要有m/z 569、509、387、327、286、268、240等多个碎片离子,其中m/z286为丰度最高的子离子。结合一级质谱的研究结果,认为[M+NH4]+由于丰度较低,且不够稳定,导致无法产生足够强度的子离子,而[M+Na]+则由于Na+与电负性较强的杂原子容易形成稳定的加合离子,不容易继续发生裂解反应来产生其他子离子[4]。

图3 电喷雾正离子模式下紫杉醇[M+H]+离子的二级质谱图Figure 3 MS2 photogram of[M+H]+ion of paclitaxel in positive electrospray ion mode

图4 紫杉醇的裂解途径和形成的主要碎片离子Figure 4 Fragmentation pathways and main fragment ions of paclitaxel
根据紫杉醇的化学结构式及其碎片离子推断其裂解途径如图4所示。紫杉醇的分子结构中含有多个C-O键,易发生断裂,多个羟基易发生脱水,故产生m/z551、509、387、327、309等不同碎片离子,而较大质荷比的碎片离子信号较弱。
碰撞电压(collision energy)对于子离子的产生具有重要影响。本研究通过调节碰撞电压的数值选择适合于定量分析的离子对。在碰撞电压5~50V的变化过程中,紫杉醇和主要碎片离子发生变化。当碰撞电压为5V时,紫杉醇的准分子离子是基峰,各种子离子丰度都很小;当碰撞电压>15V时,m/z286成为丰度最大的基峰,此时m/z 569和m/z509都具有较大的丰度;随着碰撞电压进一步提升,m/z569和m/z509减弱甚至消失,而较小质荷比的碎片离子,如m/z 122和m/z 105则大量产生。在碰撞电压变化的过程中紫杉醇丰度最大且强度稳定的子离子是m/z286的碎片离子。
2.5 代谢物研究 代谢物的质谱分析通常采用对照品比对或根据特征性的碎片离子进行定性分析,也有通过磁共振法鉴定结构的。文献报道的紫杉醇代谢物主要为羟基化产物,包括6α-羟基紫杉醇、C3′-羟基紫杉醇和二羟基紫杉醇等[5](见图1)。本研究采用了将EPI与EMS及MRM扫描相结合的质谱分析技术,能够获得更多的碎片离子信息。通过综合分析各代谢物的色谱保留时间和各级质谱的信息,对紫杉醇的各种代谢物的化学结构和裂解途径进行推测,从而完成紫杉醇各代谢物的定性鉴别。
肿瘤病人静脉滴注紫杉醇前后的血样经处理后由LC-MS/MS进样分析。通过对比分析两者的色谱与质谱信息,发现了紫杉醇原药和主要的3个代谢物(见表1)。其中,m/z854的[M+H]+(M0)的色谱保留时间及MS2质谱图与紫杉醇对照品的一致,由此确定M0即为未经代谢的紫杉醇原药。

表1 紫杉醇及其代谢物的质荷比、保留时间和主要碎片离子Table 1 The m/z,retention time and main fragment ions of paclitaxel and its metabolites
代谢物M1的m/z886和碎片离子m/z687较原药(M0)的准分子离子m/z 854和碎片离子m/z 655大32u,推断其为原药的二羟基代谢物。M1的碎片离子m/z 525、m/z 403、m/z 325分别较原药的碎片离子m/z509、m/z387和m/z309多16u,可推断一个羟基取代发生在紫杉醇的四环母核上。另有M1的碎片离子m/z302和m/z256较原药的碎片离子m/z286和m/z240多16u,推断另一个羟基取代发生于C13侧链上。由此,可以确定M1为紫杉醇的二羟基代谢物。
代谢物M2和M2′的准分子离子m/z均为870,较紫杉醇原药多16u,但色谱保留时间分别为13.2和14.0min,推断两者为紫杉醇一羟基代谢物的同分异构体。M2的碎片离子中有m/z 509、m/z 449和m/z 327等与原药相同的碎片离子,而m/z 671、m/z 302和m/z 256较原药的m/z 655、m/z 286、m/z240碎片离子多16u,证实一个羟基取代发生在C13位的侧链上,即M2为C3′-羟基紫杉醇。M2′的碎片离子中有m/z585、m/z525、m/z403等含四环母核的碎片离子,较原药的碎片离子m/z 569、m/z509、m/z387多16u,证实其一个羟基取代发生在四环母核上,M2′为6α-羟基紫杉醇。
比较各代谢物的色谱峰面积,以M0(紫杉醇原形)最大,占代谢物总量的50%以上,其次为M2′(6α-羟基紫杉醇),约占30%,M1(二羟基紫杉醇)约10%,M2(C3′-羟基紫杉醇)少于5%,且未发现二相结合型代谢物。说明人血浆中的主要循环化合物为紫杉醇原形,代谢产物中以6α-羟基紫杉醇为主,此结果与已有文献报道的一致。
3 讨 论
紫杉醇的分子结构中缺乏氨基或羧基等易电离的基团,样品溶液中未加入添加剂时,在ESI源中的质谱响应相对弱,离子化效率低,表明此时不易形成带电荷离子。而含挥发性溶质的溶液注入质谱后,紫杉醇的离子强度明显提高。这是由于加入的溶质促使离子在溶液中预形成,有利于提高目标化合物的离子化效率[6]。
去簇电压(declustering potential,DP)对于分析物的准分子离子峰的形成和响应强度也有明显的影响。紫杉醇的[M+H]+、[M+NH4]+和[M+Na]+的丰度随DP变化的趋势各不相同。其中[M+H]+的丰度随DP值增大而相应增加,并于DP升至100V左右时达到最高。本研究通过在溶液中加入添加剂和调节适宜的DP值,可以使更多的紫杉醇形成[M+H]+,减少其他加合离子的产生,从而增大紫杉醇在质谱中的响应。
实验结果表明,在较高的碰撞电压下,较大质荷比的碎片极易碎裂,产生大量低质荷比的碎片离子。在已报道的紫杉醇定量分析方法[3,5,7,8]中,常选用m/z569或m/z509的碎片作为检测的子离子,但本研究中可见这些碎片离子的丰度并不高。结合紫杉醇的化学结构和裂解途径分析,这些碎片离子中有易发生裂解的酯键和易脱水的羟基,极易碎裂为多种不同的碎片,无法产生较大的丰度。而本研究中通过二级质谱选择的离子对m/z 854→286在MRM模式下明显较其他通道具有更高的响应。
紫杉醇分子结构中的C-O键断裂和脱水是其主要的裂解方式,因而紫杉醇及其代谢物的裂解过程会产生C6H5COOH(122)、CH3COOH(60)、H2O(18)等相同的中性碎片丢失(见表1),这些特征中性丢失是鉴定紫杉醇生物体内代谢物的重要参考。紫杉醇代谢物的碎片离子中有些与原药碎片离子的质荷比相同,有些与原药碎片离子通过丢失相同的中性碎片产生,质荷比具有稳定的差值(发生羟基取代,m/z差值为16)。这些特征明显的碎片离子是推断紫杉醇在人体内代谢过程中发生羟基取代的位置以及推测代谢物化学结构的依据。
[1] ten Tije A J,Verweij J,Loos W J,et al.Pharmacological effects of formulation vehicles:implications for cancer chemotherapy[J].Clin Pharmacokinet,2003,42(7):665-685.
[2] Perez E A.Novel enhanced delivery taxanes:an update[J].Semin Oncol,2007,34(3):Suppl 1-5.
[3] Vainchtein L D,Thijssen B,Stokvis E,et al.A simple and sensitive assay for the quantitative analysis of paclitaxel and metabolites in human plasma using liquid chromatography/tandem mass spectrometry[J].Biomed Chromatogr,2006,20(1):139-148.
[4] 再帕尔·阿不力孜,方起程,梁晓天,等.利用质谱-质谱方法探讨紫杉烷类二萜化合物的裂解特征[J].科学通报,1999,44(7):691-703.
Zeper Abliz,Fang QiCheng,Liang XiaoTian,et al.The fragmentation characteristics of taxane diterpenoid compounds with MS/MS method[J].Chin Sci Bull,1999,44(7):691- 703.In Chinese.
[5] Alexander M S,Kiser M M,Culley T,et al.Measurement of paclitaxel in biological matrices:high-throughput liquid chromatographic-tandem mass spectrometric quantification of paclitaxel and metabolites in human and dog plasma[J].J Chromatogr B Analyt Technol Biomed Life Sci,2003,785(2):253-261.
[6] 刘永臻,梁 峰,再帕尔·阿不力孜.离子-分子反应及其在质谱分析中的应用[J].质谱学报,2004,25(3):175-182.
Liu YongZhen,Liang Feng,Zeper Abliz.Ion/molecule association reactions and their applications to mass spectrometry[J].J Chin Mass Spectrom Soc,2004,25(3):175-182.In Chinese with English abstract.
[7] Stokvis E,Ouwehand M,Nan L G,et al.A simple and sensitive assay for the quantitative analysis of paclitaxel in human and mouse plasma and brain tumor tissue using coupled liquid chromatography and tandem mass spectrometry[J].J Mass Spectrom,2004,39(12):1506-1512.
[8] Gardner E R,Liau C T,Chu Z E,et al.Determination of paclitaxel in human plasma following the administration of Genaxol or Genetaxyl by liquid chromatography/tandem mass spectrometry[J].Rapid Commun Mass Spectrom,2006,20(14):2170-2174.

