硒酸酯多糖对人食管鳞癌Eca109细胞增殖及凋亡的影响
岳黎敏,杨以会,赵克胜
(1.河北工程大学医学院,河北邯郸 056029;2.河北省邯郸矿业集团总医院麻醉科 056003)
硒酸酯多糖对人食管鳞癌Eca109细胞增殖及凋亡的影响
岳黎敏1,杨以会1,赵克胜2
(1.河北工程大学医学院,河北邯郸 056029;2.河北省邯郸矿业集团总医院麻醉科 056003)
目的研究硒酸酯多糖(KSC)对人食管鳞癌Eca109细胞增殖及凋亡的影响,并初步探讨其作用机制。方法 甲基噻唑基四唑(MTT)法检测不同浓度KSC对Eca109细胞增殖的影响;流式细胞术观察KSC对Eca109细胞凋亡的影响;Western blot技术检测KSC对Eca109细胞核转录因子-κB(NF-κB)蛋白表达水平的影响。结果KSC可明显抑制Eca109的增殖(P0.05),并呈时间及浓度依赖性;经KSC作用后,Eca109细胞的凋亡率随KSC作用时间的延长(24、48、72h)及KSC浓度的增加(30、60、120μg/mL)而明显升高(P0.01);KSC(60、120μg/mL)显著下调Eca109细胞核中 NF-κB蛋白水平(P0.01)。结论
KSC对Eca109细胞具有抑制增殖、诱导凋亡作用,其作用机制可能与抑制NF-κB信号通路有关。
食管肿瘤;细胞凋亡;NF-κB;硒酸酯多糖
硒酸酯多糖(kappa-selenocarrageenan,KSC)是一种新型的有机硒化合物,是微量元素硒与天然产物κ-卡拉胶半合成的一种含硒的生物活性多糖,又称硒化卡拉胶。研究表明KSC对人肝癌、乳腺癌、骨肉瘤等多种肿瘤细胞具有抑制增殖及诱导凋亡的作用[1-3],然而其对食管癌细胞株的增殖及凋亡的影响尚未见报道。本研究旨在探讨KSC对食管鳞癌Eca109细胞株增殖、凋亡的影响及其可能机制。
1 材料与方法
1.1 材料
1.1.1 药物与试剂 人食管鳞癌Eca109细胞株由本室保存。主要试剂包括硒酸酯多糖(上海天赐福生物工程有限公司,含硒量1.68%)、RPMI1640培养基(Gibco BRL)、碘化丙啶(propidium iodide,PI)(Sigma)、甲基噻唑基四唑(methyl thiazolyl tetrazolium,MTT)(Sigma)、细胞核与细胞质蛋白提取试剂盒(Pierce公司)、兔抗人核因子(nuclear factor,NF)-κB、β-actin单克隆抗体和羊抗兔第二抗体(北京中杉金桥生物技术有限公司)。
1.1.2 细胞培养 人食管鳞癌Eca109细胞株在含10%胎牛血清(fetal bovine serum,FBS)、100U/mL青霉素和100U/mL链霉素的RPMI1640培养液中,于37℃5%CO2条件下培养。
1.2 方法
1.2.1 MTT法检测KSC对Eca109增殖的影响 取对数生长期Eca109细胞,用0.25%胰蛋白酶消化,用含10%胎牛血清的RPMI1640培养液配成单细胞悬液(细胞密度为1×105/mL),加样每孔100μL于96孔培养板中。实验组加入等体积不同浓度KSC(终浓度分别为30、60、120μg/mL),阴性对照组加入等体积溶剂。各设4个复孔。置37℃、饱和湿度、5%CO2培养箱中培养24、48、72h后,各孔加入 MTT(5g/L)20μL孵育4h,弃上清液,每孔加入二甲基亚砜150μL,振荡10min,待结晶溶解后,用酶标仪于570nm波长处测定光密度(optical density,OD)值。并按下式公式计算细胞生长抑制率(inhibition ratio,IR)。IR(%)=(1-实验组平均 OD值/对照组平均OD值)×100%。
1.2.2 流式细胞术测定细胞凋亡率 收集阴性对照组和经30、60、120μg/mL KSC作用24、48、72h后的Eca109细胞,磷酸盐缓冲液(phosphate buffer saline,PBS)洗涤2次。加入70%冷乙醇固定12h,离心去乙醇,37℃RNA酶处理1h,与PI室温反应10min,流式细胞术测定凋亡率。每个浓度重复3次。
1.2.3 Western blot测定NF-κB蛋白的表达 KSC处理48h后,收集对照组和实验组细胞,以0.01mol/L PBS洗2次,悬浮在0.4mL裂解液中,冰浴10min,14 800g离心30s,弃上清液,收集细胞核沉淀,悬浮在100μL冰冷核蛋白提取液中,冰浴20min,并不断震荡,14 800g离心30s,收集上清液,即为细胞核蛋白,用Lowery法进行定量。加等量蛋白于上样缓冲液,煮沸,在十二烷基硫酸钠-聚丙烯酰胺凝胶中电泳分离,电转到硝酸纤维膜上。5%脱脂奶粉封闭2h后,加兔抗人NF-κB单抗和β-actin一抗孵育,4℃过夜。加辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗,37 ℃孵育1h,3,3′-二氨基联苯胺显色。对免疫印迹条带进行分析扫描,结果以测定蛋白条带与β-actin的积分吸光度(integrated optical density,IOD)比值表示NF-κB蛋白的相对表达水平。每个浓度均重复3次。
1.3 统计学处理 应用统计软件SPSS13.0进行统计学分析,结果用±s表示,采用t检验,以P0.05为差异有统计学意义。
2 结 果
2.1 KSC对Eca109增殖的抑制作用 KSC处理组Eca109细胞的增殖均受到不同程度的抑制,并呈明显时间和浓度依赖性(图1),IR最高达87.3%,与对照组相比,差异均有统计学意义 (P0.05)。
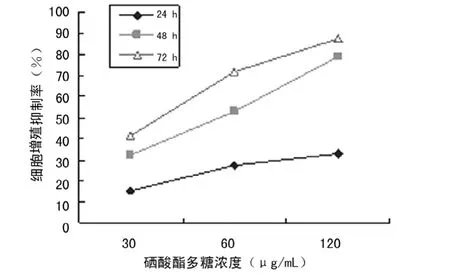
图1 肿瘤细胞生长抑制率与硒酸酯多糖不同作用浓度及时间的关系(n=4)
2.2 KSC对Eca109细胞凋亡的影响 KSC处理组在作用24、48、72h后,Eca109细胞的凋亡率随药物作用时间的延长和药物浓度的增加而明显升高(P0.01),见图2。

图2 硒酸酯多糖对Eca109细胞凋亡的影响(n=3)
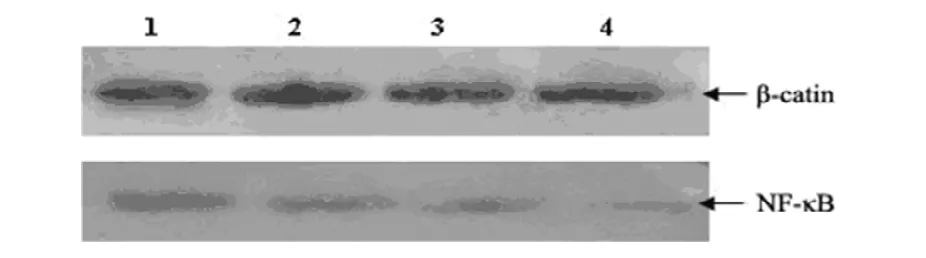
图3 硒酸酯多糖对细胞NF-κB蛋白表达的Western blot检测结果
2.3 KSC对Eca109细胞NF-κB蛋白表达的影响 Western blot结果显示,经不同浓度(30、60、120μg/mL)KSC处理48h后,Eca109细胞 NF-κB蛋白表达水平的校正值(NF-κB/β-actin)分别为0.734±0.190、0.323±0.060和0.196±0.070。随KSC浓度增加,NF-κB蛋白表达水平逐渐降低。60、120 μg/mL处理组显著低于对照组(0.873±0.040)(P0.01),见图3。
3 讨 论
硒是人体一种必需微量元素,流行病学及临床资料显示微量元素硒与食管鳞癌的发生呈负相关性。高浓度的亚硒酸钠、硒蛋氨酸对食管癌细胞均具有抑制生长、诱导凋亡的作用[4-5]。国内外相关研究显示,不同硒化合物对各类肿瘤细胞的影响不同[6]。KSC是一种新型的有机硒化合物,与无机硒相比,KSC具有生物活性高、毒性小、生物利用度高等特点。已有研究显示,KSC对肝癌、乳腺癌、卵巢癌及骨肉瘤等多种癌细胞具有抑制生长、诱导凋亡的作用[7]。本研究显示药理剂量的KSC可显著抑制Eca109细胞增殖,且随药物浓度增加及作用时间延长,其抑制作用增强;药理剂量的KSC作用下,Eca109细胞凋亡率显著增加,并也呈明显时间和浓度依赖性。
转录因子NF-κB最常见的形式是P50/P65异源二聚体。NF-κB常与其抑制物IκBs蛋白结合,以非活性状态存在于细胞质中。多种活化因子可通过磷酸化IκBs,释放NF-κB,激活的NF-κB转位进入细胞核,从而调节其靶基因的转录。NF-κB信号通路参与了感染、细胞凋亡和肿瘤等病理过程。NF-κB可诱导许多抗凋亡基因,包括凋亡抑制因子、Bcl-2、肿瘤坏死因子受体结合因子1和2等[8]。研究发现,多种肿瘤细胞内均存在着异常激活的NF-κB,并且可能是肿瘤细胞抗凋亡的主要途径之一[9-10]。已有研究发现,亚硒酸钠可通过抑制 NF-κB信号通路影响前列腺癌细胞的生长及凋亡[11],在食管鳞癌组织中存在 NF-κB表达的显著升高[12-13]。为探讨 KSC的作用机制,本实验检测了KSC对NF-κB表达的影响,结果显示高浓度的KSC可显著减少进入细胞核内NF-κB蛋白含量,提示KSC对Eca109细胞的作用机制可能与抑制NF-κB信号通路有关。
NF-κB信号通路作为肿瘤防治的新靶点日益受到关注,采用天然或人工合成的NF-κB抑制物,抑制该信号通路对多种肿瘤的临床防治具有重要意义[14-15]。KSC作为NF-κB信号通路的抑制物,在临床食管鳞癌防治中具有广阔的应用前景。
[1] 凌娜,邓丹,季宇彬.硒酸酯多糖诱导人肝癌HepG-2细胞凋亡的实验研究[J].亚太传统医药,2009,5(9):14-16.
[2] 吴兴,陈峥嵘,陈中伟.硒酸酯多糖诱导人骨肉瘤细胞凋亡作用的体外实验[J].肿瘤防治杂志,2004,11(9):927-930.
[3] 何更生,程棕,陆瑞芳,等.硒酸酯多糖对人乳腺癌细胞株(BcaP-37)生物学作用的研究[J].中华预防医学杂志,1997,31(2):105-105.
[4] 肖慧娟,黄承钰,王华余,等.硒、锌对人食管癌细胞株Eca109生长增殖的影响[J].南方医科大学学报,2008,28(12):2117-2120.
[5] 陈滋华,吴清明,谢国建,等.硒蛋氨酸对食管癌细胞株增生的影响[J].世界华人消化杂志,2004,12(5):1215-1217.
[6] 王文娟,杨建一.硒的抗肿瘤作用及其机制研究进展[J].微量元素与健康,2009,27(5):63-64.
[7] 凌娜,邓丹,季宇彬.MTT法检测多种肿瘤细胞对硒酸酯多糖敏感性的研究[J].亚太传统医药2009,5(10):16-17.
[8] Dolcet X,Llobet D,Pallares J,et al.NF-κB in development and progression of human cancer[J].Virchows Arch,2005,446(5):475-482.
[9] Kim H,Lim JW,Seo JY,et al.Oxidant-sensitive transcription factor and cyclooxygenase-2by Helicobacter pylori stimulation in human gastric cancer cells[J].J Environ Pathol Toxicol Oncol,2002,21(2):121-129.
[10]Wu W,Yao DF,Qiu LW,et al.Characteristics of hepatic nuclear-transcription factor-kappa B expression and quantitative analysis in rat hepatocarcinogenesis[J].Hepatobiliary Pancreat Dis Int,2009,8(5):504-509.
[11]Gasparian AV,Yao YJ,LüJ,et al.Selenium compounds inhibit I kappa B kinase(IKK)and nuclear factor-kappa B(NF-kappa B)in prostate cancer cells[J].Mol Cancer T-her,2002,1(12):1079-1087.
[12]田芳,徐培荣,侯卫红,等.NF-κB信号通路在食管鳞癌细胞系的激活[J].肿瘤防治研究,2006,33(1):11-14.
[13]Kang MR,Kim MS,Kim SS,et al.NF-kappaB signalling proteins p50/p105,p52/p100,RelA,and IKKepsilon are over-expressed in oesophageal squamous cell carcinomas[J].Pathology,2009,41(7):622-625.
[14]Alwahaibi NY,Budin SB,Mohamed J,et al.Nuclear factor-kappa B as a promising target for selenium chemoprevention in rat hepatocarcinogenesis[J].J Gastroentrol Hepatol,2010,25(4):786-791.
[15]Sarkar FH,Li Y.NF-kappaB:apotential target for cancer chemoprevention and therapy[J].Front Biosci,2008,13:2950-2959.
Effect of kappa-selenocarrageenan on proliferation and apoptosis in human esophageal squamous carcinoma Eca109 cell line
ObjectiveTo study the effect of kappa-selenocarrageenan(KSC)on the proliferation and apoptosis of esophageal squamous carcinoma cell line Eca109and its mechanism.MethodsAfter treatment with KSC at different concentrations,the inhibitory effect on proliferation of Eca109cells was measured by MTT and the apoptotic rates were analyzed with flow cytometry.Abundance of NF-κB protein of Eca109cells was detected by Western-blot.ResultsKSC could inhibit the growth of Eca109cells in both dose and time dependent manners(P0.05).The apoptotic rate of Eca109cells was significantly increased by KSC in a time-dependent(24,48and 72h)and concentration-dependent(30,60,120μg/mL)manners(P0.01).Abundance of NF-κB protein was down regulated in KSC(60,120μg/mL)treated Eca109cells(P0.01).ConclusionKSC can inhibit the proliferation and induce apoptosis of Eca109cells,which is correlated with down-regulation of the abundance of NF-κB protein.
esophageal neoplasms;apoptosis;NF-kappa B;kappa-selenocarrageenan
10.3969/j.issn.1671-8348.2012.16.019
A
1671-8348(2012)16-1612-02
2011-10-11
2011-12-26)
•调查报告•

