HPLC法同时检测血浆中半胱氨酸/胱氨酸和还原型谷胱甘肽/氧化型谷胱甘肽的氧化还原电势
杨荟敏 祝佳玮 赵宸龙 张晨光 张 红 赵文明
(1.首都医科大学基础医院细胞生物学系,肝脏保护与再生调节北京市重点实验室,北京100069;2.首都医科大学基础医院免疫学系,北京100069;3.首都医科大学基础医学院,北京100069)
含有巯基/二硫键的化合物在体内发挥着多种不同的作用,可参与调控细胞信号传导,蛋白质以及其他分子化合物等的组成、转运和功能等。体内含有巯基/二硫键的化合物有半胱氨酸/胱氨酸(cysteine/ cystine,Cys/CySS),谷胱甘肽氧化态/还原态(reduced glutathione/oxidized glutathione,GSH/GSSG)以及硫氧还原蛋白1和2(thioredoxin1/2,Trx1/2)[1]等,这些物质在体内环境中以氧化态和还原态的形式存在,处于动态变化的过程中并最终达到一个相对氧化还原平衡的状态。一旦这种平衡状态被破坏,机体即启动与超氧自由基产物的相关机制,从而影响脂蛋白修饰、转换和细胞功能及代谢素产生损伤[2-4],而且可对葡萄糖和糖蛋白的自身氧化作用和抗氧化酶的糖化作用产生影响。
氧化应激参与体内多种生理活动及疾病的发生[5],因此,寻找能够探测体内氧化还原状态生物学指标的简单且准确的方法,对研究氧化应激参与的体内生理活动极为重要。目前,检测体内某种蛋白氧化还原状态的方法很多。应用比较广泛的主要有氧化还原蛋白免疫印记法[5];生物素标记的碘乙酰胺蛋白免疫印记法[6-7];此外还有一些相关的测定方法如:酶循环法[8]、磁共振光谱检测法[9]以及电化学测定法[10]等。但这些方法在某些方面如检测灵敏度,相对精确定量蛋白的氧化还原状态等受到实验条件的限制,具有一定的局限性。并且在同时检测体内多种物质的氧化还原状态上也受到一定的限制。另外,目前国内文献[8-10]报道主要集中在用HPLC检测血浆中还原态物质如GSH、Cys等的含量。因此,寻找能够同时测定体内多种氧化及还原状态物质的方法对准确反映体内氧化应激的状态极为重要。本方法可同时检测血浆中含巯基/二硫键化合物 Cys/CySS和GSH/GSSG形成的氧化还原对的含量,并根据能斯特方程计算出相应的氧化还原电势。此方法是用碘乙酸封闭血浆中自由的巯基,通过丹磺酰氯衍生化后,利用HPLC进行分离检测。
1 材料和方法
1.1 实验材料与仪器
1)实验材料:水合红菲绕啉二磺酸钠(bathophenanthroline disulfonic acid disodium salt hydrate,BPDS),丹磺酰氯,L-丝氨酸,Cys,CySS,GSH,GSSG,70%高氯酸(HPLC级),甲醇(HPLC级)均购于美国Sigma公司。内参谷氨酰谷氨酸(γ-glutamylglutamate,γ-GG)购于美国 MP Biomedicals公司,碘乙酸(iodoacetic acid,IAA),肝素钠购于北京信德科兴科学器材有限责任公司,硼酸、四硼酸钠、丙酮、氯仿、冰醋酸均为国产分析纯级别。SD雄性大鼠(190~210g)购于首都医科大学实验动物部,实验动物许可证号:2006-0009。
2)仪器:高效液相色谱仪为Wasters 2695,以及荧光检测器Wasters 2475(激发波长315nm,发射波长518nm)。
1.2 主要试剂的配制
1)主要溶液的配制:①含有内参的硼酸盐缓冲液(0.5 mol/L,pH 8.5):称取 12.4 g硼酸,19 g Na2B4O7·10 H2O,溶于500 mL双蒸水中;加入内参γ-GG,终浓度为165 μmol/L。②A液的配制:称取1.53 g L-丝氨酸,25 mg肝素钠,50 mg BPDS,300 mg IAA溶于10 mL含有内参γ-GG的硼酸盐缓冲液(0.5 mol/L)中,充分混匀(pH 8.0)。分装为每管150 μL。于-20℃保存。③B液的配制:0.2 mol/L含有10%高氯酸的硼酸液:称取6.2 g硼酸至300 mL双蒸水中,加入71 mL 70%高氯酸混匀后,再用双蒸水定容至500 mL(pH 1.0)。分装为200 μL/管,于-20℃保存。
2)标准样品的制备:精确称取适量的Cys,CySS,GSH,GSSG溶解于10 mmol/L的磷酸盐缓冲液中,制成浓度均为5 μmol/L的Cys,CySS,GSH,GSSG混合溶液。然后加入IAA和内参γ-GG,浓度分别为7.4g/ L和10 μmol/L。分装,于-20℃保存。
3)血浆样品的制备:取1 350 μL全血,加入150 μL A液,室温放置一段时间,使IAA与巯基充分结合。将管轻轻倒置2次混合溶液,然后16 000g离心1 min。取上清200 μL,加入200 μL B液,再轻轻将管倒置2次,混匀后于-20℃保存。
1.3 实验方法
1)样品的衍生化:将标准样品及血浆样品取出,待样品融化后,16 000g离心2min,取300μL上清置于新离心管中,加入1 mol/L KOH/饱和硼酸盐溶液调节pH值至9.0±0.2,放置大约3min,充分清除高氯酸钾。加入300μL丹磺酰氯溶液(20mg/mL丹磺酰氯溶于丙酮,现配现用),室温避光16~26 h,加入500μL氯仿,8 000 r/min离心 5min。取上清,于-20℃保存。
2)色谱条件:色谱柱为LC-NH2硅胶柱(25cm × 4.6mm,5μm,美国Sigma公司)。流动相I为80%甲醇,20%双蒸水。流动相Ⅱ为63%甲醇,27%冰醋酸,10%双蒸水,0.002 5mol/L无水乙酸钠。流动相梯度洗脱条件见表1。
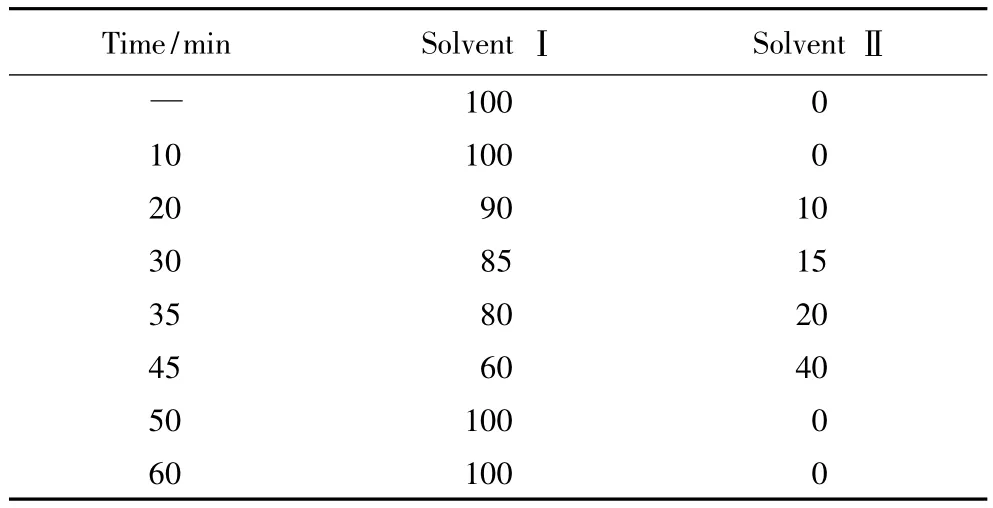
表1 流动相梯度程序Tab.1 Procedure of solvent gradient (%)
2 结果
2.1 标准样品的检测及其重复性
为检测本方法的可行性及重复性,我们首先对已知浓度的标准样品中各组进行了检测。按照1.2中2)的方法准确配制含有5 μmol/L Cys、CySS、GSH、GSSG,和10 μmol/L内标γ-GG的混合标准样品,并将其分为5份,分别测定各样品中Cys、CySS、GSH、GSSG以及γ-GG的保留时间和峰面积。以第1次结果和第5次结果为例作图(图1)。各组分的保留时间及峰面积见表2。用于标准定量的内标γ-GG在保留时间和峰面积上均显示了极高的重复性,RSD值均≤1%,为后期样品浓度的精确定量提供了基础。Cys、CySS、GSH、GSSG的保留时间及峰型的RSD值也都≤10.8%,具有较好的重合性。实验说明此方法可以准确检测出标准样品中各物质的含量,并且具有可重复性。
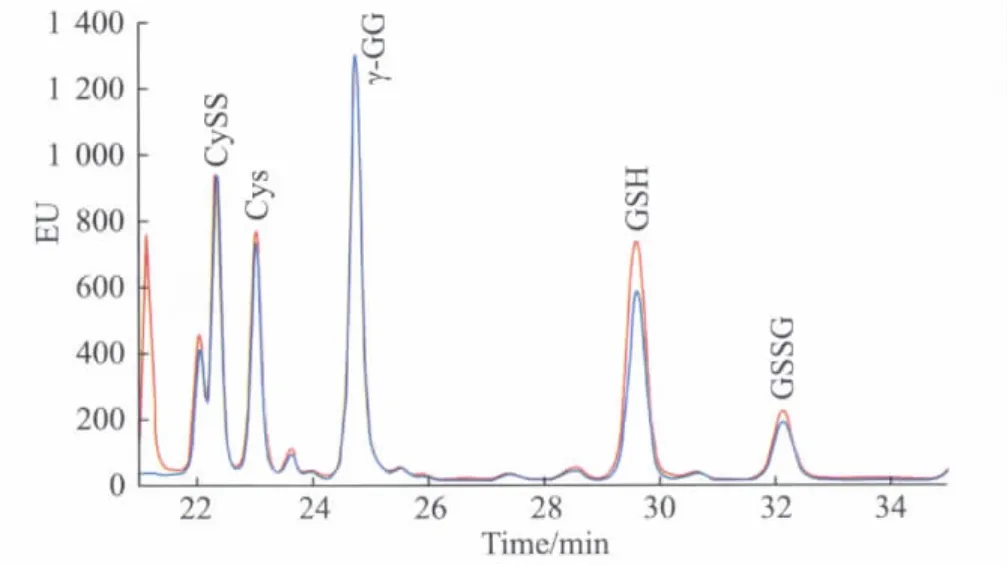
图1 HPLC重复分离、荧光检测标准品峰值图Fig.1 Replicated peak of standard were separated and detected by HPLCRed:the result from the first time;Blue:the result from the fifth time;HPLC:high performance liquid chromatography;CySS:cystine;Cys:cysteine;γ-GG:glutamylglutamateGSH:reduced glutathione;GSSG:oxideided glucathione.
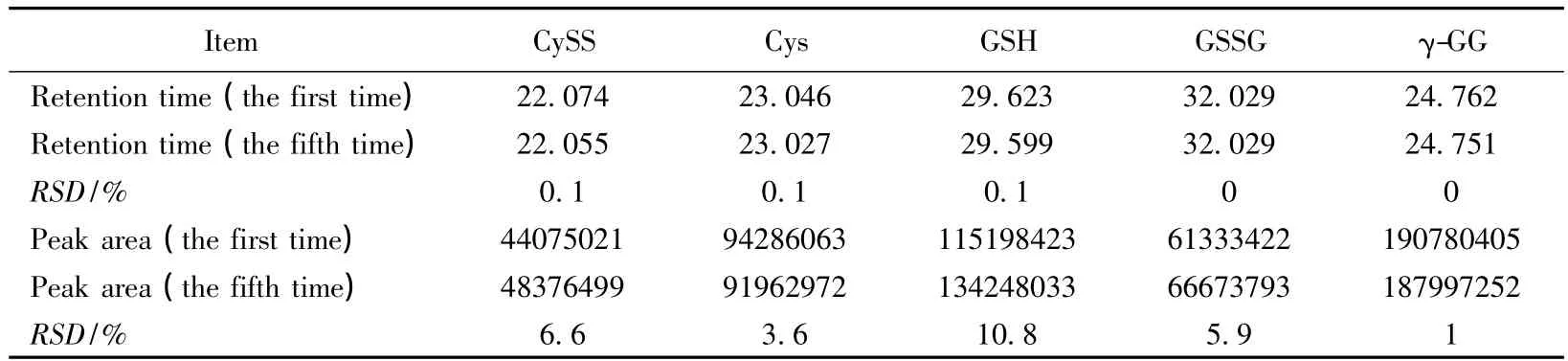
表2 重复性实验Tab.2 Repeatability of the assay
2.2 标准样品的稳定性检测
分别测定新鲜配制的标准样品与配制后置入-20℃保存90d的标准品,并对第1天和第90天的样品浓度进行检测,记录峰面积,计算RSD值。经较长时间冻存后,与新鲜制备的标准样品相比,GSH、GSSG、Cys、CySS的 RSD值分别为 7.5%,6.9%,6.4%和3.9%均小于10%,表明本方法制备的标准样品在-20℃环境中具有较好的稳定性。
2.3 血浆样品中Cys/CySS和GSH/GSSG的检测
根据血浆样品的制备方法1.2中3)制备HPLC大鼠血浆样品,并按照1.3实验方法分别检测混合标准样品、正常大鼠及帕金森大鼠模型的血浆样品中Cys、 CySS、GSH、GSSG的含量,详见图2。利用内标法公式:

内标γ-GG(10μmol/L),标准样品中各物质的浓度(5μmol/L),可 分 别 计 算 正 常 大 鼠 中 Cys (20.68 μmol/L)、 CySS (34.00μmol/L)、 GSH (25.3μmol/L)、GSSG(15.8μmol/L)和帕金森模型大鼠中 Cys(22.99μmol/L)、CySS(28.55μmol/L)、GSH (7.8μmol/L)、GSSG(18.5μmol/L)的含量。帕金森大鼠模型动物血浆中可能存在氧化还原电势的改变。
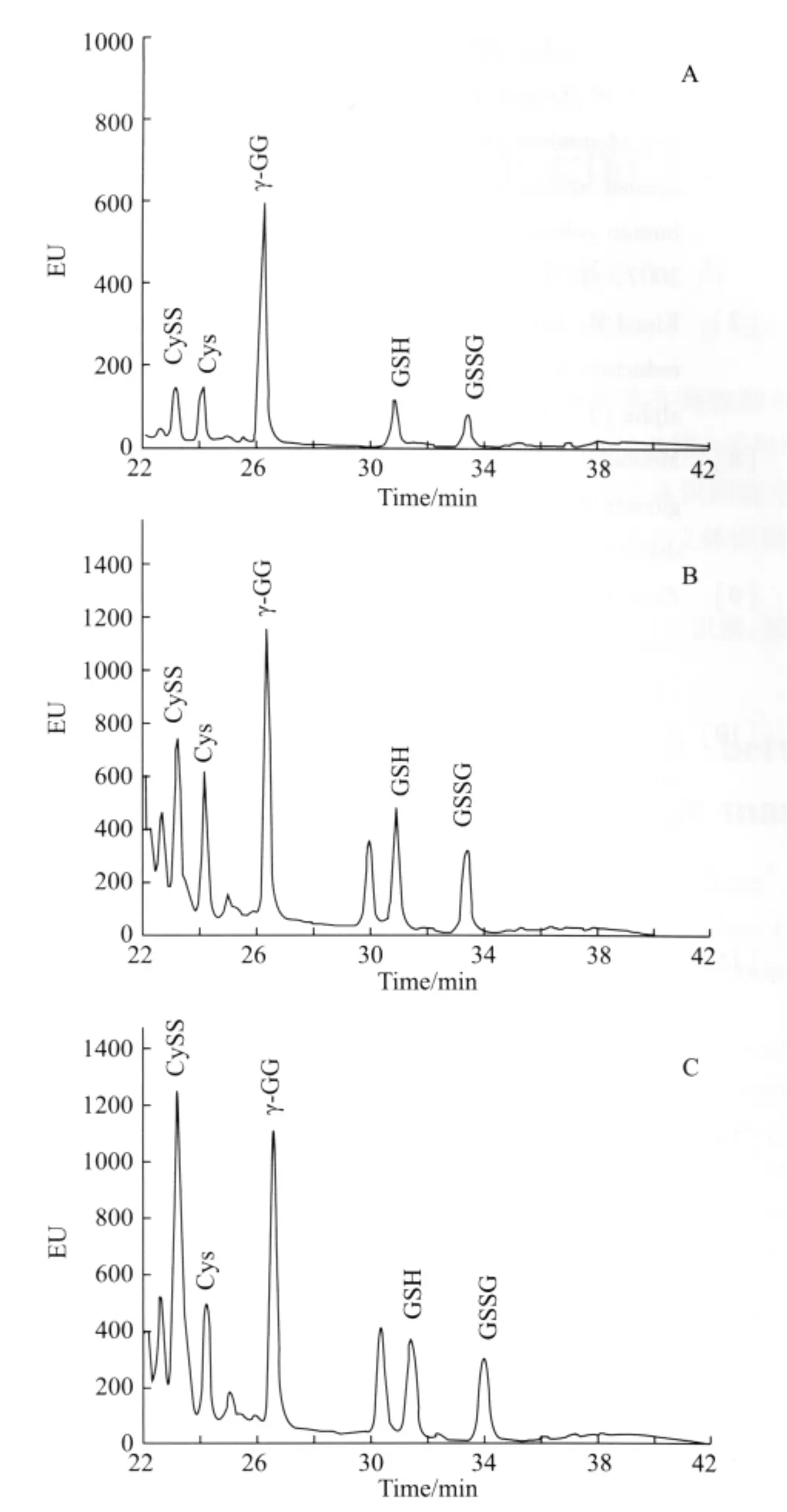
图2 HPLC分离、荧光检测大鼠血浆中Cys,CySS,GSH,GSSG峰值图Fig.2 Peaks of Cys,CySS,GSH,GSSG,in rat plasma were separated and detected by HPLCA:standard mixture containing each of Cys,CySS,GSH,GSSG at 5μmol/L and 10μmol/L internal standard,γ-GG;B:plasma sample from a healthy rat;C:plasma sample from a rat with Parkinson's disease;HPLC:high performance liquid chromatography;Cys:cysteine;CySS:cystine;GSH:reduced glutathione; GSSG:oxidized glutathione.
2.4 样品中氧化还原电势的计算
根据图2中各实验组测得的各组分的浓度,利用能斯特方程:Cys/CySSEh=-250+30 log[(CySS)/ (Cys)2],GSH/GSSGEh=-264+30 log[(GSSG)/ (GSH)2)分别计算大鼠血浆样品中的氧化还原电势(图3)。当血浆pH值为7.4时,正常大鼠的Cys/ CySSEh和GSH/GSSGEh分别为(-120.01±18.08) mV和(-131.60±2.45)mV,而在帕金森大鼠动物模型中Cys/CySSEh和GSH/GSSGEh分别为(-96.34± 9.98)mV和(-94.27±4.56)mV。与正常大鼠相比,帕金森大鼠动物模型血浆中 Cys/CySSEh和 GSH/ GSSGEh均发生了一定程度的氧化,进一步量化了帕金森大鼠动物模型中的氧化应激程度。
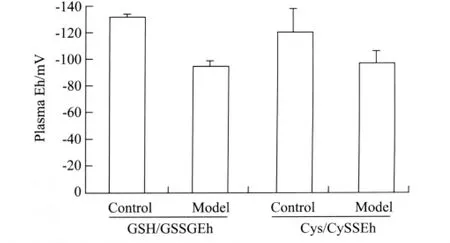
图3 不同组间大鼠Eh值柱状图Fig.3 Histograms of rat plasma Eh in different experimental groupsControl:rats injected with DMSO;Model:rotenone-induced rat model of PD;male Sprague-Dawley rats received rotenone(6 μg) injection for 3 weeks;Eh:redox potentials;Cys:cysteine;CySS:cystine;GSH:reduced glutathione;GSSG:oxidized glutathione.
3 讨论
含巯基/二硫键化合物在体内分布广泛,其多功能性也越来越引起广泛的注意。特别是近年来,活性氧、自由基以及氧化还原调控在体内的研究尤为重要[11]。目前国内文献[12]报道的方法主要集中在用HPLC检测血浆中还原态物质如GSH、Cys等的含量,未涉及相应氧化还原电势的检测。此外,疾病状态下Cys/CySSEh与GSH/GSSGEh并非同时发生变化[13],因此单独检测其中之一有可能对实验的准确性造成影响。而本方法可同时测定血浆内氧化态和还原态物质Cys、CySS、GSH、GSSG的含量,并可反映机体氧化还原能力重要的量化指标(氧化还原电势)。此方法的建立,为研究巯基依赖的氧化还原相关信号[1]提供了更加可靠的依据。
利用本研究方法制备样品时应注意以下几点:第一,在-20℃条件下,可维持样品的稳定性4~5个月,样品在-80℃条件下,则可稳定更长时间;第二,在样品制备过程中用到的高氯酸,有k+存在时会出现沉淀,因此在制备好的样品中如出现少量沉淀,并不会影响实验结果的准确性;第三,为保证色谱柱的使用寿命,可在上机操作前,适当离心弃去沉淀;第四,本研究所用方法是基于阴离子交换柱的原理建立的,带有不同负电荷的待测样品可以被梯度洗脱下来。因此实验成功的关键在于流动相Ⅰ与Ⅱ的比例。决定该比例的主要因素,除样品所带电荷数以外,还有色谱柱的柱龄。我们经过多次实验发现,随着柱龄的增加,待测样品与色谱柱的结合能力逐渐减弱,为了能够继续达到较好的分离效果,保证实验结果的准确性,可逐渐降低流动相中Ⅱ所占的比例。此外,在制备待测样品的过程中,防止样品制备过程中溶血现象的发生是实验成功的另一关键部分。因为红细胞中GSH的含量较血浆中高出很多。一旦样品制备过程中出现溶血现象,样品需丢弃,否则将严重影响实验的准确性。
此方法可被广泛用于测定与氧化应激相关的多种疾病,如肝损伤[14]、动脉粥样硬化、冠状动脉粥样硬化性心脏病、皮肤病、糖尿病、呼吸系统疾病、神经系统疾病、骨关节炎、风湿性关节炎[15-17]等,以及在不同营养状态和不同毒理学条件下,血浆、支气管肺泡灌洗液、淋巴液、脑脊液中Cys/CySS和GSH/GSSG氧化还原对的含量及相应的氧化还原电势,因而可成为检测与氧化应激相关疾病及病理条件下的新的临床诊断指标之一。
[1] Kemp M,Go Y M,Jones D P.Nonequilibrium thermodynamics of thiol/disulfide redox systems:a perspective on redox systems biology[J].Free Radic Biol Med,2008,44 (6):921-937.
[2] Bursell S E,King G L.The potential use of glutathionyl hemoglobin as a clinical marker of oxidative stress[J].Clin Chem,2000,46(2):145-146.
[3] Baynes J W,Thorpe S R.Role of oxidative stress in diabetic complications:a new perspective on an old paradigm[J].Diabetes,1999,48(1):1-9.
[4] Murr C,Fuith L C,Wridner B,et al.Increased neopterin concentrations in patients with cancer:indicator of oxidative stress[J].Anticancer Res,1999,19(3A):1721-1728.
[5] 高卫,谷利,杨荟敏,等.硫氧还蛋白-1(Trx1)氧化还原状态的检测[J].中国生物化学与分子生物学报,2010,26(4):374-379.
[6] Go Y M,Ziegler T R,Johnson J M,et al.Selective protection of nuclear thioredoxin-1 and glutathione redox systems against oxidation during glucose and glutamine deficiency in human colonic epithelial cells[J].Free Radic Biol Med,2007,42(3):363-370.
[7] Kim J R,Lee S M,Cho S H,et al.Oxidation of thioredoxin reductase in HeLa cells stimulated with tumor necrosis factoralpha[J].FEBS Lett,2004,567(2-3):189-196.
[8] Mourad T,Min K L,Steghens J P.Measurement of oxidized glutathione by enzymatic recycling coupled to ioluminescent detection[J].An Biochem,2000,283(2):146-152.
[9] Zhao T,Heberlein K,Jonas C,et al.New double quantum coherence filter for localized detection of glutathione in vivo[J].Magn Reson Med,2006,55(3):676-680.
[10]Rodriguez-Ariza A,Toribio F,López-Barea J.Rapid determination of glutathione status in fish liver using high-performance liquid chromatography and electrochemical dedection[J].J Chromatogr B Biomed Appl,1994,656(2):311-318.
[11]Ou Y,Geng P,Liao G Y,et al.Intracellular GSH and ROS levels may be related to galactose-mediated human lens epithelial cell apoptosis:role of recombinant hirudin variantⅢ[J].Chem Biol Interact,2009,179(2-3):103-109.
[12]何忠于,陈剑.利用粉末微电极检测谷胱甘肽及L-半胱氨酸[J].分析科学学报,2002,18(2):130-132.
[13]Anderson C L,Iyer S S,Ziegler T R,et al.Control of extracellular cysteine/cystine redox state by HT-29 cells[J].Am J Physiol Regul Integr Comp Physiol,2007,293(3):1069-1075.
[14]张立婷,何琦,熊亚星,等.还原型谷胧甘肤对氧化应激所致肝损伤的作用机制[J].湖南中医药大学学报,2009,29(8):15-17.
[15]冯欣,杜宇,潘坤,等.谷胱甘肽硫转移酶与氧化应激[J].医学研究与教育,2010,27(5):80-83.
[16]魏剑芬,程燕,陈冬.糖尿病肾病患者血清同型半胱氨酸与氧化应激的关系[J].天津医药,38(10):871-873.
[17]夏豫,周瑾,李春林,等.超敏C反应蛋白与血清同型半胱氨酸联合检测诊断冠心病的价值[J].临床误诊误治,2010,23(12):1140-1141.
- 首都医科大学学报的其它文章
- 两种β-环糊精对苯环壬酯手性识别的串联四极杆质谱研究

