结核分枝杆菌感染动物模型的研究进展
张昊凌, 张志勇,
1. 复旦大学附属中山医院,上海 200032; 2. 上海市(复旦大学附属)公共卫生临床中心,上海 201508
结核病(tuberculosis)是由结核分枝杆菌(Mycobacteriumtuberculosis)引起的全世界范围内高发、难治的呼吸道传染病之一,位居单一病原引起死亡的严重传染病之首。结核病病变复杂,具有多种感染形式和临床分型,可引起以肺结核为主的几乎全身各组织器官病变。近年来,随着结核病发病率和病死率逐年升高,有关结核病的各项研究已成为全球学者关注的热点。在理解结核病发病机制、结核分枝杆菌致病过程及抗结核治疗的有效性时,宿主的免疫反应、宿主与病原的相互作用等都影响着结核病的发生和严重程度。因此,应根据研究目的和实验条件,选择合适的动物,建立符合研究需要的结核病模型。将动物模型引入对结核分枝杆菌感染的探索,避免了人体试验的风险,还可严格控制实验条件,增强实验材料可比性,有助于更全面认识结核病本质,研究其发病机制,评估抗结核新药与诊断试剂的有效性,研制和开发新疫苗等[1]。现将近年来结核病研究中最常用的感染动物模型综述如下。
1 概述
尽管对结核分枝杆菌易感的动物种类较多,研究模型的选择范围较广,但各种动物对结核分枝杆菌的易感性和疾病的表现形式各不相同。目前结核病动物模型最常用的动物包括豚鼠、小鼠、兔,此外还有非人灵长类和鱼类等,每种动物模型都各有特点。
2 结核分枝杆菌感染动物模型的比较
2.1 豚鼠模型
豚鼠(Guinea pig)对结核分枝杆菌高度敏感,其感染后的病理改变酷似人类,且模型存活率高,是目前国际公认的建立结核病实验动物模型的最佳选择。
豚鼠最常见的感染途径是气溶胶吸入,也可采用静脉注射的方式,如经前肢、腹股沟或大腿内侧皮下和腹腔等。低剂量结核分枝杆菌就能使豚鼠发展成与人类相似的结构典型的肉芽肿,呈现出人类肉芽肿中常见的朗格汉斯多核巨细胞,进而发生液化坏死。豚鼠模型可复制人类感染结核分枝杆菌的许多方面,特别是儿童和免疫功能缺陷患者的结核病。因此,豚鼠在研究结核分枝杆菌呼吸道传播、肉芽肿形成和干酪样坏死方面具有重要价值。也有学者将豚鼠用于研究营养不良与结核分枝杆菌感染后细胞免疫(cell-mediated immunity)反应之间的关系[2]。
此外,豚鼠的迟发型超敏反应(delayed type hypersensitivity, DTH)强烈,广泛应用于抗结核药物和相关生物制剂检测中,已成为人类结核菌素皮肤试验(tuberculin skin test, TST)效能和生物制品鉴定的金标准。对豚鼠皮内或皮下注射低剂量的卡介苗十分有效,且疫苗的保护作用并不依赖其接种途径,通过气溶胶方式接种卡介苗与肠外免疫接种效果相当,都对结核病的发展进程具有重要影响。豚鼠还被用于一些结核分枝杆菌突变株检验实验以鉴定其毒力因子[3]。
近年来,有关豚鼠细胞因子和趋化因子的基因克隆和重组表达以及豚鼠感染结核分枝杆菌后相关免疫试剂的研发较多[4]。研究发现,在低剂量气溶胶感染后的豚鼠肺部应用单克隆抗体可出现大量免疫细胞聚集。用流式细胞技术结合免疫组织化学跟踪检测T细胞、B细胞、异嗜性细胞和嗜酸性粒细胞,结果发现早期参与反应的T细胞主要是CD4+T细胞,且感染30 d后豚鼠肺内这些细胞数量急剧下降,而与肺部病变加剧密切相关的B细胞和嗜酸性粒细胞数量稳定增加。该研究显示,豚鼠感染结核分枝杆菌后,介导保护性免疫反应和宿主免疫病理机制的细胞类型不同[5]。
由于缺乏研究宿主免疫反应的免疫学分析试剂,豚鼠应用受限。然而就病理学研究而言,大量细胞因子和炎性细胞试剂的应用不断增加,为豚鼠模型的研究开辟了新的道路。
2.2 小鼠模型
小鼠体型小、价格低廉、种群数量庞大、生长繁殖快,易于维持生物安全三级实验室(biosafety level 3 laboratory,BSL-3实验室)环境,且测定细胞因子和免疫细胞的试剂、抗体供应充足,加上相对成熟的定向基因敲除技术,因此对其免疫系统的研究比较透彻,已广泛应用于结核分枝杆菌突变、免疫反应、结核病发病机制、抗结核药物疗效评价和疫苗筛选等方面的研究,成为体内研究结核分枝杆菌优先考虑的动物模型。
小鼠对结核分枝杆菌较其他动物不够敏感,其肺内可耐受相对大量的结核分枝杆菌,其他器官无结核病症状。使用相同的感染方式和感染剂量,不同品系的小鼠对结核分枝杆菌的敏感性不同。C57BL/6小鼠是近交系小鼠中对结核分枝杆菌最敏感的动物;基因敲除小鼠对结核分枝杆菌易感且反应快,是最早进行体内单独抗结核药物检测的模型;严重联合免疫缺陷(severe combined immune deficiency, SCID)小鼠和裸小鼠由于缺乏T细胞和B细胞,不能抵抗结核分枝杆菌的感染,常用于检测巨噬细胞抵御结核分枝杆菌感染的能力[6,7]。
给予相对低剂量的结核分枝杆菌气溶胶(约50 CFU)经呼吸道感染小鼠,可成功建立自然复发和药物诱导复发的潜伏期感染动物模型,感染剂量可通过调节暴露感染时间和菌液浓度来实现[8]。小鼠肺部的结核分枝杆菌数量以对数形式增长,然后达峰值,与肺部细胞免疫进展一致[9],直到第2个月达到平稳期。峰值预示感染的持续,也可能是结核分枝杆菌在巨噬细胞内的新陈代谢相对静止。感染初期被认为是急性阶段,适于研究结核分枝杆菌诱导的免疫反应。在慢性感染阶段,小鼠体内细菌的复制速度降低,肺内细菌的数量稳定[10],代表宿主与病原之间的静态平衡。在慢性感染期内,结核分枝杆菌抗原在小鼠肺内持续积累[11],免疫抑制可引起疾病复发和结核病暴发。
小鼠感染结核分枝杆菌后形成肉芽肿结构及其过程与人类和其他易感动物不同。人类肉芽肿由淋巴细胞及周围环绕的巨噬细胞组成特异性结构,常发展为干酪样坏死,伴纤维化包裹、钙化,甚至形成空洞。小鼠肉芽肿虽由淋巴细胞和巨噬细胞组成,但细胞排列不如人类肉芽肿典型,差异小。除非肺组织结核分枝杆菌含量极高,否则一般不形成明显的干酪样坏死,但可引起T细胞介导的免疫反应,且小鼠肺损伤也不能发展为空洞。这主要是由于强烈的细胞反应和产生的初始抵抗控制了结核分枝杆菌增殖和疾病进展[1]。研究发现,Toll样受体9(Toll-like receptor 9,TLR9)激活对结核分枝杆菌引起肺肉芽肿很重要,是结核分枝杆菌感染后的保护性免疫标记[12]。
小鼠对结核分枝杆菌抗原产生的DTH较豚鼠和兔要轻,而人类的DTH比任何实验动物都明显。换言之,发生干酪样坏死在人类只需要低浓度结核分枝杆菌抗原,而在豚鼠和兔中却需要稍高浓度。对于研究新疫苗中结核分枝杆菌抗原的DTH,豚鼠和兔较小鼠更合适。同时,小鼠很少发生干酪样坏死,且对结核分枝杆菌的免疫反应只需1周,主要是细胞免疫;而豚鼠呈现明显的干酪样坏死,对结核分枝杆菌的免疫反应更强烈,主要是DTH。因此,小鼠比豚鼠更适合研究新疫苗中结核分枝杆菌抗原的细胞免疫[13],有利于理解不同免疫反应机制的作用。
2.3 兔模型
实验中使用的兔品系多为新西兰兔,常用于人类感染结核分枝杆菌的替代模型。肺部感染途径以气溶胶多见,也可皮内注射造成皮肤结核模型。兔对牛分枝杆菌(Mycobacteriumbovis)极其敏感,且吸入牛分枝杆菌后引起的肺部病变更接近于人类,易形成空洞,引起结核分枝杆菌在支气管播散。近交系兔较非近交系兔对结核分枝杆菌敏感,且肺组织病变明显,形成的干酪样坏死和活菌数量更多,成熟的上皮样细胞更少[14]。但由于缺少合适的反应分析试剂,该模型的免疫学研究受限。
兔模型分为易感和抵抗(常用的是类似于Lurie抵抗菌株)模型。易感模型中结核分枝杆菌生长更快,需更高的浓度引起免疫反应。病灶内坏死进展快,但没有液化,这可能是由于模型过早死亡或巨噬细胞还未激活。易感兔的细胞免疫反应弱,因此不断通过组织坏死的免疫反应(引起坏死的DTH)使细胞内结核分枝杆菌复制停止,然后病灶中央的干酪样坏死范围扩大,局部肺组织破坏。最后,伴随结核分枝杆菌感染,易感兔模型显示强DTH,因为该类模型中的结核分枝杆菌浓度更高,抗原引起的刺激更大。由于DTH与细胞免疫有关,局部特异性淋巴细胞引起巨噬细胞感染,或在TST时引起嗜菌细胞反应。但引起各反应的抗原浓度是不同的:纯蛋白衍生物(purified protein derivative,PPD)引起DTH的浓度低,而引起细胞免疫的浓度高。兔模型TST反应越强烈,空洞形成越多,这可能是由于此类模型含有大量结核分枝杆菌,与临床研究结果一致,即患者的TST阳性反应越明显,越易发展为活动性肺结核[15]。
结核性脑膜炎(tuberculous meningitis,TBM)是结核分枝杆菌感染后最严重的临床表现。选择兔作为结核分枝杆菌的感染模型,比较不同菌株毒力[16]和卡介苗免疫对临床分离的结核分枝杆菌强毒株HN878和实验株H37Rv感染后中枢神经系统的保护力。结果发现,卡介苗对2种毒株感染均有保护力,但对HN878毒株感染后的保护力弱,不能有效阻止结核分枝杆菌感染向肝、脾蔓延,也不能阻止感染引起的体重减轻、肺和脑部病变及临床症状的出现。因此,在使用动物模型检验新研发疫苗的保护效力时,不仅要用结核分枝杆菌标准株H37Rv,还要用像北京株一样的强毒株[17]。
用H37Rv气溶胶感染兔以模拟人类结核病的潜伏期感染,发现感染5周后所有模型肺部荷菌量达到顶峰,随后感染被控制。持续的低剂量结核分枝杆菌感染36周后,1/3兔模型出现至少1个干酪样肉芽肿,同时72%兔模型右上肺结核分枝杆菌培养阳性。用地塞米松间断给药可诱导淋巴结复发,停药后一部分兔发展为多中心明显的干酪样肉芽肿[18]。类固醇类药物诱导的免疫缺陷兔模型,也用于再复发和免疫重建炎症综合征(immune reconstitution inflammatory syndrome, IRIS)的研究。复发和IRIS有助于理解免疫缺陷后的发病机制,提高对疾病特殊时期的诊断。
2.4 非人灵长类模型
非人灵长类(non-human primate)对结核分枝杆菌易感,且其具有与人相似的生理和遗传特征,能通过与人相似的感染途径发展类似人类的疾病,无可争议地成为人类结核病基础及临床前研究最理想的动物模型。
非人灵长类最早可在感染后28周出现空洞。用低剂量气溶胶感染猕猴、恒河猴,能复制人类结核病潜伏期感染和复发表现。在TST和PPD特异性淋巴细胞反应检测中,只有60%模型发展为急性肺结核。猕猴能通过卡介苗接种获得免疫,通过猴免疫缺陷病毒(simian immunodeficiency virus, SIV)和结核分枝杆菌合并感染模型的研究,对研究人类免疫缺陷病毒(human immunodeficiency virus,HIV)与结核分枝杆菌在同一宿主体内的相互作用具有重要价值。猕猴感染SIV后,CD4细胞数量下降引起结核病复发,但不形成空洞,这与HIV合并结核分枝杆菌感染的患者表现类似[19,20]。
建立非人灵长类结核病动物模型有助于进一步研究机体感染结核分枝杆菌后的免疫反应,尤其在评价结核新疫苗的有效性和安全性以及提供临床前免疫数据方面具有独特优势[21]。然而DTH在非人灵长类的皮肤反应相对较弱,TST阳性率低[22]。比较卡介苗对猕猴和食蟹猴结核分枝杆菌感染的免疫效果,发现未免疫组出现C反应蛋白升高、结核分枝杆菌特异性IgG、空洞和干酪样坏死的广泛病变,卡介苗几乎完全阻止了食蟹猴病变的进展,肺部活菌数量以对数形式减少。但猕猴并不能受到卡介苗的有效保护,说明不同品系动物对结核分枝杆菌感染的保护机制不同[23]。对感染结核分枝杆菌的猕猴,重组卡介苗(rBCG-Ag85A)比传统卡介苗诱导出更好的保护效果[24],这使研究者们对应用非人灵长类模型进行疫苗评价产生了巨大兴趣[25]。
非人灵长类模型数量有限、价格昂贵、操作困难,感染模型的建立依赖BSL-3实验室;且非人灵长类对结核分枝杆菌高度易感,容易引起疾病暴发,因此限制了其在临床前期试验(如疫苗检测和药物评估)中的应用[26]。
2.5 斑马鱼模型
斑马鱼 (Daniorerio) 具有体型短小、易于饲养、繁殖能力强及基因组与人类相似等特点,作为结核病研究的新型替代动物模型,其优势逐渐被认识。斑马鱼的免疫系统发育完全成熟,具有较为完整的先天性和获得性免疫系统,是继小鼠之后又一个重要的脊椎动物模型。海鱼分枝杆菌和嗜血分枝杆菌对斑马鱼具有高致病性,感染后形成的结核肉芽肿与人类肺结核肉芽肿一样,会发生干酪样液化坏死。有学者利用斑马鱼和青鳉鱼通过腹腔注射方式感染海鱼分枝杆菌,成功建立了结核病模型,模拟人类结核病形成的肉芽肿,以及由于感染菌株和接种菌量不同所引发的急性或慢性结核病病变[27-29]。
表1常见结核病动物模型特点比较
Tab.1Comparisonoffeaturesofcommonanimalmodelsoftuberculosis
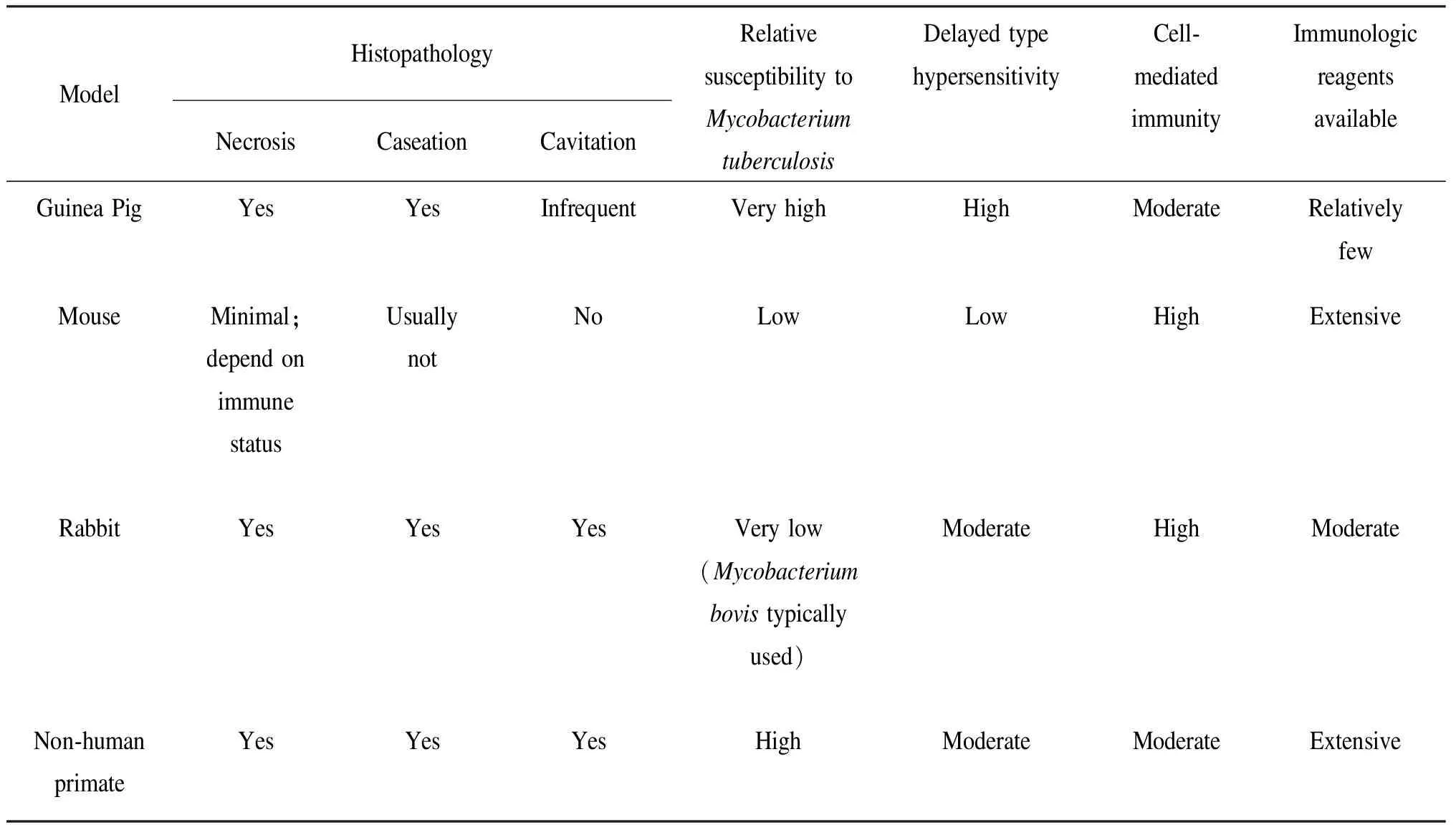
ModelHistopathologyNecrosis CaseationCavitationRelativesusceptibility to Mycobacterium tuberculosisDelayed type hypersensitivityCell-mediated immunityImmunologicreagentsavailableGuinea PigYesYesInfrequentVery highHighModerateRelatively fewMouseMinimal;depend onimmune statusUsually notNoLowLowHighExtensiveRabbitYesYesYesVery low(Mycobacterium bovis typically used)ModerateHighModerateNon-human primateYesYesYesHighModerateModerateExtensive
Reproduced from reference 1.
研究发现,肉芽肿的形成过程不但可实时监测,而且结核分枝杆菌可直接进入已形成的肉芽肿。这个出乎意料的发现表明,肉芽肿可控制感染;同时,结核分枝杆菌也可能利用肉芽肿环境为其存活提供保护。鱼类模型的这一特性为人们认识结核分枝杆菌发病机制和宿主反应提供了新范例[30]。
3 结语
综上所述,结核病感染动物模型各有特点(表1),应根据研究需要选择合适及敏感的实验动物、感染方式和感染剂量。随着对结核病的深入研究,各种检测试剂和实验技术的应用,结核病动物模型在阐明结核分枝杆菌毒力基因及其在宿主体内持续存活并致病的机制,评价结核新疫苗、诊断试剂和替代治疗药物方面将会发挥更大作用,从而使人们更深入了解结核分枝杆菌与宿主之间的相互作用,寻找预防、诊断和治疗结核病的新方法。
[1] Dharmadhikari AS, Nardell EA. What animal models teach humans about tuberculosis [J]. Am J Respir Cell Mol Biol, 2008, 39(5):503-508.
[2] Cegielski JP, McMurray DN. The relationship between malnutrition and tuberculosis: evidence from studies in humans and experimental animals [J].Int J Tuberc Lung Dis, 2004, 8(3): 286-298.
[3] Fenhalls G, Stevens L, Bezuidenhout J, Amphlett GE, Duncan K, Bardin P, Lukey PT. Distribution of IFN-gamma, IL-4 and TNF-alpha protein and CD8 T cells producing IL-12p40 mRNA in human lung tuberculous granulomas [J]. Immunology, 2002, 105(3): 325-335.
[4] Ly LH, Russell MI, McMurray DN. Microdissection of the cytokine milieu of pulmonary granulomas from tuberculous guinea pigs [J]. Cell Microbiol, 2007, 9(5):1127-1136.
[5] Ordway D, Palanisamy G, Henao-Tamayo M, Smith EE, Shanley C, Orme IM, Basaraba RJ. The cellular immune response to Mycobacterium tuberculosis infection in the guinea pig [J]. J Immunol, 2007, 179(4):2532-2541.
[6] Shiloh MU, Manzanillo P, Cox JS. Mycobacterium tuberculosis senses host-derived carbon monoxide during macrophage infection [J]. Cell Host Microbe, 2008, 3(5):323-330.
[7] Guo M, Feng H, Zhang J, Wang W, Wang Y, Li Y, Gao C, Chen H, Feng Y, He ZG. Dissecting transcription regulatory pathways through a new bacterial one-hybrid reporter system [J]. Genome Res, 2009, 19(7):1301-1308.
[8] Ha SJ, Jeon BY, Kim SC, Kim DJ, Song MK, Sung YC, Cho SN. Therapeutic effect of DNA vaccines combined with chemotherapy in a latent infection model after aerosol infection of mice with Mycobacterium tuberculosis [J]. Gene Ther, 2003,10(18):1592-1599.
[9] Lazarevic V, Nolt D, Flymm JL. Long-term control of Mycobacterium tuberculosis infection is mediated by dynamic immune response [J]. J Immunol, 2005, 175(2):1107-1117.
[11] Lazarevic V, Yankura DJ, DiVito SJ, Flynn JL. Induction of Mycobacterium tuberculosis-specific primary and secondary T-cell responses in interleukin-15-deficient mice [J]. Infect Immun, 2005, 73(5):2910-2922.
[12] Ito T, Schaller M, Hogaboam CM, Standiford TJ, Sandor M, Lukacs NW, Chensue SW, Kunkel SL. TLR9 regulates the mycobacteria-elicited pulmonary granulomatous immune response in mice through DC-derived Notch ligand delta-like 4 [J]. J Clin Invest, 2009, 119(1):33-46.
[13] Dannenberg AM Jr. Perspectives on clinical and preclinical testing of new tuberculosis vaccines [J]. Clin Microbiol Rev, 2010, 23(4): 781-794.
[14] Dorman SE, Hatem CL, Tyagi S, Aird K, Lopez-Molina J, Pitt ML, Zook BC, Dannenberg AM Jr, Bishai WR, Manabe YC. Susceptibility to tuberculosis: clues from studies with inbred and outbred New Zealand white rabbits [J]. Infect Immun, 2004, 72(3):1700-1705.
[15] Cardona PJ. A spotlight on liquefaction: evidence from clinical settings and experimental models in tuberculosis [J]. Clin Dev Immunol, 2011,2011: 868246. doi: 10.1155/2011/868246
[16] Tsenova L, Ellison E, Harbacheuski R, Moreira AL, Kurepina N, Reed MB, Mathema B, Barry CE 3rd, Kaplan G. Virulence of selected Mycobacterium tuberculosis clinical isolates in the rabbit model of meningitis is dependent on phenolic glycolipid produced by the bacilli [J]. J Infect Dis, 2005, 192(1):98-106.
[17] Tsenova L, Harbacheuski R, Sung N, Ellison E, Fallows D, Kaplan G. BCG vaccination confers poor protection against M. tuberculosis HN878-induced central nervous system disease [J]. Vaccine, 2007, 25(28): 5126-5132.
[18] Manabe YC, Kesavan AK, Lopez-Molina J, Hatem CL, Brooks M, Fujiwara R, Hochstein K, Pitt ML, Tufariello J, Chan J, McMurray DN, Bishai WR, Dannenberg AM Jr, Mendez S. The aerosol rabbit model of TB latency, reactivation and immune reconstitution inflammatory syndrome [J]. Tuberculosis, 2008, 88(3):187-196.
[19] Shen Y, Zhou D, Chalifoux L, Shen L, Simon M, Zeng X, Lai X, Li Y, Sehgal P, Letvin NL, Chen ZW. Induction of an AIDS virus-related tuberculosis-like disease in macaques: a model of simian immunodeficiency virus-mycobacterium coinfection [J]. Infect Immun, 2002, 70(2): 869-877.
[20] Capuano SV 3rd, Croix DA, Pawar S, Zinovik A, Myers A, Lin PL, Bissel S, Fuhrman C, Klein E, Flynn JL. Experimental Mycobacterium tuberculosis infection of cynomolgus macaques closely resembles the various manifestations of human M. tuberculosis infection [J]. Infect Immun, 2003, 71(10): 5831-5844.
[21] Langermans JA, Doherty TM, Vervenne RA, van der Laan T, Lyashchenko K, Greenwald R, Agger EM, Aagaard C, Weiler H, van Soolingen D, Dalemans W, Thomas AW, Andersen P. Protection of macaques against Mycobacterium tuberculosis infection by a subunit vaccine based on a fusion protein of antigen 85B and ESAT-6 [J]. Vaccine, 2005, 23(21): 2740-2750.
[22] Helke KL, Mankowski JL, Manabe YC. Animal models of cavitation in pulmonary tuberculosis [J]. Tuberculosis, 2006, 86(5): 337-348.
[23] Langermans JA, Andersen P, van Soolingen D, Vervenne RA, Frost PA, van der Laan T, van Pinxteren LA, van den Hombergh J, Kroon S, Peekel I, Florquin S, Thomas AW. Divergent effect of bacillus Calmette-Guérin (BCG) vaccination on Mycobacterium tuberculosis infection in highly related macaque species: implications for primate models in tuberculosis vaccine research [J]. Proc Natl Acad Sci USA, 2001, 98(20):11497-11502.
[24] Sugawara I, Sun L, Mizuno S, Taniyama T. Protective efficacy of recombinant BCG Tokyo (Ag85A) in rhesus monkeys (Macaca mulatta) infected intratracheally with H37Rv Mycobacterium tuberculosis [J]. Tuberculosis (Edinb), 2009, 89(1): 62-67.
[25] Reed S, Lobet Y. Tuberculosis vaccine development; from mouse to man [J]. Microbes Infect, 2005, 7(5-6): 922-931.
[26] Gupta UD, Katoch VM. Animal models of tuberculosis [J]. Tuberculosis (Edinb),2005, 85(5-6):277-293.
[27] Watral V, Kent ML. Pathogenesis of Mycobacterium spp. in zebrafish (Danio rerio) from research facilities [J]. Comp Biochem Physiol C Toxicol Pharmacol, 2007, 145(1): 55-60.
[28] van der Sar AM, Spaink HP, Zakrzewska A, Bitter W, Meijer AH. Specificity of the zebrafish host transcriptome response to acute and chronic mycobacterial infection and the role of innate and adaptive immune components [J]. Mol Immunol, 2009, 46(11-12): 2317-2332.
[29] Broussard GW, Ennis DG. Mycobacterium marinum produces long-term chronic infections in medaka: a new animal model for studying human tuberculosis [J]. Comp Biochem Physiol C Toxicol Pharmacol, 2007, 145(1): 45-54.
[30] Cosma CL, Humbert O, Sherman DR, Ramakrishnan L. Trafficking of superinfecting Mycobacterium organisms into established granulomas occurs in mammals and is independent of the Erp and ESX-1 mycobacterial virulence loci [J]. J Infect Dis, 2008, 198(12): 1851-1855.

