银星竹鼠巨噬细胞对马尔尼菲青霉分生孢子的吞噬作用的实验研究*
张 勇,胡永轩,李希清,杨亚波,张军民,鲁 莎,席丽艳
马尔尼菲青霉病(Penicilliosis marneffei,PSM)是由马尔尼菲青霉(Penicillium marneffei,P.marneffei)感染引起的地域性深部真菌病,主要在东南亚地区如泰国、越南、印度、老挝、柬埔寨,以及中国广东、广西等地流行[1-2]。人感染此病多认为是吸入马尔尼菲青霉分生孢子引起。多年来一直认为竹鼠可能与人感染马尔尼菲青霉有关,可能作为马尔尼菲青霉传播的贮存宿主[3]。竹鼠(Rhizomyidae;bamboo rats)又名竹狸、竹鼬、冬芒狸、竹根鼠、竹根猪,在动物分类学上属于脊椎动物亚门、哺乳纲、啮齿目、竹鼠科、竹鼠属。其流行分布与马尔尼菲青霉病流行分布区域大致一致,分布于南亚及东非一带,我国的竹鼠属有大竹鼠、中华竹鼠、银星竹鼠,分布于我国广东、广西、云南、福建、湖南、贵州等地[4]。目前从大多数地区野生竹鼠不同组织中均能分离出P.marneffei,文献报道各地分离率不等,曹存巍等人对广西43只野生银星竹鼠进行研究发现马尔尼菲青霉分离率达100%,而李希清等对广东地区野生竹鼠的研究表明马尔尼菲青霉分离率为70%[5-6];其中常见分离部位为肺、脾脏、肝脏、淋巴结、肠系膜等[5-6],但是竹鼠多未表现出临床感染症状,组织病理改变轻微[7]。到目前为止,竹鼠在马尔尼菲青霉传播途径中的作用与地位尚不明确。
本研究拟从银星竹鼠常见的能分离出马尔尼菲青霉的组织部位获得原代巨噬细胞,并进行初步鉴定,了解巨噬细胞对马尔尼菲青霉分生孢子的吞噬情况,探讨不同组织部位在细胞水平与马尔尼菲青霉的相互关系,为进一步研究竹鼠与马尔尼菲青霉及马尔尼菲青霉病的相互关系提供新的思路。
1 材料与方法
1.1 实验动物 银星竹鼠购自广东从化某野生竹鼠驯化养殖场。
1.2 主要试剂与仪器 Dulbecco's Modified Eagle’s Medium (DMEM)、Fetal bovine serum(FBS)为Gibco产品,瑞氏-吉姆萨染液、绿色荧光素5-FITC为美国AnaSpec产品,红细胞裂解液购自普利莱基因技术有限公司,其它试剂为生化常用试剂。二氧化碳培养箱、倒置显微镜及照相系统为孙逸仙纪念医院医学研究中心提供,透射电镜为广州军区广州总医院提供。
1.3 巨噬细胞分离培养
1.3.1 肺泡巨噬细胞分离培养 使用10%水合氯醛腹腔注射麻醉竹鼠后,用75%酒精浸泡3~5 min。参考文献[8-9],采用支气管肺泡灌洗的方法获得肺泡巨噬细胞。4℃离心(1 500r/min)10min,弃上清液。加入5mL含10%FBS的DMEM培养基重悬细胞,0.4%台盼蓝染液染色2~3min,镜下观察蓝染细胞比例,然后再高倍镜下细胞计数,并调整细胞浓度为2×106个/mL。分装至培养瓶或培养板中,置于37℃、5%CO2、饱和湿度的培养箱内孵育。2~2.5h后,弃去非贴壁细胞,贴壁细胞即为巨噬细胞,加入新的含10%FBS的DMEM培养基继续培养备用。
1.3.2 腹腔巨噬细胞分离培养 参照文献[8,10]所述方法,采用乙醚吸入法麻醉竹鼠后,用75%酒精浸泡3~5min,腹腔注入4℃预冷PBS 50~100 mL,仰卧并轻揉竹鼠腹部2~3min,回抽并收集腹腔冲洗液。离心及纯化等过程与肺泡巨噬细胞的收集步骤相同。
1.3.3 脾脏巨噬细胞分离培养 无菌条件下手术分离脾脏,剪成1mm×1mm组织块,4℃预冷PBS洗涤3次,DMEM培养基洗涤2次,机械研磨组织块,200目不锈钢网过滤2次,获得脾脏组织混悬液(主要含红细胞、淋巴细胞、巨噬细胞),红细胞裂解液裂解去除红细胞后PBS洗涤2次,DMEM培养基洗涤1次。分装至培养瓶或培养板中,置于37℃、5%CO2、饱和湿度的培养箱内孵育。1.5h后,弃去非贴壁细胞,贴壁细胞即为巨噬细胞,加入新的含10%FBS的DMEM培养基继续培养备用[8,11-12]。
1.4 细胞形态学观察
1.4.1 瑞氏-吉姆萨染色 每日用倒置相差显微镜观察贴壁细胞的形态及生长状况。将培养2d的巨噬细胞,制成细胞爬片,按试剂说明书进行细胞染色,中性树脂封片,显微镜下观察。
1.4.2 透射电镜观察 使用细胞刮子刮下培养3d的贴壁巨噬细胞,PBS洗涤2次,离心后弃上清,细胞沉淀用4%的戊二醛固定过夜。按照透射电镜超薄切片制作方法进行系列脱水、包埋、制作超薄切片,透射电镜下观察。
1.5 吞噬功能检测
1.5.1 透射电镜观察巨噬细胞吞噬马尔尼菲青霉分生孢子 参考文献[13]获得马尔尼菲青霉分生孢子悬液,按5∶1比例与培养2d的巨噬细胞共培养2h后收集细胞,常规透射电镜制片并观察。
1.5.2 流式细胞技术检测巨噬细胞的吞噬率 将绿色荧光素5-FITC用DMSO配成使用浓度后与马尔尼菲青霉分生孢子共孵育1h,再与培养2d的巨噬细胞共培养2h,台盼蓝淬灭5-FITC 15min,洗涤收集巨噬细胞,流式细胞仪测定吞噬率,实验结果采用SPSS 13.0统计软件进行分析。
2 结 果
2.1 竹鼠巨噬细胞形态观察
2.1.1 普通显微镜观察 将分离到的竹鼠巨噬细胞培养24h后镜下观察,可见肺泡巨噬细胞多贴壁生长,细胞呈圆形、椭圆形、三角形或不规则形,多有伪足。腹腔及脾脏来源巨噬细胞较肺泡巨噬细胞体积小,不完全贴壁,大多呈圆形、椭圆形,部分呈三角形,不规则形(图1)。培养过程中三种来源的巨噬细胞未见明显细胞有丝分裂相。培养4d后,细胞形态变异较大,贴壁细胞开始减少,有细胞碎片。
2.1.2 瑞氏-吉姆萨染色 细胞经瑞氏-吉姆萨染色后,光镜观察可见细胞界限清楚。肺泡巨噬细胞形态多样,有钝圆形突起胞浆较多,核大深染,为卵圆形、肾形、马蹄形或不规则形,偏居于细胞的一侧。腹腔及脾脏来源巨噬细胞较肺泡巨噬细胞体积小,大多呈圆形、椭圆形,部分呈三角形,不规则形,胞浆相对较少(图2)。
2.1.3 透射电镜观察 电镜下可见细胞形状不规则,细胞表面有数量不等微皱褶、微绒毛;细胞核呈卵圆形或马蹄形;细胞质丰富,内有大量溶酶体,线粒体数量较少,呈不规则圆球形,部分线粒体嵴略有肿胀,可见少量游离核糖体和内质网等细胞器,有些细胞内有大量泡状小体,呈椭圆形或圆形,具有巨噬细胞形态结构特点(图3)。
2.2 吞噬功能检测
2.2.1 电镜观察巨噬细胞吞噬马尔尼菲青霉分生孢子 不同来源巨噬细胞与马尔尼菲青霉分生孢子共培养2h后,可见部分细胞吞噬有数量不等的真菌孢子,且吞噬马尔尼菲青霉分生孢子的巨噬细胞表面突起较多,较粗大,吞噬空泡较多(图3),具有巨噬细胞吞噬特性。巨噬细胞细胞器如线粒体、内质网、溶酶体等未见明显数量及结构变化。被巨噬细胞吞噬的马尔尼菲青霉分生孢子形态结构也未见明显改变。
2.2.2 流式细胞技术检测吞噬率 采用流式细胞仪测定肺泡、腹腔、脾脏巨噬细胞对马尔尼菲青霉分生孢子的吞噬率分别为(75.09±6.92)%、(83.36±0.87)%、(78.84±3.73)%,流式分析结果见图4,应用SPSS 13.0软件,采用 Kruskal-Wallis检验,χ2=6.96,P=0.031(<0.05),3种来源巨噬细胞对马尔尼菲青霉分生孢子吞噬率有统计学差异。
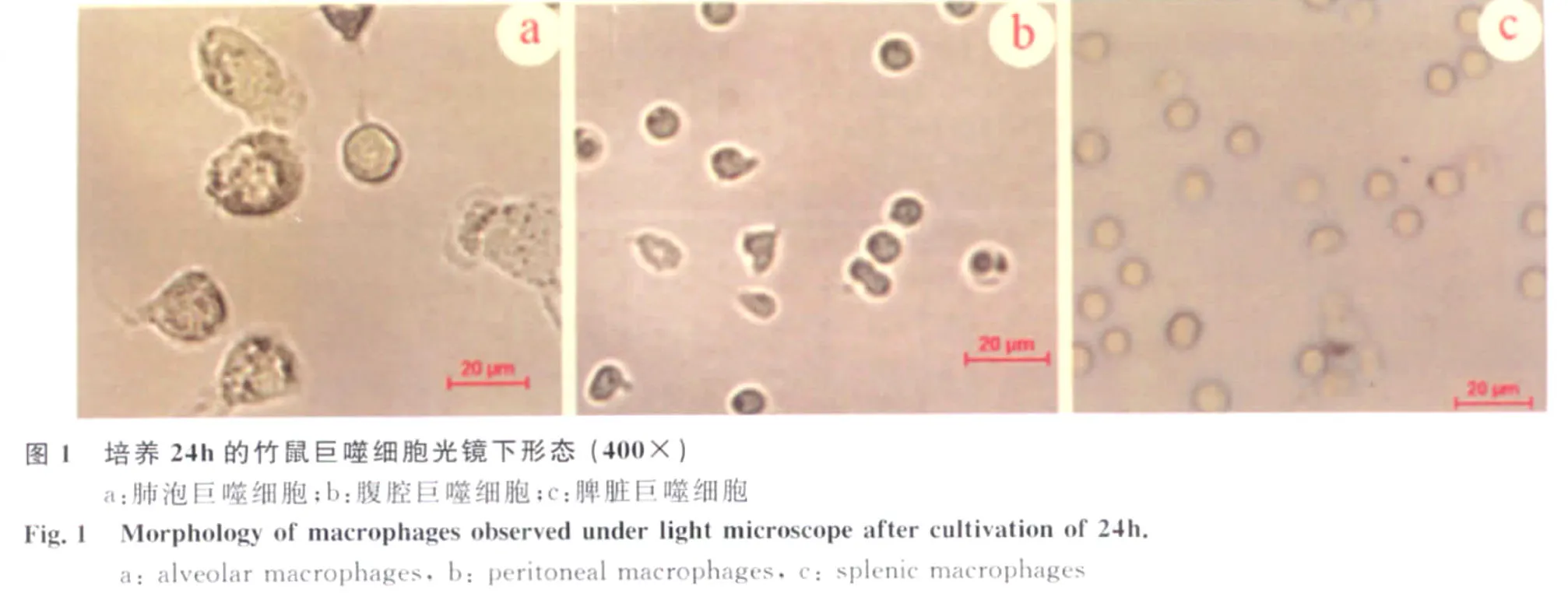
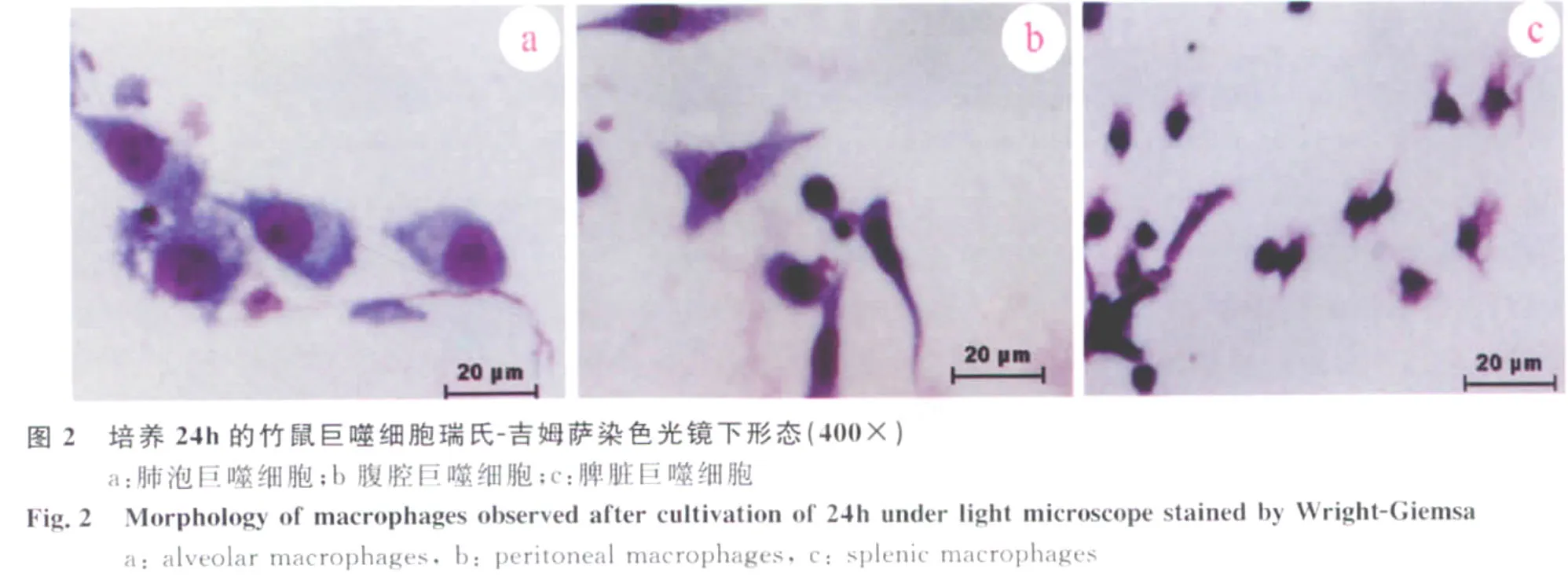
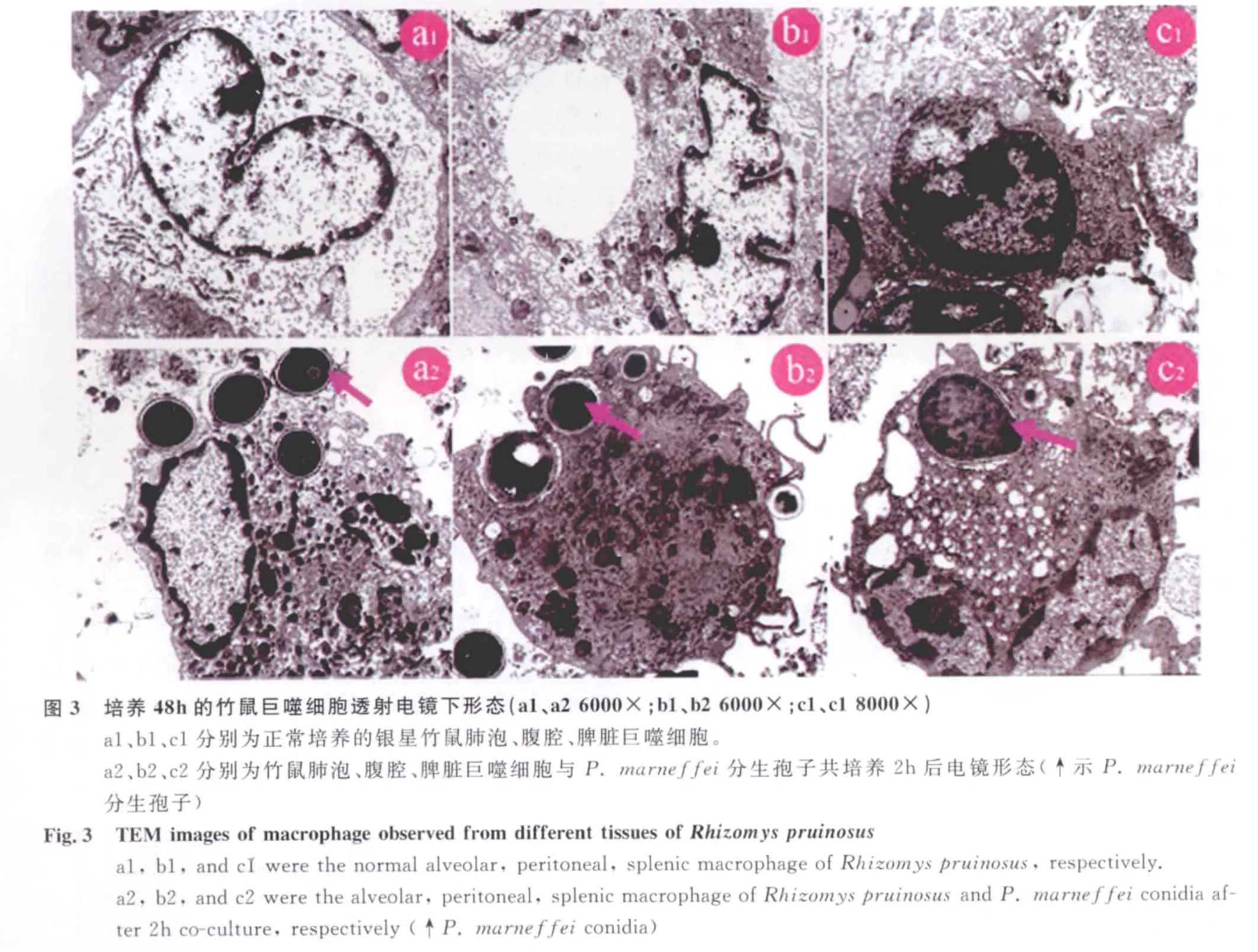

3 讨 论
马尔尼菲青霉病常见于艾滋病患者等免疫力低下人群,患者感染此病现多认为是由肺吸入马尔尼菲青霉分生孢子所致。竹鼠作为一类野生动物,多见于东南亚及我国广东、广西等地,与马尔尼菲青霉病流行分布区域一致。据文献报道,大多数野生竹鼠体内能分离出马尔尼菲青霉且证实与感染人的菌群一致,人常见感染部位也与竹鼠体内分离部位大致一致,迄今为止尚未见有其他潜在动物分离出该菌的报道[3,5-6]。由于大多数竹鼠感染该菌后并无明显临床症状,且组织病理改变甚微,因此,竹鼠可能是马尔尼菲青霉一个很重要的贮存库,其本身并不致病[3]。但是竹鼠在马尔尼菲青霉的传播过程中的具体地位尚不明确。目前关于竹鼠与人马尔尼菲青霉病相关性的研究多集中在野生竹鼠不同组织部位分离获得马尔尼菲青霉及竹鼠与马尔尼菲青霉流行病学调查等方面。本研究选择银星竹鼠作为实验动物,从能分离出马尔尼菲青霉的常见感染部位(肺泡、腹腔和脾脏)分离获得原代巨噬细胞,从巨噬细胞对马尔尼菲青霉分生孢子吞噬作用出发,为进一步探讨竹鼠与马尔尼菲青霉及马尔尼菲青霉病的相互关系奠定初步基础。
由于竹鼠本身的生物学特性,原代巨噬细胞的分离获得往往存在众多不稳定因素,尤其是各种原因所致的肺出血、肺水肿等对所获得肺泡巨噬细胞的数量及活性影响较大,而在脾脏巨噬细胞分离的过程中,贴壁纯化的时间对获得较纯的巨噬细胞至关重要。在这3种分离方法中,腹腔巨噬细胞的分离较肺泡、脾脏巨噬细胞操作简单、稳定性好、获得细胞数量较多。透射电镜下观察3种来源的巨噬细胞对马尔尼菲青霉分生孢子均具有吞噬作用,并采用流式细胞技术检测三者均具有较高的吞噬率,统计学分析三者间吞噬率具有统计学差异,其中腹腔来源巨噬细胞对马尔尼菲青霉分生孢子的吞噬率最高。电镜下未发现吞噬后的马尔尼菲青霉分生孢子形态结构的改变,也未发现巨噬细胞在吞噬真菌孢子后重要细胞器数量及结构的变化。竹鼠感染马尔尼菲青霉后临床症状不典型及组织病理变化轻微,可能与巨噬细胞对马尔尼菲青霉免疫反应微弱或缺乏有关。因此竹鼠巨噬细胞在抗马尔尼菲青霉感染过程中是否具有免疫杀伤作用甚至可能是一种保护作用尚需进一步研究。
综上所述,本研究成功分离获得银星竹鼠肺泡、腹腔和脾脏来源巨噬细胞,这将为竹鼠生物学功能、细胞生理学的研究、病理模型的建立奠定基础。来源于银星竹鼠常见能分离出马尔尼菲青霉的组织部位的巨噬细胞虽具有较强的吞噬马尔尼菲青霉分生孢子能力,但电镜下未见巨噬细胞细胞器及被吞噬的马尔尼菲青霉分生孢子形态结构明显改变,因此竹鼠巨噬细胞对马尔尼菲青霉分生孢子是否具有免疫杀伤作用尚待更进一步研究。
[1]Vanittanakom N,Cooper CR,Fisher MC,et al.Penicillium marneffei infection and recent advances in the epidemiology and molecular biology aspectsɡ[J].Clin Microbiol Rev,2006,19(1):95-110.
[2]Liyan X,Changming L,Xianyi Z,et al.Fifteen cases of penicilliosis in Guangdong,China[J].Mycopathologia,2004,158(2):151-155.
[3]吴易,李菊裳,梁伶.广西银星竹鼠与人马尔尼菲青霉病关系的研究[J].中国皮肤性病学杂志,2004,18(4):196-198.
[4]宋兴超,杨福和,邢秀梅,等.我国竹鼠资源种类、价值及人工驯养前景[J].特种经济动植物,2009(2):8-10.
[5]Cao C,Liang L,Wang W,et al.Common reservoirs for Penicillium marneffei infection in humans and rodents.China[J].Emerg Infect Dis,2011,17(2):209-214.
[6]Li X,Yang Y,Zhang X,et al.Isolation of Penicillium marneffei From Soil and Wild Rodents in Guangdong.SE China[J].Mycopathologia,2011,172(6):447-451.
[7]朱宏,催进,刘明,等.竹鼠马尔尼菲青霉菌感染的病理学研究[J].哈尔滨医科大学学报,2000,34(6):404-405.
[8]Zhang X,Goncalves R.The Isolation and Characterization of Murine Macrophages[J].Curr Protoc Immunol,2008,14(14):1.
[9]邹丹,全宏勋.小鼠肺泡巨噬细胞的提取、纯化及活性检测[J].中国公共卫生,2003,19(9):1087-1088.
[10]张华,曲震寰,王莹,等.小鼠腹腔巨噬细胞的分离培养与吞噬功能测定[J].黑龙江医药科学,2007,30(5):9-10.
[11]闫峰,李宗芳,张澍,等.人脾脏巨噬细胞的分离与纯化[J].西安交通大学学报,2004,5(25):513-516.
[12]Timo LM,ten Hagen,Vianen WV ,et al.Isolation and characterization of murine Kupffer cells and splenic Macrophages[J].Journal of Immunological Methods,1996,193(1):81-91.
[13]Feng P,Xie Z,Sun J,et al.Molecular cloning,characterization and expression of PmRsr1,a Ras-related gene from yeast form of Penicillium marneffei[J].Mol Biol Rep,2010,37(7):3533-3540.

