结核分枝杆菌利福平依赖性的初步研究
金海霞 付雷 王彬 郑梅琴 陆宇
20世纪60年代,国外文献报道了链霉素依赖的Mtb菌株,即菌株在含链霉素的培养基上生长较在不含药培养基上旺盛[1-2]。之后,又发现了“依赖RFP的 Mtb菌株”[3-4]。目前,除 RFP依赖 Mtb菌株外,还报道了 Mtb的INH、S、EMB依赖现象[5-8]。RFP自1971年发明以来,一直是治疗结核病的首选药物。资料显示,Mtb对RFP的依赖率最高。现阶段,无论在临床还是在实验室研究层面,Mtb药物依赖现象都还没有引起足够的重视。国内关于Mtb药物依赖现象的研究,大多数还仅停留于菌株的体外筛选,以及对该现象的简单描述。国外自20世纪50年代报道了链霉素的依赖现象后,尚未见新的报道。一些研究者利用豚鼠模型在体内观察RFP依赖菌株的依赖现象,但未观察到依赖菌株与非依赖菌株的差异[9]。有学者认为,依赖是在耐药基础上产生的,是量变到质变的过程,可能是耐药菌耐药基因进一步变异的结果[10]。目前研究表明,大多数RFP耐药是由于其靶分子RNA聚合酶β亚基(RpoB)的编码基因(rpoB)发生突变,阻止 mRNA合成所致[11-12]。目前,国内外已报道有 70 多个rpoB 基因突变位点[11-14],95%以上集 中 在 一个被称为RFP耐药决定区的高度保守区内(507~533位),其中又以531、526和516位3个位点的突变最常见,约占所有耐 RFP Mtb基因突变位点的86%[11-12]。本研究以RFP依赖现象为例,拟从体内外同时验证RFP依赖菌株的依赖现象。并通过rpoB基因突变位点分析,比较RFP依赖与耐药菌株的差异,从而探讨依赖菌株的产生原因,为RFP依赖结核病的诊断和防治提供依据。
材料和方法
一、材料
1.菌株:Mtb H37Rv(ATCC27294)为本室保存,46例临床分离菌株均来自国家结核病参比实验室,并在本室保存。
2.实验动物:6~8周龄雄性 SPF(specific pathogen free)级BALB/c小鼠,体质量为16~18 g,购自首都医科大学实验动物中心。经本所动物伦理委员会批准,开展动物实验。
3.试剂和培养基:7H9培养基(美国Difico公司)4.7 g溶于900 ml蒸馏水中,加入2.0 ml甘油,121℃高压10 min,待使用前加入0.1体积分数的营养添加剂白蛋白-葡萄糖-过氧化氢酶(ADC);7H11培养基(美国Difco公司)21 g,溶于900 ml蒸馏水中,加入5 ml甘油,121℃高压10 min,加入100 ml OADC(oleate-albumin-dextrose-catalase),冷却至50~55℃后分装。含RFP(终浓度为1μg/ml和10μg/ml)的7H11培养基:称取7H11培养基21 g,溶于850 ml蒸馏水中,加入5 ml甘油,121℃高压10 min,加入100 ml OADC,同时加入50 ml 20μg/ml或200μg/ml的无菌 RFP溶液,冷却至50~55℃后分装。RFP,Rfb均购自Sigma公司。
二、方法
1.菌株的耐药情况:46例菌株在改良罗氏培养基上通过绝对浓度法测定其对INH、RFP、EMB、S、Km、卷曲霉素(capreomycin,Cm)、Ofx、左氧氟沙星(levofloxacin,Lfx)(以上药品均购自Sigma公司)的耐药情况。具体操作过程参见《结核病诊断实验室检验规程》[15]。耐多药结核病(multidrug resistant tuberculosis,MDR-TB)为结核病患者感染的Mtb在体外被证实至少同时对INH和RFP耐药;广泛耐药结核病(extensively drug-resistant tuberculosis,XDR-TB)为结核病患者感染的Mtb在体外被证实除对INH和RFP耐药外,还对任意一种氟喹诺酮类药物及对三种二线抗结核药物注射剂(Km和 Am、Cm)中的至少一种耐药[16]。
2.依赖菌株的筛选:46例菌株以1×104CFU/平皿的菌量分别接种于含0、1和10μg/ml RFP的7H11培养基上,37℃培养,3周后观察菌株在含药培养基上的生长是否较不含药培养基旺盛。根据《结核病诊断实验室检验规程》,菌落生长占接种面积的1/4、1/2、3/4或布满接种面积时,分别记为+、++、+++、++++。菌株在含1μg/ml RFP的培养基上的生长多于在不含药培养基和含10μg/ml RFP的培养基上的生长,且多出+以上时,判断为低浓度依赖;菌株在含10μg/ml RFP的培养基上的生长多于在不含药培养基和含1μg/ml RFP的培养基上的生长,且多出+以上时,判断为高浓度依赖;若菌株在含1μg/ml和10μg/ml RFP的培养基上的生长类似,但多于在不含药培养基上的生长,且多出+以上时,亦判断为高浓度依赖;其余情况,判断为非依赖。
3.小鼠体内实验:选取在体外具有典型的RFP依赖现象的05116菌株,在7 H9液体培养基(含0.05%吐温80)中生长至对数生长期后,用PBS(含0.05%吐温80)制成5×107CFU/ml的菌液。取10 ml置于雾化器中,用气溶胶感染暴露装置感染小鼠。同时取0.1 ml的感染菌液用PBS进行10倍系列稀释后,取0.1 ml接种于7 H11培养基上进行活菌计数。感染2周后开始灌胃给药,每周给药5次,每只小鼠给予0.2 ml。每周记录体质量,并根据体质量调整给药剂量。小鼠按照给药的种类和给药单位剂量分成对照组0.5%羧甲基纤维素钠(carboxymethyl cellulose sodium,CMC)、10 mg/kg Rfb(Rfb10)组、10 mg/kg RFP(RFP10)组、20 mg/kg RFP(RFP20)组,每组各10只。在感染后第2天、治疗开始时分别解剖3只小鼠,取肺进行活菌计数,作为基线值。在给药后4周、给药后8周,每组各解剖5只小鼠,对肺进行摄影、活菌计数,同时分别接种于不含RFP、含1、10μg/ml RFP的7 H11培养基上,观察菌株的生长情况。
4.检测rpoB基因突变位点:选取利福平依赖与非依赖菌株中MDR及XDR菌株共19株,应用煮沸法提取基因组DNA。挑取少量菌落置于EP(eppendorf)管中,加入100μl TE缓冲液,混匀,煮沸15 min,立即置于冰上5 min,12 000转/min(离心半径8 cm)离心3 min,取上清液,-20℃冰箱保存备用。PCR扩增:上游引物序列5′-TCAGACCACGATGACCGTTCC-3′,下 游 引 物 序 列 5′-GTCCATGTAGTCCACCTCAGACG-3′。PCR 反应采用50μl反应体系:10×PCR缓冲液5μl,MgCl23 μl,d NTPs(10 mmol/L)1 μl,引 物(10μmol/L)各1μl,DNA模板2μl,TaqDNA 多聚酶(5 U/L)1μl,用高压灭菌后的双蒸水补至50μl。94℃预变性5 min,94℃变性15 s,62℃退火30 s,72℃延伸1 min,共30个循环,最后72℃延伸10 min。PCR反应后,取5μl产物进行2%琼脂糖凝胶电泳,在紫外线下鉴定有无扩增产物。扩增产物片段长688 bp,送华大基因测序以检测突变位点。
结 果
1.体外筛选RFP依赖的Mtb菌株:本研究从46例RFP耐药的Mtb临床分离株中筛选到18例RFP耐药伴依赖的菌株(39.1%)和28例RFP耐药非依赖的菌株(60.9%)(表1)。18例RFP耐药依赖的菌株中,2例为低浓度依赖菌株,16例高浓度依赖菌株。药敏结果显示,46例菌株具有不同的耐药组合(表1),MDR、XDR分别占14.3%,67.9%;而RFP耐药伴依赖株中,MDR、XDR分别占38.89%,55.56%。

图1 057、05116菌株在体外具有典型的RFP依赖现象:菌株在含10μg/ml RFP的培养基上的生长比在不含药培养基和含1μg/ml RFP的培养基上的生长至少多出+。1:不含RFP培养基;2:含1μg/ml RFP培养基;3:含10μg/ml RFP培养基
2.体内验证RFP依赖现象:057、05116菌株在体外具有典型的RFP依赖现象(图1)。菌株与含10μg/ml RFP的培养基上的生长比在不含药培养基和含1μg/ml RFP的培养基上的生长至少多出+。体外药敏实验表明05116菌株为INH低度耐药,RFP高度耐药,对其他所有受试药物均敏感。体外依赖实验表明05116菌株为RFP高浓度依赖。选取05116菌株在小鼠体内验证其RFP依赖现象。给药期间,各组小鼠体质量差异不大(图2)。给药后4周、给药后8周,各组小鼠全肺发生肉芽肿样病理改变(图3,4),但从病理改变和给药后4周的活菌计数结果中未观察到明显的药物依赖现象(表2)。继续给药至8周,各组小鼠的活菌计数结果(lgCFU 为6.20~6.60)接近于最初感染的菌量(lgCFU为5.93),并且各组小鼠的活菌计数结果从高到低依次为:RFP20组、RFP10组、Rfb10组、对照组,说明,RFP及Rfb对小鼠持续给药达8周时,药物对体外RFP依赖的菌株具有一定的促生长作用,并具有浓度依赖性,但差异无统计学意义(与对照组相比,各组P值均大于0.05)。同时,在给药后8周,各组小鼠全肺匀浆液在含1μg/ml和10μg/ml RFP的7H11培养基上的培养结果也显示,菌株仍保持明显的RFP依赖现象(图5)。

表1 RFP耐药株中依赖菌株和非依赖菌株数(株)
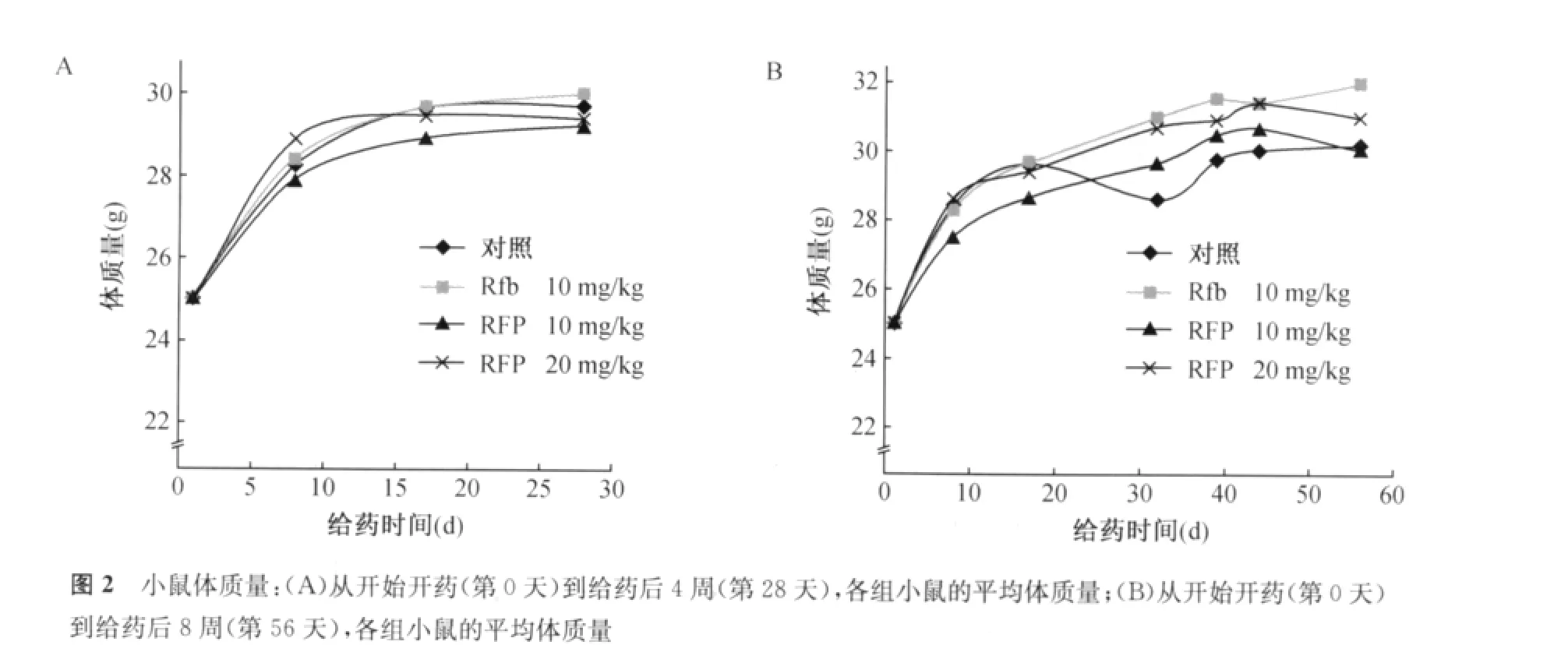
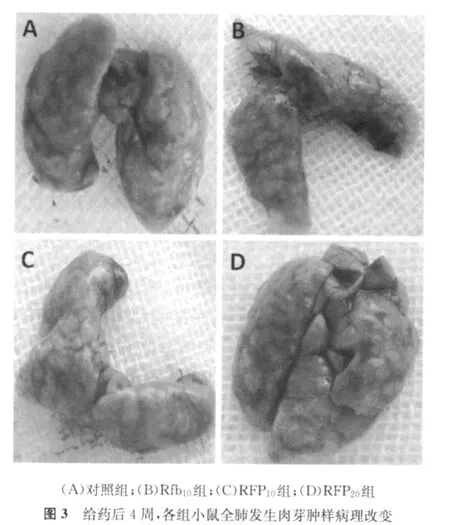
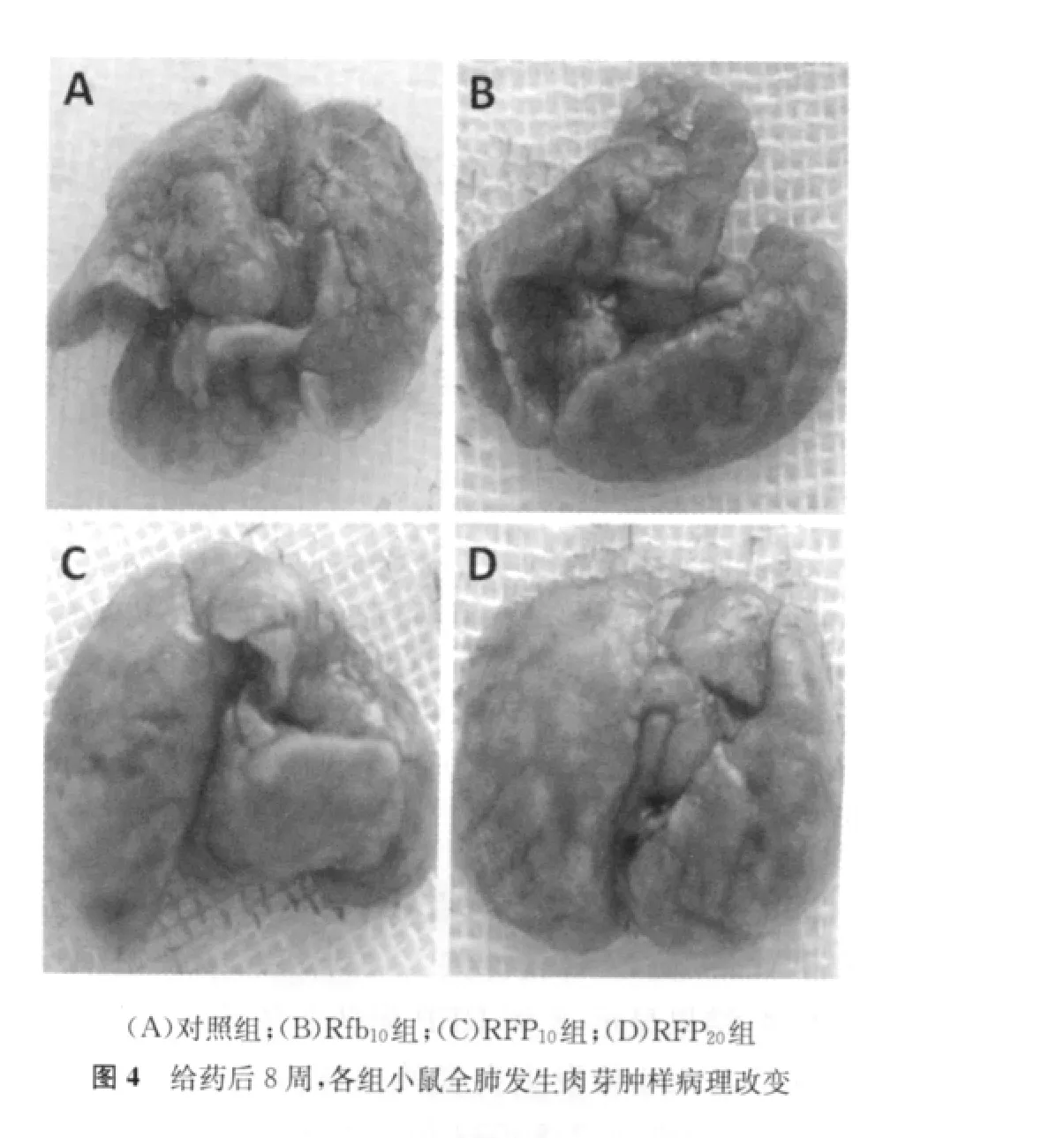
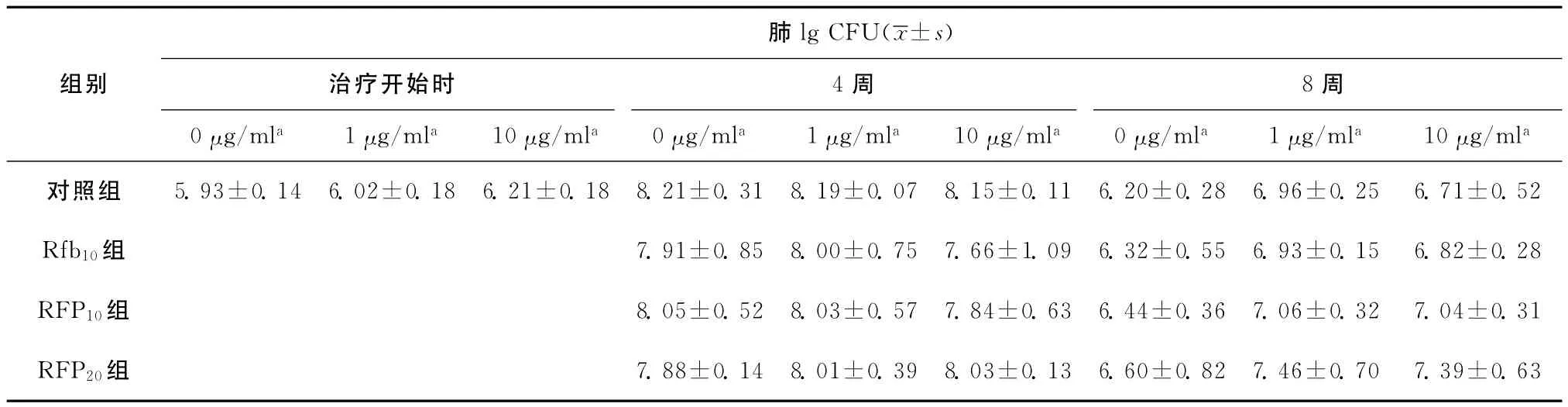
表2 给药后各组小鼠肺CFU计数

A列:0μg/mlRFP7H11培养基;B列:1μg/ml7H11培养基;C列:10μg/mlRFP 7H11;在给药后8周,各组小鼠全肺匀浆液在含1μg/ml和10μg/ml RFP的7H11培养基上菌株仍保持明显的RFP依赖现象,对照组菌落较少,而其他组则菌落生长相对旺盛图5 给药后8周,对照组、Rfb10组、RFP10组、RFP20组小鼠肺部活菌在含0μg/ml、1μg/ml和10μg/ml RFP的7H11培养基上的生长情况
3.rpoB基因突变位点:RFP依赖与非依赖菌株中MDR及XDR菌株共19株,对其rpoB基因进行测序,结果显示,8例RFP耐药非依赖的菌株中,rpoB基因526位发生突变的菌株占3/8,531位发生突变的菌株占2/8,533位、522位发生突变以及561位和672位同时发生突变的菌株各占1/8;11例RFP耐药伴依赖的菌株中,rpoB基因526位发生突变的菌株占4/11,531位发生突变的菌株占6/11,511位和518位同时发生突变的菌株占1/11。
讨 论
目前国际尚没有药物依赖菌的判断标准。Mtb依赖菌100%为耐药菌。现有资料显示,在我国耐药结核患者中,RFP依赖菌的检出率为14.13%~17.7%,链霉素依赖菌的检出率为7.8%~11.41%,异烟肼依赖菌的检出率为1.0%~6.52%[4,7]。这说明,在耐药结核患者中,药物依赖菌患者占了很大的比例。本研究中,RFP依赖菌的检出率为39.1%,高于文献报道的值,其原因一方面与样本量有关,另一方面可能与本单位为三级甲等结核病专科医院,接收的多为病情重、耐多药、治疗效果差的重症患者有关。
如图1所示,临床分离菌株在体外具有典型的RFP依赖现象。在本研究中,笔者在小鼠气溶胶感染模型中也观察到给药8周时体外RFP依赖菌株05116对RFP及Rfb的依赖现象:给予RFP及利福类药物治疗依赖性菌株感染的小鼠时,小鼠的肺活菌计数不仅没有降低,反而呈现浓度依赖性增加。同时,将体内传代后的05116菌株重新接种于含不同RFP浓度的7 H11培养基上,菌株仍表现出明显的RFP依赖现象。这些结果间接说明,患者感染药物依赖性Mtb后,继续使用该药不但治疗无效,而且在一定条件下可能促进病原菌生长繁殖,使病情加重。Mtb耐药造成临床用药无效,Mtb药物依赖无疑将导致临床有害用药。这一现象也得到了多位临床医生的观察证实:部分结核患者在用药后,病情恶化;停止用药,病情反而有所缓解。同时,已经有文献报道表明结核患者中存在明显的RFP依赖现象[17],该患者停用RFP而其他治疗药物不变后,病情明显好转并治愈。RFP依赖菌株05116在小鼠体内也表现出对Rfb的依赖性,这也间接证明Rfb和RFP存在交叉耐药,从而提醒临床医生为RFP耐药的患者选择利福类药物时需慎重考虑。从小鼠给药4周、8周的肺部病理改变中未观察到明显的药物依赖现象,笔者推测其原因之一可能是本研究在气溶胶感染小鼠的过程中,感染菌量偏大,从而无法通过肉眼观察分辨出RFP或Rfb的促生长作用(图3,4)。
有人认为,依赖是在耐药基础上产生的,是量变到质变的过程,可能是耐药菌耐药基因进一步变异的结果[10]。本研究结果表明,RFP依赖株和耐药株在rpoB基因突变位点上略有不同,但因检测的样本量有限,仅检测了19例,不足以说明两者之间是否差异有统计学意义,因此,需要进一步扩大样本量,以鉴定RFP依赖株和耐药株的差异。其他研究也表明,结核分枝杆菌RFP依赖株和耐药株的rpoB基因突变位点基本相同,DNA指纹类型及分布亦无明显特殊性,表明前者的变异主要为表型变异[18]。因此,依赖现象的独特表现可能源于基因表达差异。
综上所述,RFP依赖菌在临床RFP耐药株中的检出率高,并在小鼠体内初步观察到体外RFP依赖菌株的RFP依赖现象。但由于本研究主要以肉眼观察指标来判断药物依赖,没有量化指标,所以研究结果也存在一定的局限性。同时,通过对利福平依赖与非依赖菌株中MDR及XDR菌株进行测序分析,检测突变位点,发现RFP耐药株和依赖株的rpoB基因突变位点基本相同,因此RFP依赖的原因是表型变异还是其他因素尚有待进一步的实验证实。
[1]Coletsos PJ.Streptomycin dependence of Mycobacterium tuberculosis.Rev Tuberc,1951,15(6):548-555.
[2]Dufourt A,Brun J,Viallier J,et al.Streptomycin dependence and tertiary tuberculosis aggravated by streptomycin.Rev Tuberc,1951,15(1/2):1-6.
[3]Nakamura M,Harano Y,Koga T.Isolation of a strain of M.tuberculosis which is considered to be rifampicin-dependent,from a patient with long-lasted smear positive and culture difficult(SPCD)mycobacteria.Kekkaku,1990,65(9):569-574.
[4]钟敏,娄乐山,温博海,等.分支杆菌依赖利福平的实验观察.中华结核和呼吸杂志,2000,23(2):104-105.
[5]董梅,孟祥红,匡铁吉,等.结核分枝杆菌异烟肼依赖性的初步调查.解放军医学杂志,2007,32(4):335-336.
[6]罗春明,蔡杏珊,刘志辉.药物依赖性肺结核30例临床分析.广东医学,2009,30(1):110-111.
[7]孟祥红,匡铁吉,董梅,等.结核分支杆菌对抗痨药物依赖性的初步观察.实用医学杂志,2006,22(3):345-346.
[8]孟祥红,匡铁吉.结核分枝杆菌药物依赖性的研究进展.中国误诊学杂志,2008,8(12):3972-3973.
[9]黎友伦,罗永艾,钟敏,等.依赖利福平结核分枝杆菌的动物实验研究.中华结核和呼吸杂志,2006,29(9):617-621.
[10]McCammon MT,Gillette JS,Thomas DP,et al.Detection of rpoB mutations associated with rifampin resistance in Mycobacterium tuberculosis using denaturing gradient gel electrophoresis.Antimicrob Agents Chemother,2005,49(6):2200-2209.
[11]Ramaswamy S,Musser JM.Molecular genetic basis of antimicrobial agent resistance in Mycobacterium tuberculosis:1988 update.Tuber Lung Dis,79(1):3-29.
[12]Zhang Y,Telenti A.Genetics of drug resistance in Mycobacterium tuberculosis:Molecular genetics of mycobacteria.Washington DC:ASM Press,2000:235-254.
[13]Herrera L,Jimenez S,Valcerde A,et al.Molecular analysis of rifampicin-resistant Mycobacterium tuberculosis isolated in Spain(1996—2001).Description of new mutations in the rpoB gene and review of the literature.Int J Antimicrob Agents,2003,21(5):403-408.
[14]Van Der Zanden AG,Te Koppele-Vije EM,Vijaya Bhanu N,et al.Use of DNA extracts from Ziehl-Neelsen-stained slides for molecular detection of rifampin resistance and spoligotyping of Mycobacterium tuberculosis.J Clin Microbiol,2003,41(3):1101-1108.
[15]中国防痨协会基础专业委员会.结核病诊断实验室检验规程.北京:中国教育文化出版社,2006.
[16]中国防痨协会.耐药结核病的化学治疗指南(2009).中国防痨杂志,2010,32(4):181-198.
[17]Zhong M,Zhang X,Wang Y,et al.An interesting case of rifampicin-dependent/-enhanced multidrug-resistant tuberculosis.Int J Tuberc Lung Dis,2010,14(1):40-44.
[18]钟敏,温博海,陈荣,等.依赖利福平结核分枝杆菌的分子生物学研究.中华检验医学杂志,2003,26(l):42-45.

