外源性肺表面活性物质治疗新生儿急性肺损伤25例*
尹同进,杨代秀,叶巍岭,董莉莉
(东南大学医学院附属盐城医院新生儿科,224001)
肺表面活性物质(pulmonary surfactant,PS)治疗新生儿呼吸窘迫综合征(neonatal respiratory distress syndrome,NRDS)已经取得明确的临床疗效,包括早产儿及足月儿的 NRDS。目前 PS已经不完全用于NRDS,其在胎粪吸入综合征、重症肺炎、休克、重症感染等所致新生儿急性肺损伤/急性呼吸窘迫综合征(acute lung injure/acute respiratory distress syndrome,ALI/ARDS)的治疗方面也有着一定的疗效,并有着广泛的应用前景[1]。尽管PS在治疗成人ARDS的确切效果仍存在一定的争议[2],但作为一种潜在的治疗手段,其在新生儿及儿童的ALI/ARDS治疗中所取得的疗效仍值得期待[3]。ALI在新生儿中并不少见,因此有必要对PS治疗ALI作深入的研究。2006年1月~2008年6月,笔者观察了PS对新生儿ALI的疗效,报道如下。
1 资料与方法
1.1 临床资料 东南大学医学院附属盐城医院新生儿科诊断新生儿ALI的患儿25例,其中男17例,女8例,平均胎龄(38.5±2.5)周,出生体质量(3350 ±680)g,原发疾病分别为:胎粪吸入综合征8例,羊水吸入性肺炎7例,重症肺炎3例(肺内源性急性ALI);重度窒息3例,败血症2例,失血性休克2例(肺外源性急性ALI)。新生儿ALI的临床诊断标准[4-5]:①急性起病,有严重的原发疾病;②胸部X线片有弥漫性浸润影,透光度降低;③无心功能不全的证据;④动脉氧分压/肺泡氧分压值(PaO2/FiO2)<39.90 kPa作为判断ALI的指标之一,<26.60 kPa结合临床则定义为并发ARDS;对入院时病情即进展至ARDS的患儿未纳入研究对象。
1.2 治疗方法 所有诊断新生儿ALI的患儿诊断明确后立即予以经鼻气管插管,机械通气。呼吸机为NPB840型呼吸机,采用压力控制下的同步间隙指令通气+压力支持(SIMV+PS)模式,目标呼出气潮气量6 mL·kg-1,尽量以较低的呼吸机参数维持氧分压PaO2≥7.98 kPa,二氧化碳分压(PaCO2)<5.32 kPa。上机后予以经气管内滴入PS(北京双鹤药业股份有限公司,批准文号:国药准字H20052128)100 mg·kg-1;同时积极治疗引起ARDS的原发疾病。
1.3 观察项目 所有患儿上机前、上机后(使用PS前)、使用 PS 后 2,6,24,48 h、拔管前检测血气分析,记录 PaCO2:平均气道压(average airway pressure,MAP),吸入峰压(peak inspiratory pressure,PIP),计算呼吸指数PaO2/FiO2值,上机后使用PS前的数值值为基础值,上机前及上机后根据病情随访胸部X线片,拔管后常规作气管插管末端分泌物培养,统计住院天数及机械通气时间。
1.4 统计学方法 所有数据均由SPSS11.0统计学软件完成,采用均数±标准差()表示,同一患者的不同时间点的比较采用配对资料均数的检验的t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 患儿的呼吸机参数及主要血气指标 见表1。从表1中可以看出,使用了PS后,血气指标pH值、PaO2均较前上升,FiO2下降,MAP下降,呼吸指数明显增高,氧和改善明显,6 h后PaO2及呼吸指数出现下降趋势,48 h与2 h下降差异有统计学意义(P<0.05),但仍高于基础值(P<0.05);MAP在48 h与基础值差异无统计学意义,使用了PS后呼吸机的参数明显下降,PaCO2的改变不明显。
2.2 预后及转归 所有患儿均未发生气胸、肺出血等并发症,并发呼吸机相关性肺炎2例,病情持续进展至ARDS且并发持续肺动脉高压而导致多脏器功能衰竭而死亡 2例(8.0%),平均机械通气时间(116.4±36.4)h,住院时间(12.2±5.3)d。
3 讨论
新生儿ALI是新生儿常见的危急重症,随着对其认识的加深,临床新生儿ALI并不少见。常见的引起新生儿ALI的因素包括胎粪吸入综合征、羊水吸入性肺炎、新生儿感染性肺炎、新生儿重度窒息、休克等,临床以肺部吸入性炎症与肺部感染最为常见,其次是重度窒息与严重的全身性感染。由于ARDS是ALI连续病理过程中最严重的阶段,所有ARDS均经历ALI,而ALI并不一定发展成 ARDS[6],早期发现并及时有效的治疗可以阻断其病情继续向ARDS发展,从而降低ALI死亡率。PS是一种由磷脂、中性脂肪和特异性蛋白组成的复杂混合物,主要由肺泡Ⅱ型上皮细胞合成与分泌,其主要生理机能包括降低肺泡表面张力,促进肺内液体吸收,稳定肺泡和小气道的形态结构,还具有抗氧化和蛋白酶所致的肺损伤,调节肺的局部炎性和免疫反应等重要功能[7]。并发ALI/ARDS的新生儿,尽管其病理生理特点与原发性的肺表面活性物质缺乏存在一定的差别,但病理过程都有PS的灭活或者功能的紊乱,这也是外源性PS治疗ALI/ARDS的理论基础[7-8]。
本研究显示,在上机后给予PS,能在短时间内迅速改善氧合,维持目标氧合的呼吸机参数较使用前明显降低。这种作用在6 h后出现下降趋势,在48 h的时间点上,维持目标的氧合的条件下,呼吸机的参数如FiO2较使用PS后2,6 h增高,而氧合指数则逐渐下降,这种下降与使用PS后有明显的差异,但这种下降并没有降至PS使用前的水平,血气氧分压仍在可以接受的范围内;而PaCO2在使用了PS后则没有明显变化,考虑与新生儿ALI的病变早期以氧气弥散功能障碍为主的病理有关。尽管气管内滴入PS后的氧合改善作用仅可持续48 h左右,但在氧合改善的48 h内,为引起新生儿ALI及其原发疾病的治疗赢得了氧和改善的时间,随着原发疾病的好转及ARDS链级反应的中断,内源性的PS生成逐渐增加,病情趋于好转;这也提示重复使用PS的时间点在首剂后48h前较为合适。由于PS的使用,肺顺应性明显改善,维持相同的目标氧合的条件下,呼吸机的参数明显下降,因此呼吸机相关性肺损伤、呼吸机相关性肺炎、气胸的发生率明显下降,本组25例病例中,无一例发生气胸,仅有2例进展至ARDS并发持续肺动脉高压、多脏器功能衰竭而死亡。
表1 使用PS前后不同时间点血气分析、呼吸机参数变化Tab.1 Respiratory parameters and blood gas analysis at different time points before and after PS treatment
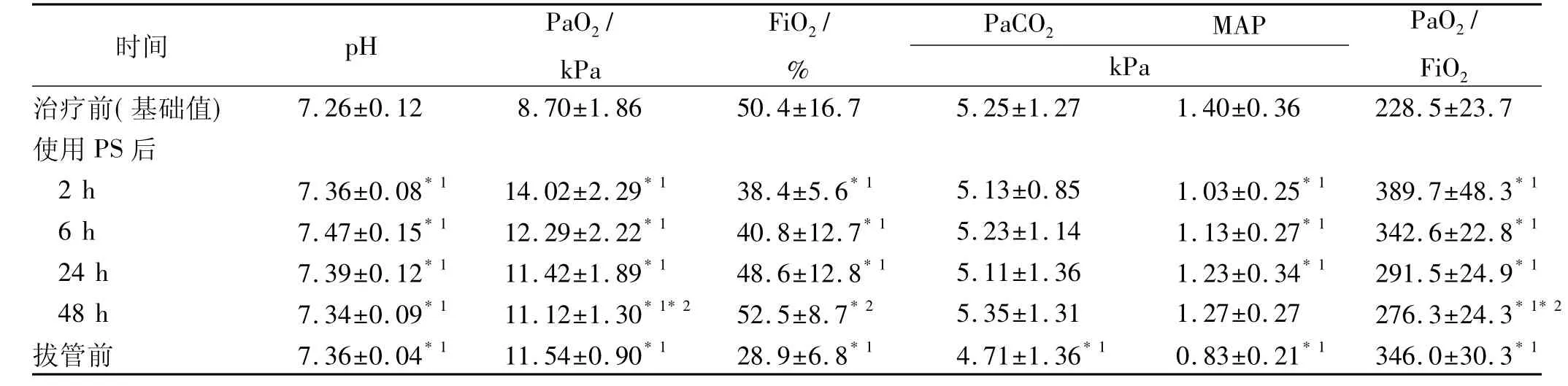
表1 使用PS前后不同时间点血气分析、呼吸机参数变化Tab.1 Respiratory parameters and blood gas analysis at different time points before and after PS treatment
与基础值比较,*1P<0.05;使用 PS后48 h与2 h比较,*2P<0.05Compared with baseline,*1P<0.05;compared with itself at 48 h or 2 h after PS,*2P<0.05
新生儿ALI的病因可以分为肺外源性与肺内源性,它们在病理生理、呼吸力学及对治疗的反应均存在不同的反应[9]。研究表明,PS气管内滴入对婴幼儿心脏转流术后ALI的氧合改善有令人满意的效果[10-12],其研究主要针对心肺转流术后所导致的ALI,以肺外源性损伤为主。本研究显示,PS对肺内肺外源性的新生儿ALI的治疗反应不一样,肺外源性的ALI无论在机械通气的时间及PS治疗后的持续效果是要明显好于肺内源性的ALI,且无重复使用PS的病例,提示对肺内、肺外源性的ALI的PS使用临床管理要差别化;由于本研究的肺外源性ALI仅有7例,样本量较小,尚需在以后的临床工作中收集病例,与肺内源性的ALI进行系统对照研究。本研究对入院时病情进展至ARDS的患儿未纳入研究对象,初衷并不是割裂ALI与ARDS的连续的病理过程,而是旨在强调对ALI的早期发现并及时干预,在临床中部分患儿在病程中病情持续加重进展至ARDS也说明了其病理过程的连续性;而对病情进展至ARDS新生儿,如何合理使用PS,尚需以后进行深入的探讨。
总之,PS对早期的新生儿ALI有着较好的治疗效果,表现为短期内迅速改善氧合,降低呼吸机的条件等作用,同时对肺起到保护作用,一定程度上可以避免病情进展至ARDS。虽然部分患儿在PS的治疗后病情反复,但为ALI的治疗赢得了时间与氧合改善的机会,其可以作为肺保护药来使用,而对病情进展至ARDS的新生儿来说,多次重复使用PS并联合其他肺复张策略值得进一步的探讨与研究.
[1]WILLIAM A E,the Committee on Fetus and Newborn.Surfactant-replacement therapy for respiratory distress in the preterm and term neonate[J].Pediatrics,2008,121(2):419-432.
[2]ROY G B,HENRY E F.Another"negative"trial of surfactant:time to bury this idea[J].Am J Res Criti Care Med,2011,183(7):966-968.
[3]ADRIENNE G R.Management of acute lung injure and respiratory distress syndrome in children[J].Crit Care Med,2009,38(8):248-2454.
[4]MICHAEL R A .Update on pediatric acute respiratory distress syndrome[J].Resp Care,2003,48(3):261-278.
[5]韩玉昆,蔡栩栩.足月新生儿急性呼吸窘迫综合征的病因及临床诊断[J].小儿急救医学,2004,11(1):62-63.
[6]李华强.新生儿急性肺损伤中几个问题的思考[J].中国新生儿科杂志,2011,26(1):5-9.
[7]STEVEN M D,JENNIFER D.Surfactant replacement therapy in the neonate:beyond respiratory distress syndrome[J].Resp Care ,2009,54(9):1203-1208.
[8]汪薇,孙波.肺表面活性物质与小儿急性肺损伤的临床研究进展[J].中国小儿急救医学,2007,14(2):96-99.
[9]徐军,吴学忠,马遂.肺内与肺外源性急性呼吸窘迫综合征[J].国际呼吸杂志,2007,27(5):329-332.
[10]邢泉生,韩俐,曹倩.联合应用肺表面活性物质和保护性机械通气策略治疗婴幼儿体外循环后急性肺损伤[J].中华实验外科杂志,2003,20(9):849-851.
[11]陈伟敏,付丽娟,何萍萍,等.肺表面活性物质在婴幼儿先天性心脏病术后撤机中的应用[J].护理学杂志,2004,19(2):68-69.
[12]洪小样,孔祥东,周更须.肺表面活性物质治疗婴幼儿心脏术后急性肺损伤研究[J].中华儿科杂志,2012,50(3):193-196.

