抗人CD25嵌合抗体的稳定表达及鉴定
胡迪超 张爱华 杨晓明 (武汉生物制品研究所有限责任公司,武汉430060)
IL-2通过与IL-2R结合而发挥其生物学功能。高亲和力的IL-2R由α(Tac,CD25)、β和γ三条异源多肽链组成。αβγ、βγ和α与IL-2的亲和力分别为10-11、10-9和 10-8mol/L,可见只有当 IL-2与CD25结合后才能使得IL-2与IL-2R达到最大的亲和力,因此CD25在介导IL-2生物学功能的过程中发挥重要作用。CD25分子是由251个氨基酸残基组成的分子质量约为55 kD的跨膜糖蛋白,从细胞膜上脱落的可溶性CD25分子约为44 kD。CD25分子高表达于许多自身免疫病、同种移植排斥反应和多种淋巴瘤的T细胞表面[1]。
以CD25分子为靶标的治疗性抗体Basiliximab和Daclizumab在肾脏移植排斥反应中发挥了重要作用。起初,Binder等[2]采用噬菌体文库筛选法表明Basiliximab和Daclizumab识别CD25分子上的表位为D2区的116~122(ERIYHFV)位残基。但Du等[3]采用结构生物学分析法表明Basiliximab识别CD25分子上几个不连续的片段,包括D1区1~6、21~29、38~48和56~57位残基以及D2区118~120残基共23个氨基酸残基。而Yang等[4]采用结构生物学分析法表明Daclizumab也识别CD25分子上几个不连续的片段,包括D1区1~6、25~27和42~43位残基以及D2区118~120和149~155位残基共21个氨基酸残基。由于它们所识别的表位与IL-2识别的表位很多都重叠,因而能够阻断IL-2的生物学功能。Basiliximab与CD25的亲和力为1×10-10mol/L,而采用Scatchad法测定Daclizumab与CD25的亲和力为1/3×10-9mol/L,其亲本抗体为1/9×10-9mol/L。鉴于此,本研究构建了具有自主知识产权的CD25嵌合抗体稳定细胞株并对表达产物进行相关鉴定。
1 材料与方法
1.1细胞株、菌株及质粒 CHO-DHFR-由本室保存;Top 10感受态细胞购自天根生化科技(北京)有限公司;含有抗人CD25嵌合抗体基因的表达质粒pOptiVEC-TacH和pcDNA3.3-TacL由本人前期构建并保存(宿主细胞为 Top 10);含有质粒pUC57-VP163的宿主菌由本室保存。
1.2主要试剂 PrimeSTARⓇHS DNA Polymerase with GC Buffer购自宝生物工程(大连)有限公司;质粒小量、中量提取试剂盒购自Qiagen公司;FastDigestⓇEcoR Ⅰ 和 FastDigestⓇXhoⅠ 购自 Fermentas公司;LigaFast Rapid DNA Ligation System购自Promega公司;IMDM培养基、透析FBS、IgG超低FBS、Opti-MEMⓇReduced Serum Media、LipofectamineTM2000和 Geneticin购自 Invitrogen公司;HT media supplement、甲氨蝶呤(MTX)和FITC标记的山羊抗人IgG(Fc specific)多抗为Sigma公司产品;Cy5标记的山羊抗小鼠IgG(H+L)多抗购自abcam公司;TRITC标记的山羊抗人Kappa链多克隆抗体购自SouthernBiotech公司;人源细胞表达的重组人IL2Rα(CD25)胞外段Met 1-Cys 213购自北京义翘神州生物技术有限公司;5层细胞工厂(3 180 cm2)为Corning公司产品;1 ml HiTrap Protein A HP预装纯化柱为GE公司产品。
1.3相关引物 VPP1:5'-CGGAATTCAGCGCAG AGGCTTGGGGCAGCCGAG-3'(EcoRⅠ);VPP2:5'-TGGTGGCGGCGGTTTCGGAGGCCGTCCGGGGC-3';V5H3:5'-CCTCCGAAACCGCCGCCACCATGGAATGTAAC-3';V5H4:CCG CTCGAGAGCTCATTTACCCGGAGACAGG G-3'(XhoⅠ);V5L3:5'-GCCTCCGA AACCGCCGCCACCATGGTGTCCTCT-3';V5L4:5'-CCG CTCGAGAGCTCAACACTCTCCCCTGTTGAAGC-3'(XhoⅠ)。
1.4细胞培养 使用含100 μg/ml氨苄青霉素的LB培养基筛选和培养含有目的基因的工程菌;使用含100 μmol/L次黄嘌呤和 16 μmol/L胸腺嘧啶(HT)的IMDM培养基(含10%FBS)常规培养CHODHFR-细胞;抗CD25嵌合抗体稳定细胞株的筛选和培养使用含500 μg/ml Geneticin的IMDM培养基(无HT)进行选择性培养。
1.5抗人CD25嵌合抗体稳定表达质粒的构建以质粒pUC57-V163为模板,用引物VPP1和VPP2扩增含有VP163序列的基因片段;并分别以pOptiVEC-TacH和 pcDNA3.3-TacL为模板,以引物V5H3和V5H4以及V5L3和V5L4扩增含有重、轻链序列的基因片段;反应条件均为98℃变性10秒,58℃(5个循环)、56℃(5个循环)、54℃(10 个循环)和52℃(10个循环)均退火5秒,每个循环72℃延伸均为90秒;凝胶纯化回收目的基因片段后分别将含有VP163的基因片段与含有重、轻链的基因片段按一定比例混合,按98℃变性10秒、68℃保温90秒循环10次;然后分别补加引物VPP1和V5H4以及VPP1和V5L4,按上述反应条件扩增VTacH和VTacL片段,但循环完毕继续72℃保温5分钟;使用EcoRⅠ和XhoⅠ双酶切质粒以及目的基因片段,纯化回收后在T4 DNA连接酶的作用下进行连接,转化Top 10后采用菌落PCR鉴定阳性克隆并进行测序鉴定。
1.6抗人CD25嵌合抗体稳定细胞株的构建 用Pvu I内切酶分别将质粒pOptiVEC-VTacH和pcDNA3.3-VTacL进行线性化;然后使用Opti-MEM分别稀释质粒DNA和Lipofectamine 2000并按一定比例制备质粒DNA:脂质体复合物,转染生长状态良好的CHO-DHFR-细胞并继续常规培养48小时后,使用含500 μg/ml Geneticin但不含HT的IMDM培养基(10%透析FBS)进行选择性培养,约14天后使用有限稀释法筛选表达水平高的克隆;分别以100、200、300、400和500 nmol/L MTX进行初次加压筛选,待细胞在该条件下恢复生长良好状态后继续增加100 nmol/L MTX直至抗体表达水平不再增高。
1.7抗人CD25嵌合抗体的表达及才纯化 将CD25嵌合抗体稳定细胞株扩大培养,以约1×105ml-1接种于5层细胞工厂,培养6~8天后更换为经优化的无血清培养基,并继续培养6~9天进行表达;收获细胞上清液,经离心、过滤和超滤浓缩后使用1 ml Protein A纯化目的抗体;然后使用BCA法(Pierce)对抗体浓度进行定量。
1.8激光共聚焦法检测CD25嵌合抗体的稳定表达 将连续传代3个月以上的CD25嵌合抗体细胞株进行细胞爬片,预冷PBS清洗3次后用80%冷丙酮-20℃固定20分钟,预冷PBS洗涤3次(5分钟/次)后分别使用TRITC标记的山羊抗人Kappa链多抗(1∶1 000)、FITC 标记的山羊抗人 IgG-Fc(1∶64)多抗和Cy5标记的山羊抗小鼠IgG(H+L)多抗(1∶5 000)进行标记,然后用预冷PBS洗涤3次并使用注射用水冲洗一次,完毕用激光共聚焦显微镜(Leica公司)进行观察。
1.9质谱法对抗人CD25嵌合抗体进行鉴定 使用还原型SDS-PAGE将CD25嵌合抗体的重、轻链分开,0.1 μg/μl胰蛋白酶消化后使用基质辅助激光解析离子化串联飞行时间质谱仪(MALDI-TOF/TOF,德国Bruker公司)分析,将获得的数据输入Mascot肽质量指纹图谱数据库进行检索分析。
1.10蛋白质N端氨基酸测序法对抗人CD25嵌合抗体进行鉴定 使用还原型SDS-PAGE将CD25嵌合抗体和亲本抗体WuTac的重、轻链分开,然后分别将目的蛋白片段进行蛋白质N端氨基酸测序(ABI公司),此过程委托上海基康生物技术有限公司完成。
1.11抗人CD25嵌合抗体平衡解离常数(Kd)的测定 取黑色96孔板,第1列全部加入200 μl PBS(0.01 mol/L,pH7.4);第2 列全部加入 200 μl抗体溶液(25 μg/ml);第3列全部加入200 μl SD 溶液(0.01 mol/L PBS,pH7.4,0.02%Tween 20,0.1%BSA);第4列第1~7孔分别加入200 μl重组CD25抗原溶液(10、5、2.5、1.25、0.625、0.313 和 0.156 μg/ml),第8孔加入200 μl SD溶液;第5列全部加入200 μl SD溶液;CD25嵌合抗体用抗人IgG-Fc传感器(AHC)进行捕获;WuTac单抗用抗鼠IgG-Fc传感器(AMC)进行捕获;然后在Octet RED系统(ForteBio)内按PBS平衡60秒、捕获抗体600秒、SD平衡180秒、结合600秒和解离1 800秒程序进行结合和解离测定;完毕使用Octet软件计算Kd值。
2 结果
2.1采用重叠延伸PCR法分别在质粒pOptiVECTac-H和pcDNA3.3-Tac-L抗体表达框内添加VP163序列,琼脂糖凝胶电泳表明成功进行了拼接,见图1;菌落PCR均鉴定出阳性克隆并进行序列测定,结果表明成功构建了稳定表达质粒VEC-VTac-H和3.3-VTac-L。
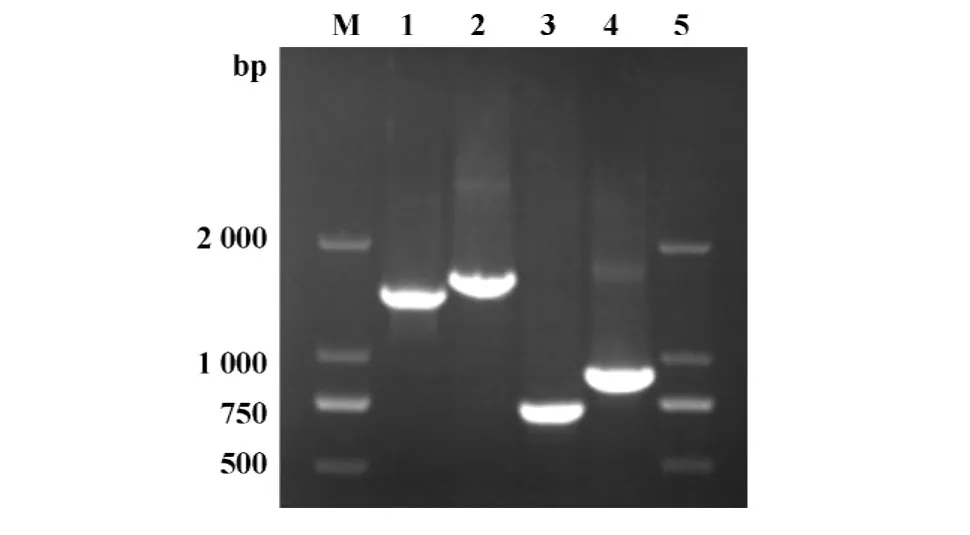
图1 重叠延伸PCR结果Fig.1 Overlap PCR products analyzed by agarose gel electrophoresis
2.2将线性化的质粒稳定转染CHO-DHFR-细胞并经历选择性培养后,采用有限稀释法筛选表达水平高的克隆,结果见图2;然后采用逐步提高MTX浓度的方法进行加压筛选,最终获得的稳定细胞株抗体表达水平约为3.74~7.07 μg/ml(3~4天),MTX浓度为600~800 nmol/L。
2.3扩大培养抗CD25嵌合抗体稳定细胞,待5层细胞工厂内达到一定细胞密度后采用优化后的无血清培养基进行表达;将1 900 ml表达上清离心、过滤、超滤浓缩后使用Prtoein A纯化目的抗体,结果见图3;BCA蛋白定量法测得抗体总量为16.08 mg,因此CD25嵌合抗体的表达水平为8.46 mg/L。
2.4激光共聚焦检测结果表明所有表达CD25嵌合抗体的细胞均能呈现红色、绿色和蓝色荧光,这表明抗CD25嵌合抗体基因在宿主细胞内稳定表达人的恒定区和鼠的可变区,结果见图4;而对照细胞(正常CHO-DFHR-)未发现有红色和绿色荧光,但出现较弱的蓝色荧光(数据未给出),这可能是由于Cy5标记的抗鼠抗体与CHO-DFHR-细胞存在一定的交叉反应。
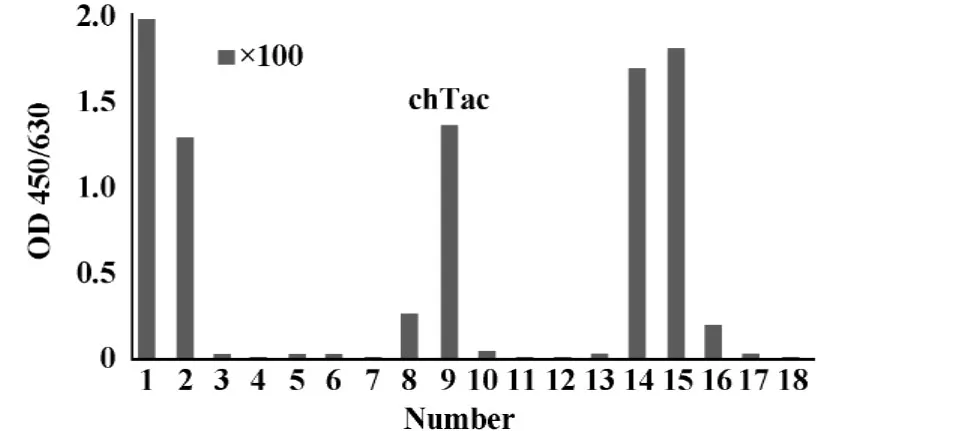
图2 克隆筛选的ELISA检测结果(×100)Fig.2 Screening for high-level expression clones identified by sandwich ELISA(×100)
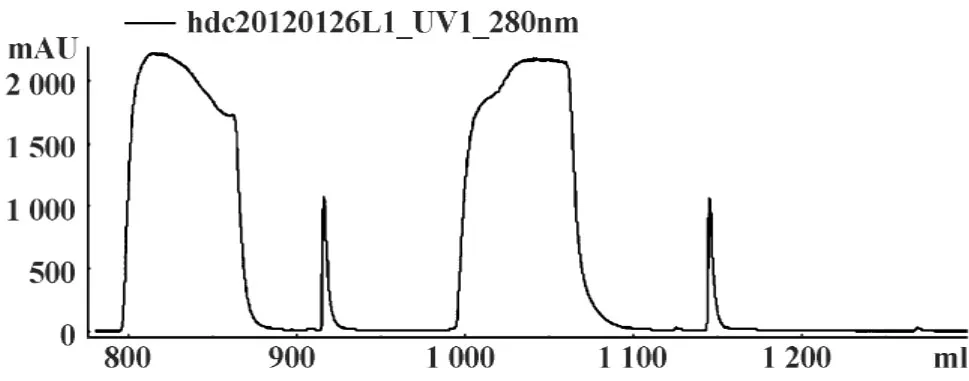
图3 抗CD25嵌合抗体亲和层析图Fig.3 Affinity chromatogram ofchimeric antibody against CD25 molecule
2.5质谱分析检索结果表明CD25嵌合抗体重链均能检索到与之匹配的鼠源和人源抗体片段,轻链也能检索到与之匹配的人源抗体片段,但只能检索到鼠源性成分,而未能检索到匹配的鼠源性抗体片段,这可能由于数据库中还未收集与其轻链鼠源性可变区相似的抗体质量指纹,质谱检索结果见表1。
2.6蛋白质N端氨基酸测序结果表明CD25嵌合抗体(chTac)的N端氨基酸序列与DNA序列推导的氨基酸序列完全一致,这也与亲本抗体WuTac的N端氨基酸序列完全一致(见表2和图5),且信号肽在预期的位点进行了剪切(SignalP 3.0,数据未给出)。
2.7以传感器分别捕获CD25嵌合抗体和WuTac,通过结合与解离不同浓度重组CD25抗原,采用Octet软件进行曲线拟合并分别计算出CD25嵌合抗体的Kon(1/Ms)和Kdis(1/s)为5.90×105和1.39×10-4,其 Kd值为2.35×10-10mol/L;而 WuTac的 Kon(1/Ms)和Kdis(1/s) 为1.30×106和2.45×10-4,其KD值为1.88×10-10mol/L。

表2 CD25嵌合抗体和WuTac单抗N端测序结果Tab.2 The N-terminal sequencing results of WuTac and chTac
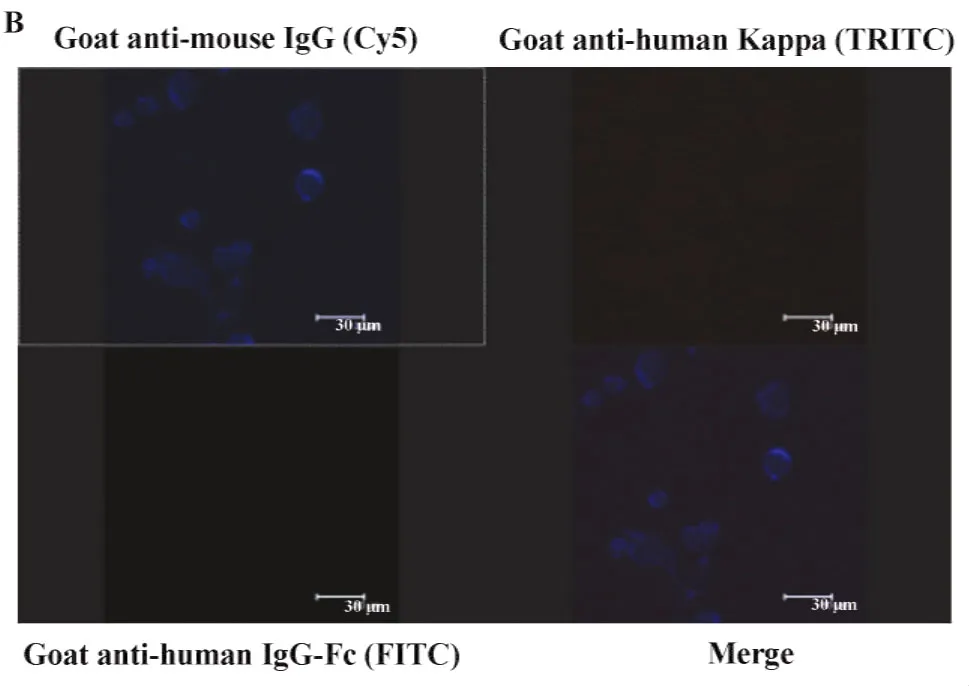
图4 激光共聚焦检测结果Fig.4 Stable expression o f chimeric antibody against CD25 molecule observed by confocal microscopy
表1 肽质量指纹检测结果Tab.1 The results of peptide mass fingerprint
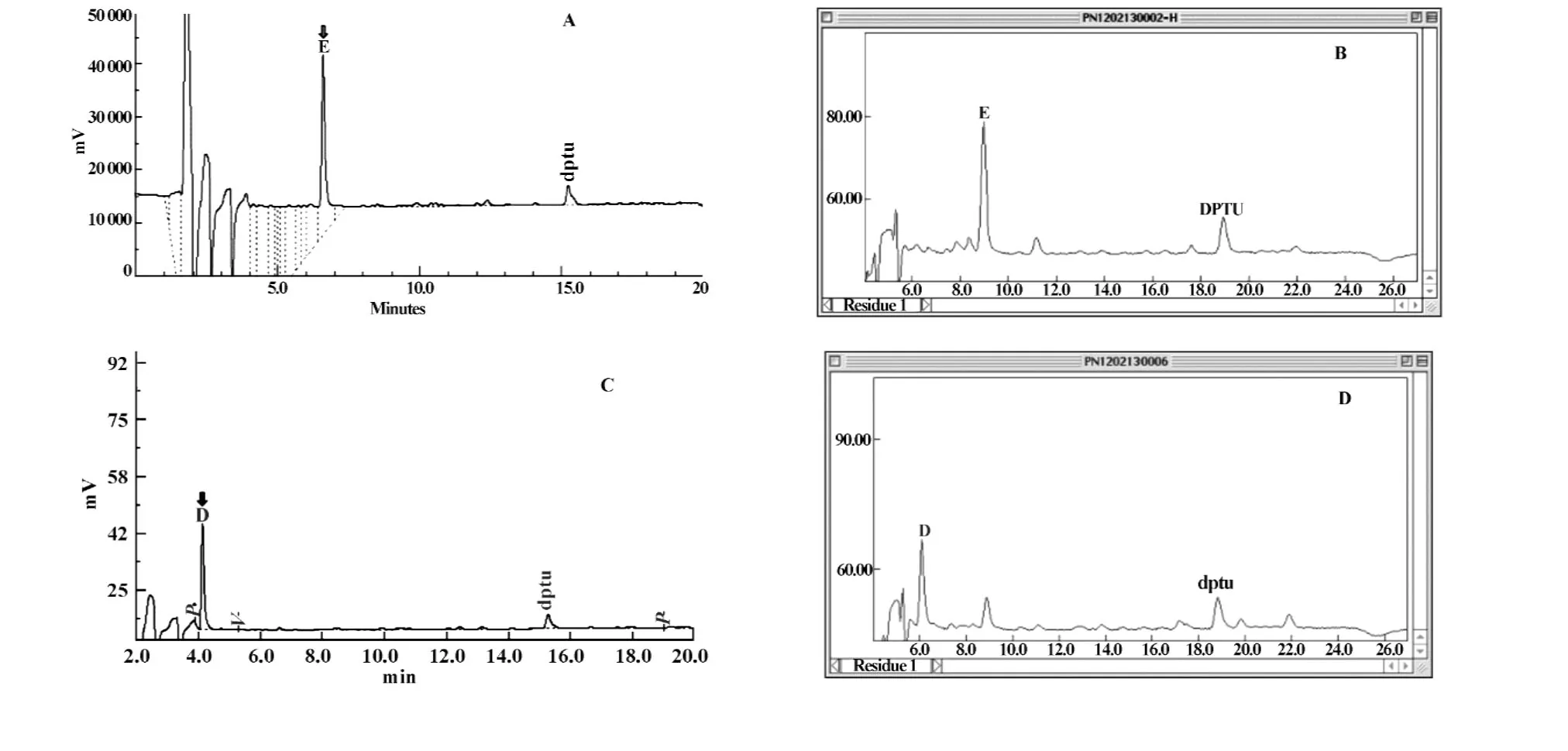
图5 蛋白质N端氨基酸测序峰图(第1个氨基酸)Fig.5 The sequencing graph of N-terminal amino acid of WuTac and CD25 chimeric antibody by Edman degradation method(The first amino acid)
3 讨论
当前抗CD25嵌合抗体Basiliximab和人源化抗体Daclizumab在器官移植排斥反应中发挥着重要作用,并具有治疗肿瘤和自身免疫病的潜力。为了研发具有自主知识产权的CD25治疗性抗体,采用重组DNA技术对本所构建的WuTac进行了人鼠嵌合改造。前期研究表明其保留了亲本抗体的抗原结合特异性[5]。为了进一步确证其保留了亲本抗体的结合特异性性和亲和力,本研究构建了CD25嵌合抗体稳定细胞株并对表达产物开展了进一步鉴定。
VP163为鼠VEGF 5'UTR的一段序列,其可能有增强目的蛋白表达的作用,因此本研究将其插入CD25嵌合抗体重、轻链的表达框内。由于使用BCA法定量抗体时使用的标准品为BSA,与IgG为不同类蛋白质,同种浓度下鼠IgG的OD值为BSA的1.18,而人IgG为其1.09,因而在计算抗体浓度时对数据进行了校正以使其更接近真实值。为了评估CD25嵌合抗体细胞株的稳定性,本研究采用了激光共聚焦法对抗体基因在细胞内的表达进行了检测,同时也采用ELISA法对抗体的分泌水平进行了连续监测以及对基因组DNA和总mRNA进行了PCR鉴定(数据未给出)。质谱分析结果表明CD25嵌合抗体含有鼠源性成分和人源性成分。为了评估CD25嵌合抗体的抗原结合特异性,本研究采用Western blot、Dot blot和流式细胞术对纯化的抗体进行了检测(数据未给出)。蛋白质N端氨基酸测序表明CD25嵌合抗体与WuTac的N端氨基酸序列完全一致,且信号肽在预期位点被成功剪切掉。由于测定KD值时本身存在一定的允许误差,因而可以认为CD25嵌合抗体与亲本抗体WuTac的亲和力无明显差异。
综上所述,所构建的嵌合抗体保留了亲本抗体的抗原结合特异性和亲和力,从而为研发具有自主知识产权的CD25治疗性抗体打下了坚实基础。
致谢:感谢湖北大学生命科学院、武大大学基础医学院及武汉病毒研究所在仪器设备上提供的帮助。
1 Morris J C,Waldmann T A.Advances in interleukin 2 receptor targeted treatment[J].Ann Rheum Dis,2000;59(Suppl1):i109-i114.
2 Binder M,Vogtle F N,Michelfelder S et al.Identification of their epitope reveals the structural basis for the mechanism of action of the immunosuppressive antibodies basiliximab and dalizumab[J].Cancer Res,2007;67(8):3518-3523.
3 Du J,Yang H,Zhang D et al.Structural basis for the blokage of IL-2 signaling by therapeutic antibody basiliximab [J].J Immunol,2010;184(3):1361-1368.
4 Yang H,Wang J,Du J et al.Structural basis of immunosuppression by the therapeutic antibody daclizumab [J].Cell Res,2010;20(12):1361-1371.
5 胡迪超,张爱华,杨晓明et al.抗人CD25嵌合抗体基因的构建及其瞬时表达研究[J].中国免疫学杂志,2011;27(7):648-653.

