体外RNAi对S100A4基因表达及其对骨肉瘤细胞侵袭、转移能力的影响
马 旭,杨毅欣,王岩峰,安贵峰,商冠宁,吕 刚
(1.沈阳市骨科医院,辽宁 沈阳 110044;2.中国医科大学 附属第一医院 骨科,辽宁 沈阳 110001;3. Department of Biological Sciences, Emporia State University, Emporia, KS 66801, USA)
骨肉瘤是临床常见的成骨性恶性肿瘤,约占所有骨肿瘤的20%,其恶性程度高,易复发和转移,预后较差。近年来的研究表明,S100A4基因和蛋白的异常表达与恶性肿瘤的生物学行为密切相关,特别在肿瘤的侵袭和转移中发挥着重要的作用。本实验设计S100A4小发夹RNAi载体,干扰骨肉瘤细胞中的S100A4基因的表达,观察干扰后骨肉瘤细胞生物学行为的变化以及对侵袭、转移能力的影响。
1 材料和方法
1.1 细胞培养
人骨肉瘤细胞系MG-63购自中科院上海细胞研究所。细胞培养条件:37℃, 5% CO2,DMEM/HIGH Glucose培养基+10%标准胎牛血清。
1.2 siRNA的设计与合成
依据Ambion公司提供的设计原则,根据S100A4基因在GenBank中的序列设计相应的siRNA。针对S100A4的siRNA载体委托闪晶生物公司构建与合成。siRNA表达载体pSIREN-DNR含新霉素抗性基因和GFP绿色荧光标记,可以实时监测载体在细胞中的转染效率。根据目的mRNA序列,设计3条RNA干扰靶序列及非特异性的siRNA(表1)。
1.3 细胞的分组及转染
转染前24 h,取对数生长期的细胞用胰酶消化并计数,用DMEM培养基调整细胞浓度为1×105/ mL,取2 mL接种于六孔板,放置于37℃,5%CO2培养箱中培养,在细胞达80%融合时用于转染。转染按照LipofectamineTM2000 Transfection Reagent(Invitrogen)提供的步骤进行。细胞分为如下几组:C组(空白对照组);C1组(转染脂质体组);C2组(转染非特异性的siRNA组);S1、S2、S3组(转染特异性的siRNAⅠ、Ⅱ、Ⅲ组)。转染24 h后,将培养板置于荧光倒置显微镜下观察细胞形态及生长状态,绿色荧光下观察转染情况。
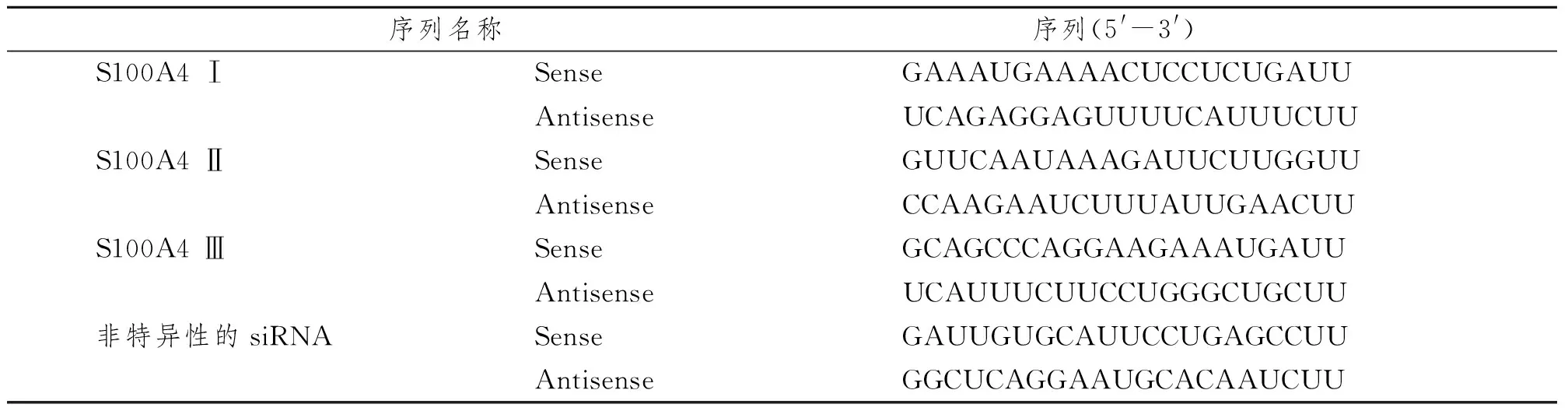
表1 siRNA转录模板序列Tab 1 SiRNA transcribed template sequences
1.4 细胞总RNA提取和Real-time PCR反应
各组细胞使用Trizol试剂提取细胞总RNA并进行逆转录反应。Real-time PCR反应引物序列,目的基因S100A4:5'-GCCCTGGATGTGATGGTG-3′(上游),5'-CGTTGTCCCTGTTGCTGT-′(下游),扩增产物184 bp;内参照β-actin:5′-AGTTGCGTTACACCCTTTCTTG-3′(上游),5′-TCACCTTCACCGTTCCAG TTT-3′(下游),扩增产物150 bp。使用SYBR®PremixExTaqTM(Perfect Real Time)(TaKaRa)进行Real-time PCR反应,反应条件:95℃,5 sec(1次);95℃,5 sec;56℃,20 sec;68℃,15 sec(循环45次)。
1.5 应用Western-Blot方法检测转染前后S100A4蛋白表达的变化
选取各组培养细胞制备蛋白质样品,用点式分光光度仪ND-1000 测定蛋白浓度。经聚丙烯酰胺凝胶电泳(SDS-PAGE)转移至聚偏二氟乙烯膜(PVDF)上,5%脱脂奶粉封闭90 min,加入兔抗人S100A4一抗(1∶1500),4℃过夜。将膜置于碱性磷酸酶标记的山羊抗兔二抗(1∶20000)中室温缓摇1 h,37℃恒温箱孵育1 h,于膜的蛋白面滴加化学发光剂(ECL)显色,同样方法检测内参照β-actin。胶片曝光,显影,定影。
1.6 MTT法测细胞增殖
实验分为正常细胞组,阴性对照组和实验组。正常细胞组为常规培养的MG-63;阴性对照组为非特异性siRNA转染后48 h;实验组为特异性siRNA转染后48 h。以每孔104个细胞接种于96孔培养板中,培养后第0、24、48、72、96 h,进行MTT反应,选择490 nm波长,在紫外分光光度计上测定各孔吸光度,绘制细胞生长曲线。
1.7 平板克隆形成实验
本实验设置正常细胞组,阴性对照组和实验组。正常细胞组为常规培养的MG-63;阴性对照组为非特异性siRNA转染后48 h;实验组为特异性siRNA转染后48 h。将细胞悬液以50个/孔的细胞密度,接种于六孔板中培养14 d;倒置相差显微镜下观察集落形成情况。判断标准:含50个细胞以上的细胞集落为一集落,计算克隆形成率(克隆形成率=克隆数/接种细胞数×100%)。
1.8 体外侵袭实验
本实验设置正常细胞组,阴性对照组和实验组。正常细胞组为常规培养的MG-63;阴性对照组为非特异性siRNA转染后48 h;实验组为特异性siRNA转染后48 h。将Transwell小室(8 μm孔径,Corning)放入培养板中,用50 mg/L Matrigel (BD)1∶8稀释液包被Transwell小室底部膜的上室面,取2×105/mL细胞200 μL加入上室,下室加入作为化学趋化物的含10%FBS的DMEM培养基500 μL,37℃、5%CO2条件下孵育20 h。取出小室,弃去上室内培养基,用棉签仔细擦净膜上室面未侵袭的细胞,下室面用甲醇固定10 min后,0.1%结晶紫染色。在倒置显微镜下随机选取6个200×视野,计数穿膜细胞数目,取均值。
1.9 统计学方法
所有数据均使用SPSS 11.0统计学软件处理,采用t检验进行统计学分析,P<0.05为差异有统计学意义。
2 结 果
2.1 荧光倒置显微镜下观察细胞形态和转染情况
倒置显微镜下可见各组细胞正常生长,荧光倒置显微镜下可见空白对照组(C组)、单纯转染脂质体组(C1组)未见荧光,转染非特异性siRNA组(C2组)、转染特异性siRNA组(S1、S2、S3组)可见绿色荧光,表达部位在细胞浆(图1)。
2.2 Real-time PCR、Western-Blot检测转染效率
用双标准曲线的方法比较各组S100A4基因的表达。C、C1、C2组S100A4基因的表达基本相似,差异无显著性意义。S1、S2、S3组抑制效率分别达40%、37%和87%, S3组的作用更明显。与C、C1、C2组比较,差异有显著性意义,P<0.05(表2)。
2.3 Western-Blot检测转染后蛋白的表达
S1、S2、S3组的S100A4蛋白表达水平明显低于C、C1、C2组,差异有显著性意义,P<0.05。S1、S2、S3组干扰作用分别为 30.1%、22.2%、84.4%(表2,图2)。
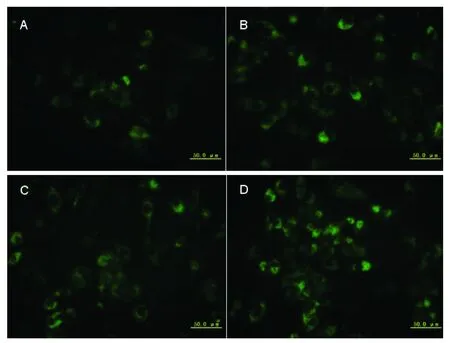
表2各组S100A4 mRNA以及蛋白表达水平

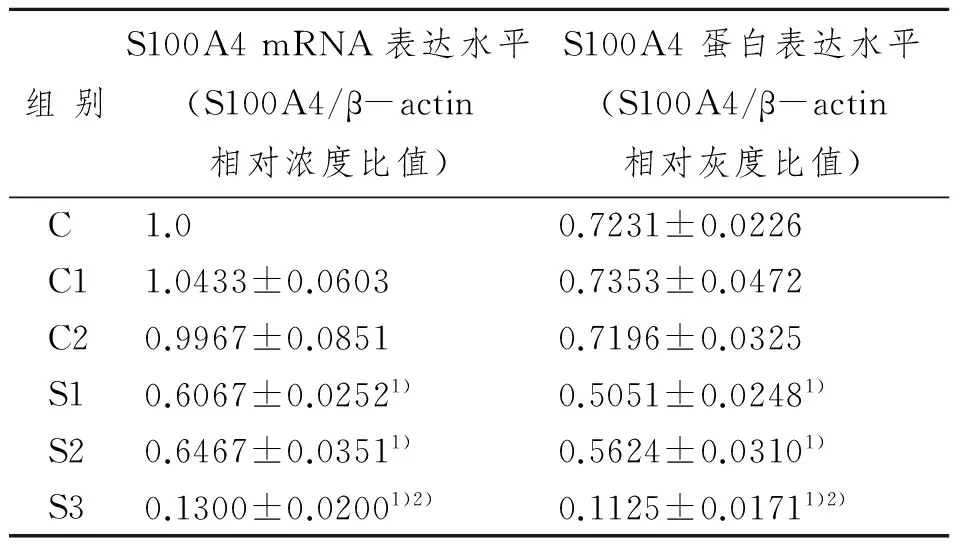
组别S100A4mRNA表达水平(S100A4/β-actin相对浓度比值)S100A4蛋白表达水平(S100A4/β-actin相对灰度比值)C1.00.7231±0.0226C11.0433±0.06030.7353±0.0472C20.9967±0.08510.7196±0.0325S10.6067±0.02521)0.5051±0.02481)S20.6467±0.03511)0.5624±0.03101)S30.1300±0.02001)2)0.1125±0.01711)2)
1)与C 、C1、C2组比较,P<0.05;2)与S1、S2组比较,P<0.05
从以上Real-time PCR和Western blot检测转染效率结果可以得出,S3组抑制S100A4的表达作用更明显。因此,接下来的实验以S3组作为特异性siRNA转染实验组。
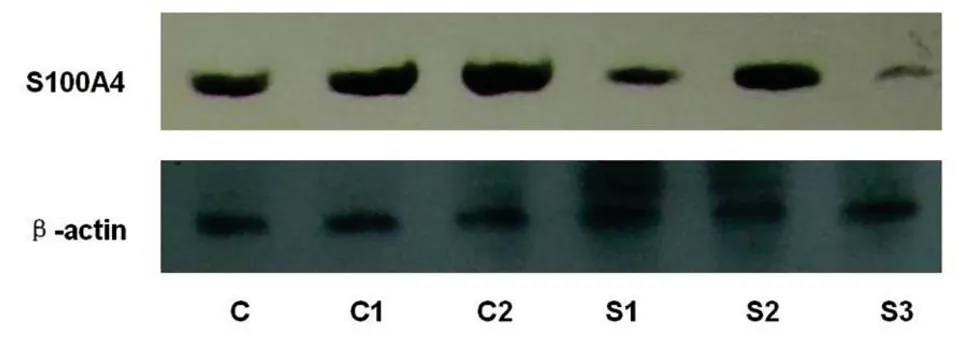
图2应用Western-Blot方法检测转染前后S100A4蛋白表达的变化
Fig 2 Application of Western-Blot method detects the changes of S100A4 protein expression before and after transfection
2.4 细胞增殖抑制实验(MTT)
四甲基偶氮唑蓝比色法(MTT)实验显示,在相同的初始条件下,各组细胞增殖速度相近。24 h后,正常细胞组(0.233±0.0161)、阴性对照组细胞(0.2327±0.0186)增殖速度相近,实验组(0.1823±0.0199)细胞增殖速度减慢,差异有显著性意义(P<0.05)。随着观察时间延长,前两组组间比较,增殖速度相似,差异无显著性意义(P>0.05);实验组与前两组比较,增殖速度明显减慢,差异有显著性意义(P<0.05)。见图3。
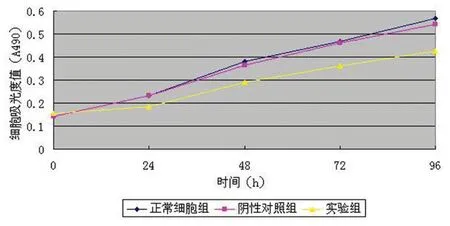
图3 RNA干扰前、后MG-63细胞增殖变化
Fig 3 The changes of MG-63 cell proliferation before and after RNA interference
2.5 平板克隆形成实验
正常细胞组、阴性对照组的细胞生长状态比较相似,而实验组集落细胞形成相对减少,细胞生长缓慢。正常细胞组、阴性对照组及实验组的克隆形成率分别为(18.00±1.63)%,(17.50±1.91)%,(10.00±1.63)%,后者与前两者比较差异有显著性意义(P<0.05)。
2.6 体外侵袭实验
正常细胞组、阴性对照组及实验组侵袭细胞的相对数目分别为34.00±2.72、34.61±3.11、19.50±1.89,后者与前两者比较差异有显著性意义(P<0.05)。见图4。

图4 Transwell小室实验检测细胞侵袭力的变化 (×200)Fig 4 Transwell chamber test detects the changes of cell invasion (×200)A: 正常细胞组; B: 阴性对照组; C: 实验组A: Normal cells group; B: Negative control group; C: Experimental group
3 讨 论
RNA干扰(RNA interference,RNAi)是近年发展起来的研究生物体基因表达、调控与功能的一项新技术[1-3]。它利用了由小干扰RNA(small interfering RNA, siRNA)引起的生物细胞内同源基因的特异性沉默现象,其本质是siRNA与对应的mRNA特异结合、降解,从而阻止mRNA的翻译。RNAi普遍存在于各种生物,具有抗病毒、稳定转座子及监控异常表达mRNA的生物学功能。RNAi现象不仅能提供一种经济、快捷、高效抑制基因表达的技术手段,而且有助于在基因功能测定,基因治疗等方面开辟一条新思路。S100A4蛋白是S100蛋白家族的成员之一, S100蛋白被认为是一组钙离子传感器,通过钙离子信号转导途径在细胞增殖、分化、粘附、运动、基因表达及凋亡过程中发挥重要作用[4]。
本实验根据S100A4基因的mRNA序列,设计3条RNA干扰靶序列及阴性对照,体外合成针对S100A4基因的siRNA 表达载体pSIREN-DNR,用脂质体介导转入人骨肉瘤MG-63细胞中。应用Real-time PCR的方法检测出在转染特异性的siRNA后可以出现S100A4基因 mRNA表达的沉默。用Western-Blot的方法同样检测到了在转染特异性的siRNA后即出现S100A4蛋白的下调,与转染后mRNA的改变基本一致。可见,体外转录合成的siRNA能有效的实现对目的基因的干扰效应。本实验设计合成的针对S100A4基因的siRNA 表达载体能够实现对S100A4基因表达的抑制作用。
本实验MTT结果显示,在相同的初始条件下,各组细胞增殖速度相近,随着观察时间延长特异性siRNA转染组的细胞生长明显受到抑制;而平板克隆形成实验结果同样也表明:特异性siRNA转染组集落细胞形成相对减少,细胞生长缓慢,提示干扰S100A4基因表达后抑制了细胞的增殖能力。
近期的研究表明,S100A4基因和蛋白的异常表达与恶性肿瘤的生物学行为密切相关,特别在肿瘤的侵袭和转移中发挥着重要的作用[5-6]。目前已经发现S100A4在选取的骨肉瘤组织中有比较高的表达,而在对照组骨软骨瘤中没有表达,据此可推测骨肉瘤的发生发展与S100A4的异常表达有密切的关系[7]。作者发现,RNA干扰S100A4基因表达后穿过人工基底膜的细胞数量明显减少,肿瘤细胞的运动侵袭能力明显下降,说明抑制S100A4的表达降低了MG-63细胞的侵袭力,提示S100A4可能参与了肿瘤细胞侵袭力的调节。S100A4通过参与降低肿瘤细胞间粘附力、增加肿瘤细胞的运动能力、重塑细胞外基质、抑制细胞凋亡、促进细胞异常增生、促进新生血管生成等各个阶段,进而促进了恶性肿瘤的侵袭和转移。
RNA干扰技术为骨肉瘤的治疗提供了一种新的思路,S100A4基因与骨肉瘤的侵袭、转移密切相关,应用此技术抑制S100A4基因的表达可能成为骨肉瘤手术、化疗、放疗等传统治疗的辅助手段,本研究为应用RNAi进行肿瘤的基因治疗提供了实验依据。
[1] Foshay KM, Gallicano GI. Small RNAs, big potential: the role of MicroRNAs in stem cell function [J]. Curr Stem Cell Res Ther, 2007, 2 (4): 264-271.
[2] Micklem DR, Lorens JB. RNAi screening for therapeutic targets in human malignancies [J]. Curr Pharm Biotechnol, 2007, 8 (6): 337-343.
[3] Ying SY, Chang DC, Lin SL. The microRNA (miRNA): overview of the RNA genes that modulate gene function [J]. Mol Biotechnol, 2008, 38 (3): 257-268.
[4] Donato R. S100: a multigenic family of calcium-modulated proteins of the EF-hand type with intracellular and extracellular functional roles [J]. Int J Biochem Cell Biol, 2000, 33 (7): 637-668.
[5] Boye K, Andersen K, Tveito S, et al. Interferon-gamma-induced suppression of S100A4 transcription is mediated by the class II transactivator [J]. Tumour Biol, 2007, 28 (1): 27-35.
[6] Tarabykina S, Griffiths TR, Tulchinsky E, et al. Metastasis-associated protein S100A4: spotlight on its role in cell migration [J]. Curr Cancer Drug Targets, 2007, 7 (3): 217-228.
[7] 马旭,王岩峰,安贵峰,等. S100A4基因在不同骨肉瘤细胞和组织中的表达. [J]. 大连医科大学学报,2011,33(6),542-545.

