锂硫电池关键材料改性的研究进展
李 红,徐 强,余劲鹏,桑 林
(1.天津大学化工学院,天津 300072;2.中国电子科技集团公司第十八研究所,天津 300381)
单质硫的理论比容量为1 675 mAh/g,相比于锂离子电池的常见正极材料(见表1),来源丰富、价格便宜且对环境友好,与金属锂组成锂硫电池,理论比能量达2 600 Wh/kg,相当于锂离子电池的5倍。
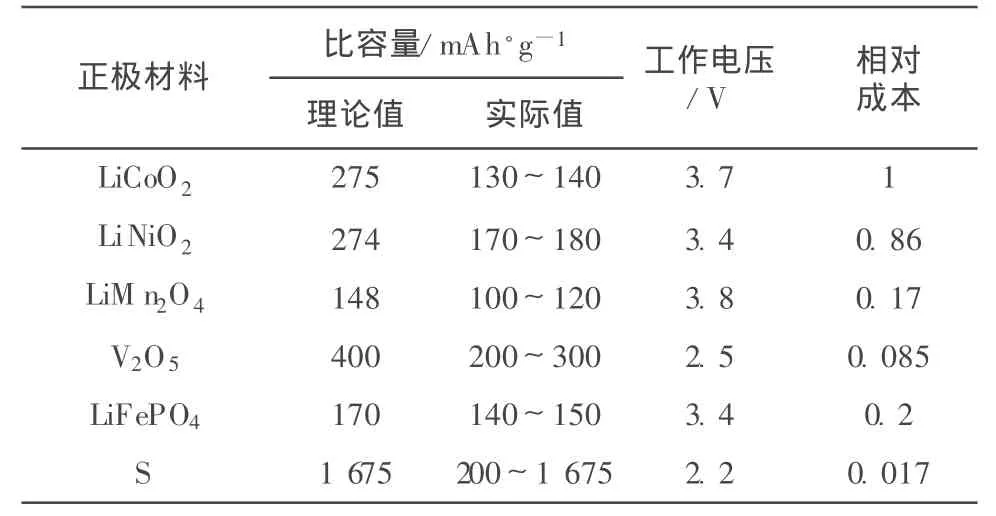
表1 锂离子电池常用正极材料的性能参数Table 1 Performance parameters of common cathode materials for Li-ion battery
与基于嵌入式反应的锂离子电池不同,锂硫电池的工作原理是Li+与单质硫可逆反应生成多硫化物,它不受限于Li+的嵌入数量,因而容量高[1]。有人将锂硫电池应用于无人飞机驱动电源,无人机白天由太阳能电池提供动力并向锂硫电池充电,晚上由锂硫电池放电提供动力,实验电池的能量密度可达500 Wh/kg,飞机可连续飞行14 d[2]。目前,锂硫电池存在的问题主要有[3]:①室温下单质硫(S8)是电子和离子绝缘体(电导率为2.5×10-30S/cm),作为电极活性材料,活化困难;②S8在常见有机电解液中的浸润性差,使电池活性物质无法与电解质接触并完成电化学反应,活性物质利用率低;③放电过程产生的中间产物易溶于有机电解液中,产生“穿梭效应”,造成正极活性物质损失,并腐蚀锂负极;④放电产物Li2S2和Li2S会从电解液中沉淀析出,团聚在硫正极表面,形成不可逆容量并阻碍活性物质与电解质间的接触;⑤负极金属锂表面不均匀,可能生成锂枝晶,导致安全性问题,另外,充放电过程中,部分锂会失活,成为不可逆的死锂。
本文作者针对上述问题,分别对硫正极、电解液和锂负极的改性研究进展进行了综述。
1 硫正极改性
为了提高单质硫的导电性能,抑制放电产物的溶解损失,可添加以下导电性能优良并具有吸附能力的材料,提高硫正极的导电性、抑制多硫化物的“穿梭效应”,改善循环性能。
1.1 硫/碳复合材料
碳材料不仅具有较高的比表面积和较好的导电性能,而且碳的表面对硫及硫化物有较强的物理吸附作用,适合作为硫的载体。硫/碳复合材料一般可经简单的热处理法得到。硫在155℃时熔化,黏度最低,液态硫扩散至碳材料的孔道或网络空隙中,形成导电碳材料负载活性物质硫的硫/碳复合材料。单质碳材料主要包括有序介孔碳、微孔碳、分级介微孔碳、碳纳米管和石墨烯(GNS)等。
介孔碳材料的比表面积大、孔容积大、结构稳定且导电性能好,适合作为硫/碳复合材料的载体。X.L.Ji等[4]用模板法制备了含硫70%的有序介孔碳/硫复合材料,单质硫主要存在于复合材料孔间隙中,固化凝聚成硫纳米纤维,与碳载体紧密连接。该复合材料以0.1 C充放电,首次和第20次循环的放电比容量分别为1 005 mAh/g和 800 mAh/g,容量衰减较快。用聚乙二醇(PEG)包覆后,首次和第20次循环的放电比容量分别提高至1 320 mAh/g和1 100 mAh/g。基于药物传输原理,X.L.Ji等[5]研究了硅基SBA-15吸附在硫正极表面的特性。在电化学反应过程中,硅基SBA-15不仅能可逆地吸脱附多硫化物,还能抑制放电产物Li2S2和Li2S不可逆沉积在复合材料表面,改善电池的循环稳定性。以0.2 C循环 40次,放电比容量仍有 650 mAh/g。N.Jayaprakash等[6]用模板法合成含硫69.75%的介孔碳微球/硫复合材料,以0.5 C在3.1~1.7 V充放电,首次和第100次循环的放电比容量分别为1 071 mAh/g和974 mAh/g,容量保持为 91%,第100次循环的库仑效率为94%,表明多硫化物未溶于有机电解液中。
微孔碳的孔径小,复合后,硫可在微孔碳中高度分散;同时,微孔碳的强吸附性能可抑制放电产物的溶解,确保高的活性物质利用率及循环稳定性。罗虎等[7]将单质硫高度分散到导电性良好的KS6碳骨架中,以提高正极的电化学活性;同时,借助纳米碳孔的吸附作用和石墨颗粒间的相互作用,将中间产物多硫离子控制在孔道内部和石墨颗粒之间,阻止向本体电解液的扩散流失,以期提高活性物质利用率,改善电池的循环稳定性。B.Zhang等[8]通过热处理法得到含硫负载量为42%的碳微球/硫复合材料,硫的利用率可达80%。该复合材料以400 mA/g的电流在3.0~1.0 V循环500次,比容量保持在650 mAh/g,循环性能优良,可满足商用电池体系对循环寿命的要求。该电池的缺点是放电电位滞后,造成工作电压降低。为此,人们提出分级介微孔碳/硫复合的概念,充分借助介孔碳孔径较大、能容纳负载更多的单质硫的特点,保证高的放电容量;微孔碳孔径小和强的吸附性能,保证高的循环性能。C.Liang等[9]通过激活处理制得分级介/微孔多孔碳结构,硫通过溶液浸湿法进入到微孔中,产物具有高的放电容量及良好的循环性能。
多壁碳纳米管(MWCNT)和GNS具有较高的比表面积和良好的吸附能力,也是良好的导电剂,可以提高硫电极的导电性,改善循环性能。S.C.Han等[10]将自制MWCNT直接添加到硫正极中,首次放电比容量仅485 mAh/g。原因是MWCNT很难均匀分布在正极中,与活性材料的接触欠佳。W.Wei等[11]通过球磨,将MWCNT均匀地分散于聚丙烯腈(PAN)与硫颗粒之间,并制成三元复合材料,改善了锂硫电池硫利用率低、循环性能及高倍率性能差等问题,将硫的利用率提高到95.3%。该复合材料以0.5 C在3.0~1.0 V循环 100次,放电容量保持率为96.5%,电流为7.0 C时,放电容量保持率为71%;但由于硫负载量低,放电比容量较低。伍英蕾等[12]分析了MWCNT对复合材料电化学性能的影响,得出当MWCNT的含量为5%~8%时,循环性能最好。L.Yin等[13]通过原位聚合方法,将 MWCNT均匀分散在PAN基质中并形成化学键,制成热解的pPAN-S/MWCNT复合材料。产物以0.1 C充放电,首次放电比容量为697 mAh/g,第50次循环的容量保持率为85%。
J.Z.Wang等[14]通过热处理,将GNS与硫直接复合,硫很难直接均匀分散在GNS中,因此产物的循环性能很差。H.Wang等[15]合成了S/GNS复合材料:先用PEG包覆硫颗粒,再在外面包覆一层经炭黑修饰、低程度氧化的GNS。产物以0.2 C充放电,首次和第100次循环的放电比容量分别为750 mAh/g和600 mAh/g。复合材料中,PEG包覆将硫颗粒的尺寸限制在1 μ m以内,抑制了充放电过程中的体积变化,并改善了复合材料导电性差的问题,减少了多硫化物在电解质溶液中的溶解。
1.2 硫/导电聚合物的复合
常用的导电聚合物有聚吡咯(PPY)、聚苯胺(PANi)、PAN、聚噻吩(PTh)等。其复合机理是:单质硫是良好的脱氢剂,在一定温度下加热导电聚合物与单质硫的混合物,单质硫使有机聚合物的主链脱氢,生成具有共扼电子的导电聚合物;同时,剩余的单质硫在熔融状态下与导电聚合物在分子水平上接触,冷却后形成导电聚合物/硫复合材料。X.Liang等[16-17]分析了不同形貌PPY与硫复合的性能,发现管状PPY(T-PPy)以0.1 mA/cm2的电流密度在3.0~1.0 V循环60次,放电比容量为 500 mAh/g,电化学性能比颗粒状PPY(G-PPY)更好。用T-PPy与升华硫热复合,可制得S/T-PPy复合材料,硫的含量及位置对复合材料电化学性能的影响很大。当硫含量为30%时,由于毛细管作用,硫均匀分布在PPY孔道里,电化学性能最佳,以0.1 mA/cm2的电流密度在3.0~1.0 V循环,首次和第80次循环的放电比容量分别为1 151.7 mAh/g和 650 mAh/g。F.Wu等[18]用化学氧化聚合法,将噻吩氧化聚合于硫颗粒表面,PTh的多孔结构允许电解液进入复合材料,增加电子和离子导电性;PTh能吸附多硫化离子,防止多硫化物进入电解液及对锂负极的腐蚀。产物以100 mA/g电流在3.0~1.0 V充放电,首次和第50次循环的放电比容量分别为1 168.0 mAh/g和819.8 mAh/g,容量保持率为70.2%。F.Wu等[19]研究了包覆硫颗粒的PTh含量对电化学性能的影响。当载硫量为71.9%、PTh含量为18.1%时,电化学性能最好。以 100 mA/g电流在 3.0~1.0 V充放电,首次和第80次循环的放电比容量分别为1 119.3 mAh/g和 830.2 mAh/g。
1.3 硫/纳米金属氧化物的复合
纳米金属氧化物具有高的比表面积和强的吸附性能,可作为硫正极添加剂,抑制放电产物溶解在有机电解液中。常见的金属氧化物有 Ti2O3、La2O3、Al2O3、Mg0.6Ni0.4O 和 V2O5等。W.Zheng等[20]用固相反应法制备纳米La2O3并添加到升华硫中。纳米La2O3化合物对多硫化物具有吸附作用,并对Li/S氧化反应具有催化作用,可加快硫电极的动力学反应。当电流为60 mA/g时,首次和第80次循环的放电比容量分别为800 mAh/g和450 mAh/g,衰减很快。M.S.Song等[21]用溶胶-凝胶法制备的纳米Mg0.6Ni0.4O并添加到硫正极中,具有催化和吸附作用。以167.5 mA/g电流在3.5~1.5 V充放电,首次和第50次循环的放电比容量分别为1 185 mAh/g和 1 007 mAh/g,容量保持率为 85%。Y.J.Choi等[22]将纳米γ-Al2O3添加到硫正极中,能抑制多硫化物的溶解,放电容量比未添加的高,循环性能也更好。Y.Zhang等[23]通过溶胶-凝胶法制得V2O5,再与硫机械混合,得到复合材料。交流阻抗测试显示:含该复合材料的硫电极,电荷传递阻抗低于普通硫电极,电池的大电流放电性能良好。
2 电解液改性
锂硫电池要求电解液的电导率高、电化学窗口宽与锂负极相容性好。常用溶剂优化与凝胶电解质的应用来改性。
单质硫具有离子导电绝缘性,用于锂硫电池中的有机溶剂与一般常见锂离子电池不同,必须对单质硫及多硫化物具有一定的溶解度,提高硫的利用率;但过量溶解会造成活性物质损失及引起“穿梭效应”等问题,一般使用混合有机溶剂。常用的有机溶剂有1,3-二氧五环(DOL)、乙二醇二甲醚(DME)和四乙二醇二甲醚(TEGDME)等。W.Wang等[24]研究了电解液1 mol/L LiClO4/DOL+DME的溶剂组成对电化学性能的影响。DME能提供良好的氧化还原反应环境,但过量会增加电池的界面阻抗;DOL在一定程度上能解决这个问题,过量会影响电池的循环稳定性。有机溶剂的最佳配比为 v(DOL)∶v(DM E)=1∶2。
凝胶电解质由于不含流动的有机电解液,可以避免硫及多硫化物的溶解,有望解决锂硫电池循环性能差等问题。J.H.Shin等[25]以TEGDME为塑化剂、偏氟乙烯与六氟丙烯的共聚物P(VDF-HFP)为基体、LiPF6为锂盐,制得电导率为0.499 mS/cm的凝胶态电解质,以0.14 mA/cm2的电流密度充放电,首次放电比容量可达 765 mAh/g。J.L.Wang等[26]将纳米SiO2掺杂的P(VDF-HFP)作为基体,吸收电导率为1.2 mS/cm的电解液1 mol/L LiPF6/PC+EC+DEC(体积比1∶4∶5),用于硫和活性炭纳米复合材料组成的锂硫电池。硫的利用率为90%,以0.3 mA/cm2的电流密度在3.0~1.0 V充放电,首次和循环稳定后的放电比容量分别为800 mAh/g和440 mAh/g。J.L.Wang等[27]使用PAN/S复合材料和P(VDF-HFP)基凝胶电解质组装电池,以0.2 mA/cm2的电流密度在3.0~1.0 V充放电,首次和第50次循环的放电比容量分别为850 mAh/g和600 mAh/g。凝胶电解质的性能低于有机电解液,原因可能是凝胶电解质膜的电导率低,机械稳定性差,凝胶电解质膜与电极的相容性差,界面电阻大。
3 锂负极改性
金属锂化学性质活泼,易与电解液反应生成固体电解质相界面(SEI)膜,导致电极极化电阻增大;负极金属锂表面不均匀,可能生成锂枝晶,导致安全问题;另外,在充放电过程中,部分锂会失活;放电产物溶于电解液,会造成锂负极的腐蚀。基于这些原因,对锂金属表面进行修饰保护很有必要。目前,对锂负极保护主要是采用电解液添加剂,在锂负极表面形成一层稳定的 SEI膜。J.W.Choi等[28]研究了在LiCF3SO3/TEGDME电解液中加入甲苯的影响。加入甲苯可降低电极和电解液界面的阻抗,加入5%甲苯的锂硫电池以 C/16的电流在2.8~1.5 V放电,比容量为 750 mAh/g。X.Liang等[29]将LiNO3添加到有机电解液中,可在锂负极表面形成一层保护膜,防止多硫化物对锂负极的腐蚀,进而抑制“穿梭效应”。电池以 0.1 mA/cm2的电流密度在3.0~1.0 V充放电,第50次循环的库仑效率和放电比容量分别为95%和527 mAh/g。D.Aurbach等[30]利用 FT-IR和 XPS测试,分析了LiNO3的作用机理,得出锂能还原 LiNO3,得到LixNOy,还原氧化多硫化物,得到 LixSOy,从而钝化锂层,抑制多硫化物对锂负极的腐蚀,提高充放电效率。
可直接在锂金属表面形成保护层,进行保护。K.Chung等[31]通过磁控溅射的方法,在锂负极表面溅射电子绝缘、离子导电的锂磷氧氮层,隔离锂负极和有机电解液,发现在充放电过程中,锂负极保持了良好的可逆性。Y.M.Lee等[32]通过单体在锂负极与电解液表面紫外光固化,形成保护层,抑制“穿梭效应”,改善电池的循环性能。R.S.Thompson等[33]在锂负极表面形成一层基于硅烷的包覆层,阻止电解液扩散至锂表面,延长了负极的循环寿命。
4 结束语
锂硫电池研究的方向主要为:①锂硫电化学反应机理基础性研究;②寻找高比表面积、高孔容的分级多孔碳材料作为硫的载体,保证高的放电容量及长的循环寿命;③优化电解液的组成及电解液添加剂的研发;④离子液体及高性能凝胶电解质膜的研究;⑤锂负极的保护技术。
[1] Ji X L,Nazar L F.Advances in Li-S batteries[J].J Mater Chem,2010,20(44):9 821-9 826.
[2] http://www.qinetiq.com/news/PressReleases/Pages/zephyr-14-days.aspx[EB/OL].
[3] WU Feng(吴峰),YANG Han-xi(杨汉西).绿色二次电池[M].Beijing(北京):Science Press(科学出版社),2009.67-88.
[4] Ji X L,Lee K T,Nazar L F.A highly ordered nano-structured carbon-sulphur cathode for lithium-sulphur batteries[J].Nat Mater,2009,8(6):500-506.
[5] Ji X L,Evers S,Black R,et al.Stabilizing lithium-sulphurcathodes using polysulphide reservoirs[J].Nature Communications,2011,2:325-332.
[6] Jayaprakash N,Shen J,Moganty S S,et al.Porous hollow carbon@sulfur composites for high-power lithium-sulfur batteries[J].Angew Chem,Int Ed 2011,50(26):5 904-5 908.
[7] LUO Hu(罗虎),DENG Quan-dao(邓全道),XU Guang(许光).单质硫与 KS6合成石墨制备 S/C复合材料[J].Battery Bimonthly(电池),2010,40(6):323-326.
[8] Zhang B,Qin X,Li G R,et al.Enhancement of long stability of sulfur cathode by encapsulating sulfur into micropores of carbon spheres[J].Energy&Environmental Science,2010,3(10):1 531-1 537.
[9] Liang C,Dudney N J,Howe J Y.Hierarchically structured sulfur/carbon nanocomposite material for high-energy lithium battery[J].Chem Mater,2009,21(19):4 724-4 730.
[10] Han S C,Song M S,Lee H,et al.Effect of multiwalled carbon nanotubes on electrochemical properties oflithium sulfur rechargeable batteries[J].J Electrochem Soc,2003,150(7):A889-A893.
[11] Wei W,Wang J,Zhou L,et al.CNT enhanced sulfur composite cathode material for high rate lithium battery[J].Electrochem Commun,2011,13(5):399-402.
[12] WU Yin-lei(伍英蕾),YANG Jun(杨军),W ANG Jiu-lin(王久林),et al.高性能锂-硫电池用复合正极的构造与粘结剂[J].Acta Physico-Chimica Sinica(物理化学学报),2010,26(2):283-290.
[13] Yin L,Wang J,Yang J,et al.A novel pyrolyzed polyacrylonitrilesulfur@MWCNT composite cathode material forhigh-rate rechargeable lithium/sulfur batteries[J].J Mater Chem,2011,21(19):6 807-6 810.
[14] Wang J Z,Lu L,Choucair M,et al.Sulfur-graphene composite for rechargeable lithium batteries[J].J Power Sources,2011,196(16):7 030-7 034.
[15] Wang H,Yang Y,Liang Y,et al.Graphene-wrapped sulfur particles as a rechargeable lithium-sulfurbattery cathode material with high capacity and cycling stability[J].Nano Lett,2011,11(7):2 644-2 647.
[16] Liang X,Wen Z,Liu Y,et al.Preparation and characterization of sulfur-polypy rrole composites with controlled morphology as high capacity cathode for lithium batteries[J].Solid State Ionics,2011,192(1):347-350.
[17] Liang X,Liu Y,Wen Z,et al.A nano-structured and highly ordered polypy rrole-sulfur cathode for lithium-sulfur batteries[J].J Power Sources,2011,196(16):6 951-6 955.
[18] Wu F,Wu S X,Chen R,et al.Sulfur-polythiophene composite cathode materials for rechargeable lithium batteries[J].Electrochem Solid-State Lett,2010,13(4):A29-A31.
[19] Wu F,Chen J Z,Chen R J,et al.Sulfur/polythiophene with a core/shell structure:synthesis and electrochemical properties of the cathode for rechargeable lithium batteries[J].J Phys Chem C,2011,115(13):6 057-6 063.
[20] Zheng W,Hu X G,Zhang C F.Electrochemical properties of rechargeable lithium batteries with sulfur-containing composite cathode materials[J].Electrochem Solid-State Lett,2006,9(7):A364-A367.
[21] Song M S,Han S C,Kim H S,et al.Effects of nanosized adsorbing material on electrochemical properties of sulfur cathodes for Li/S secondary batteries[J].J Electrochem Soc,2004,151(6):A791-A795.
[22] Choi Y J,Jung B S,Lee D J,et al.Electrochemical properties of sulfur electrode containing nano Al2O3for lithium/sulfur cell[J].Phys Scr,2007,T129:62-65.
[23] Zhang Y,Wang L,Zhang A,et al.Novel V2O5/S composite cathode material for the advanced secondary lithium batteries[J].Solid State Ionics,2010,181(17-18):835-838.
[24] Wang W,Wang Y,Huang Y,et al.T he electrochemical performance of lithium-sulfur batteries with LiClO4DOL/DME electrolyte[J].J Appl Electrochem,2010,40(2):321-325.
[25] Shin J H,Jung S S,Kim K W,et al.Preparation and characterization of plasticized polymer electroly tes based on the PVdF-HFP copolymer for lithium/sulfur battery[J].J M ater Sci:Mater Electron,2002,13(12):727-733.
[26] Wang J L,Liu L,Ling Z J,et al.Polymer lithium cells with sulfur composites as cathode materials[J].Electrochim Acta,2003,48(13):1 861-1 867.
[27] Wang J L,Yan J,Xie J Y,et al.A novel conductive polymer-sulfur composite cathode material for rechargeable lithium batteries[J].Adv Mater,2002,14(13-14):963-965.
[28] Choi J W,Cheruvally G,Kim D S,et al.Rechargeable lithium/sulfur battery with liquid electrolytes containing toluene as additive[J].J Power Sources,2008,183(1):441-445.
[29] Liang X,Wen Z Y,Liu Y,et al.Improved cycling performances of lithium sulfur batteries with LiNO3-modified electrolyte[J].J Power Sources,2011,196(22):9 839-9 843.
[30] Aurbach D,Pollak E,Elazari R,et al.On the surface chemical aspects of very high energy density,rechargeable Li-sulfur batteries[J].J Electrochem Soc,2009,156(8):A694-A702.
[31] Chung K,Kim W S,Choi Y K.Lithium phosphorous oxynitride as a passive layer for anodes in lithium secondary batteries[J].J Electroanal Chem,2004,566(2):263-267.
[32] Lee Y M,Choi N S,Park J H,et al.Electrochemical performance of lithium/sulfur batteries with protected Li anodes[J].J Power Sources,2003,119(S1):964-972.
[33] T hompson R S,Schroeder D J,Lopez C M,et al.Stabilization of lithium metal anodes using silane-based coatings[J].Electrochem Commun,2011,13(12):1 369-1 372.

