纳米NiO负极材料的制备及电化学性能
李求忠,游东宏,陈 震,2
(1.宁德师范学院化学系,福建宁德 352100;2.福建师范大学化学与材料学院,福建福州 350007)
商品锂离子电池的负极材料主要以石墨化碳为活性物质,但受碳理论比容量(373 mAh/g)的限制[1]。纳米结构的过渡金属氧化物MxOy(M=Ni、Co、Cu和Fe)可作为锂离子电池负极材料[2],但嵌脱锂机理与锡基氧化物不同:在嵌锂时,MxOy与Li反应,生成Li2O和纳米级金属M;在脱锂时,金属M与 Li2O可逆反应,生成MxOy和Li[3][见式(1)]。

NiO负极材料的理论比容量为718 mAh/g,实际比容量与表面结构、充放电时的体积变化及活性粒子的团聚情况等关系密切。不同方法制备的活性材料,电化学性能差别大,通常,活性材料的粒径越大、越不均匀,循环性能越差[4]。目前,制备NiO薄膜的主要方法有磁控溅射法、化学气相沉积法和电沉积法等,制备NiO纳米粉体的主要方法是固相法和溶胶-凝胶法[5],所得产物具有较好的循环性能。乳液沉淀法制备的材料粒径分布窄且可控,制备时粒子的表面包覆一层表面活性剂,使粒子间不易团聚,稳定性好,选择不同的表面活性剂修饰,可获得不同性质的纳米微粒。直接沉淀法制备的材料,没有表面活性剂的修饰作用,粒子容易发生团聚,粒径大,且粒径不易控制,分布不均匀。
本文作者分别采用乳液沉淀法和直接沉淀法制备了Ni(OH)2前驱体,在空气氛中煅烧得到不同形态的NiO材料,考察了产物作为锂离子电池负极材料的电化学性能。
1 实验
1.1 材料的制备与分析
在100 ml 0.5 mol/L NiCl2(天津产,AR)中加入10 ml 2%曲拉通X-100(上海产,99%),在 60℃水浴、快速搅拌的条件下滴加0.5 mol/L NaOH(上海产,AR),控制终点pH=10,搅拌30 min,抽滤后,用去离子水洗至无泡沫,再用无水乙醇(上海产,AR)洗涤 3次,在100℃下干燥5 h,得到浅绿色的 Ni(OH)2前驱体(乳液法)。在无曲拉通X-100的条件下,用相同的方法制备Ni(OH)2前驱体(直接法)。将上述前驱体在500℃下煅烧2 h,得到黑色NiO粉体,使用和不使用曲拉通X-100的样品分别记为样品A和B。
用D8 Advance型X射线衍射仪(德国产)进行物相分析,CuKα,管压 40 kV 、管流 40 mA,扫描速度为 6(°)/min;用XL30 ESEM-TMP环境扫描电子显微镜(荷兰产)观察形貌。
1.2 电池组装及电化学性能测试
将制得的NiO、高导电炭BP2000(宁夏产,电池级)和聚偏氟乙烯(上海产,电池级)按质量比75∶15∶10混合,加入少量N-甲基吡咯烷酮(天津产,AR),以250 r/min的转速球磨(球料比20∶1)2 h,制成浆料,再均匀涂覆约 2.5 mg于铜箔(Φ 15 mm×0.1 mm,广州产,电池级)上,在 120℃下真空(<113 Pa)干燥5 h后,以6 MPa的压力压片。
以金属锂片(北京产,99.9%)为对电极,1 mol/L LiPF6/EC+DMC+DEC(体积比1∶1∶1,上海产,电池级)为电解液,Celgard 2325微孔聚丙烯膜(美国产)为隔膜,在充满氩气的手套箱中组装CR2025型扣式电池。
用电池测试系统(武汉产)进行恒流充放电测试,电流为100 mA/g,电压为0.01~3.00 V。用CHI660C电化学分析仪(上海产)进行循环伏安和交流阻抗测试。循环伏安的扫描速率为0.1 mV/s,电压为0~3 V(vs.Li+/Li);交流阻抗的频率为0.05~105Hz,交流信号振幅为5 mV。
2 结果与讨论
2.1 材料的分析
图1是制得的NiO样品的XRD图。
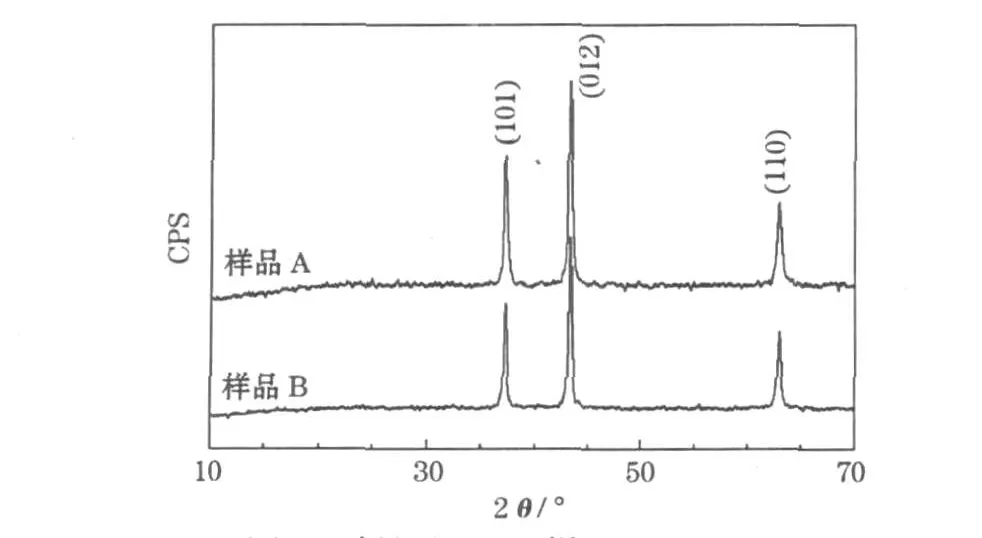
图1 制得的NiO样品的XRD图Fig.1 XRD patterns of prepared NiO samples
从图1可知,两种样品分别在37.32°、43.36°和62.84°处出现衍射峰,与 NiO标准谱(PDF:44-1159)的特征峰吻合,属R3m空间群。用Sherrer公式,以最强的(012)衍射峰计算,样品A和B的平均粒径分别为17.5 nm和21.5 nm。
图2是制得的NiO样品的SEM图。

图2 制得的NiO样品的SEM图Fig.2 SEM photographs of prepared NiO samples
从图2a可知,样品A呈均匀的粒状,从图2b可知,纳米颗粒致密地聚集在一起,形成粒径为50~100 nm的较大颗粒。曲拉通X-100起到了乳化的作用,可使生成的沉淀粒径更小,分散更均匀。从图2c可知,样品B呈不规则的块状结构,一次颗粒的粒径为微米级,大于样品A,不均匀,且带有棱角和尖角。这种结构在充放电时易造成材料的粉化、剥落,容量衰减速度较快。
2.2 电化学性能测试
制得的NiO样品的首次充放电曲线见图3。
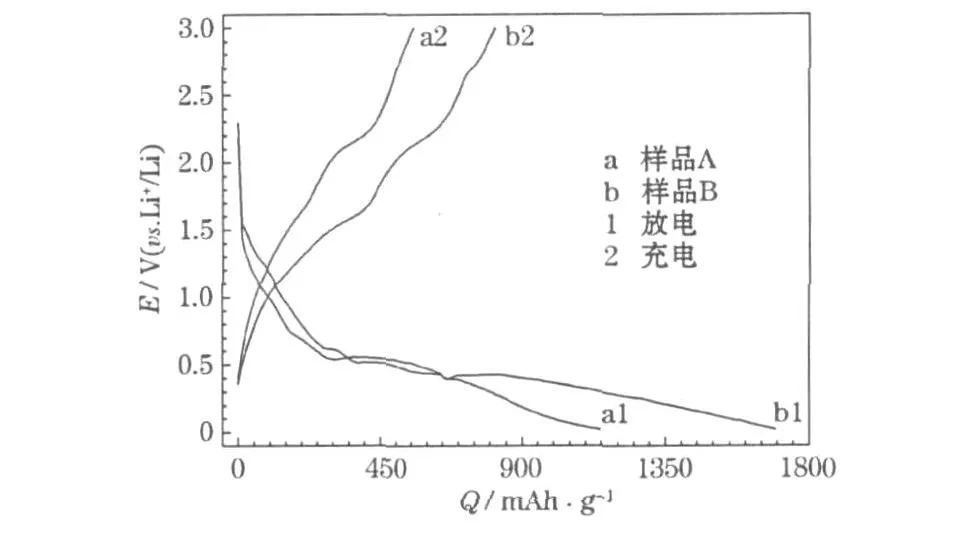
图3 制得的NiO材料的首次充放电曲线Fig.3 Initial charge-discharge curves of prepared NiO materials
从图3可知,在放电(嵌锂)过程中,电压很快下降到1.50 V;在1.50~0.54 V,电压下降较慢,是形成固体电解质相界面(SEI)膜的过程;在0.54~0.01 V,电压下降缓慢,是NiO与Li+生成可逆的Li2O和纳米金属Ni的过程。在充电(脱锂)过程中,出现分步脱锂的特征。S.Grugeon等[6]认为:嵌锂时生成的纳米过渡金属(Ni、Co、Cu和Fe等)具有催化作用,在脱锂时能使SEI膜部分分解而脱出锂,提高可逆容量。图3的充电曲线出现分步脱锂特征,对应部分SEI膜在纳米Ni催化作用下分解,以及Li2O与Ni发生氧化反应生成NiO和Li+的过程。NiO的充放电过程可用式(2)表示。
制得的NiO样品的循环性能见图4。
结合图3、图4可知,样品A的首次放电比容量为1 146.7 mAh/g,高于NiO的理论值,但首次充电比容量仅为555.3 mAh/g,库仑效率低,不可逆比容量(591.4 mAh/g)大,主要原因是大部分的SEI膜不能可逆分解和一定量的Li2O不能顺利脱锂。样品B的首次充、放电比容量均高于样品A,不可逆比容量更大,达881.4 mAh/g。第 2次循环,样品A和B的充、放电比容量相差不大,不可逆比容量仍较大,与首次循环相比,样品A的充电比容量有所升高,库仑效率升高,样品B的充电比容量下降明显。在随后的循环中,样品A的充电比容量衰减很慢,而样品B衰减较快。第30次循环,样品A的充电比容量为427.3 mAh/g,库仑效率为94.9%,容量保持率为 76.9%;样品 B的充电比容量为325.0 mAh/g,容量保持率为39.9%。综上所述,样品A的循环性能优于样品B。Li+在纳米级且均匀分布的样品A中更易嵌脱,嵌锂时生成的纳米颗粒 Ni分布均匀,对SEI膜的分解起到了更好的催化作用,可提高材料的循环性能。
图5是NiO电极的Nyquist图,其中,高、中频区圆弧反映的是电化学反应的电荷传递阻抗(Rct),低频区的斜线反映的是Li+在电极中扩散的Warburg阻抗(ZW)。
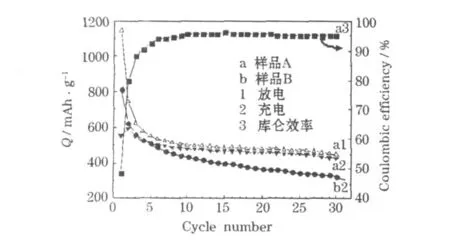
图4 制得的NiO样品的循环性能Fig.4 Cycle performance of prepared NiO samples
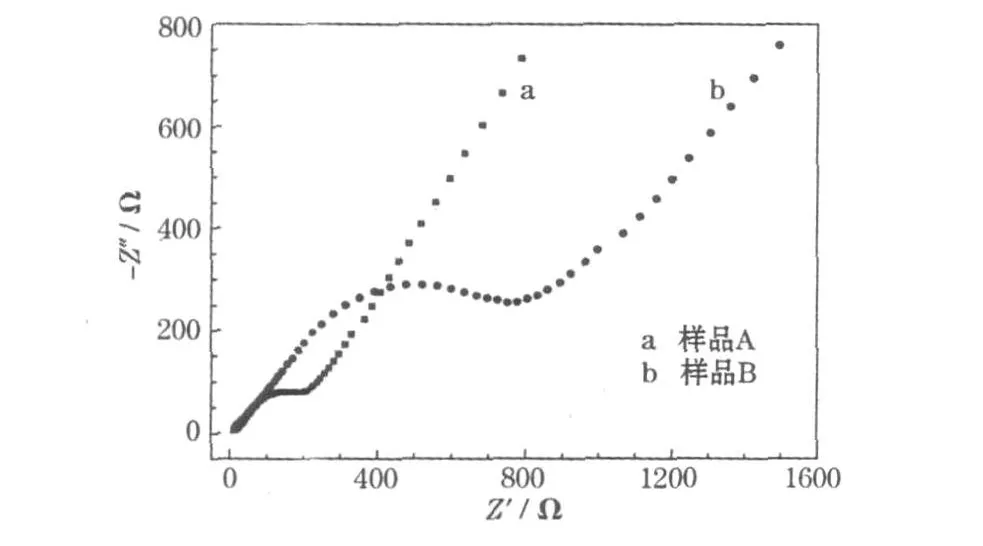
图5 NiO电极的 Nyquist图Fig.5 Nyquist plots of NiO electrodes
从图5可知,样品A的圆弧直径比样品B的小,将实验结果用ZSimpWin软件拟合,得到的 Rct分别为265 Ω/cm2和917 Ω/cm2,表明样品 A的电导率高,更容易发生电化学反应,有利于提高循环性能。
样品A前2次循环的循环伏安曲线见图6。
图6中曲线的特征,与X.H.Huang等[3]报道的相似。首次阴极扫描时,在0.14 V出现1个强的还原峰(嵌锂),对应于NiO与Li+反应生成纳米尺寸的Ni和无定形态的Li2O;在第2次循环中,还原峰变宽、减弱且漂移到1.07 V,且在0.37 V有1个弱的还原峰。阳极扫描过程在1.71 V和 2.24 V出现 2个氧化峰(脱锂),分别对应SEI膜的分解和 Li2O与 Ni反应生成NiO[3,6]。
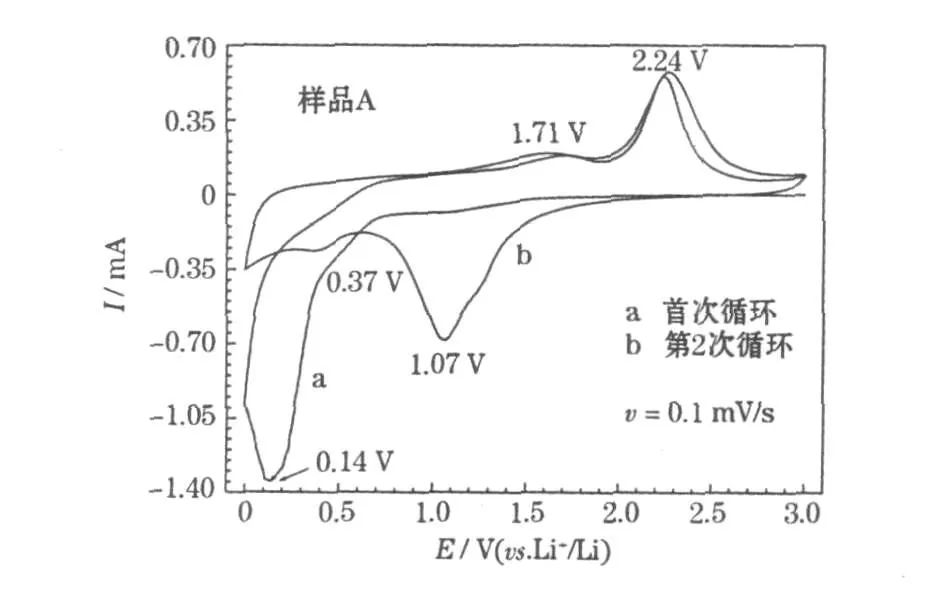
图6 NiO电极前2次的循环伏安曲线Fig.6 CV curves of NiO electrode in the first two cycles
3 结论
分别采用乳液沉淀法和直接沉淀法制备了Ni(OH)2前驱体,在500℃下煅烧2 h后,制得NiO材料。XRD和SEM分析结果表明:在乳液中制备的纳米NiO材料更均匀、粒径更小。用乳液沉淀法制得的纳米NiO材料,电导率更高,容量衰减较慢,因此具有更好的循环性能,首次放电比容量达1 146.7 mAh/g,充电比容量为 555.3 mAh/g,第 30次循环的充电比容量为427.3 mAh/g,容量保持率为76.9%,库仑效库为94.9%;用直接沉淀法制得的NiO材料,第30次循环的充电比容量为325.0 mAh/g,容量保持率为39.9%。
[1] YANG Tong-huan(杨同欢),GUO Yong-lang(郭永榔),ZHOU Xue-chou(周学酬),et al.碳包覆纳米SnO2锂离子电池负极材料合成及其性能研究[J].Chinese Journal of Inorganic Material(无机材料学报),2009,24(1):147-151.
[2] Poizot P,Laruelle S,Grugeon S,et al.Nanosized transition-metal oxides as negative-electrode materials for lithium-ion batteries[J].Nature,2000,407(6 803):496-499.
[3] Huang X H,T u J P,Zhang B,et al.Electrochemical properties of NiO-Ni nanocomposite as anode material for lithium ion batteries[J].J Power Sources,2006,161(1):541-544.
[4] Huang X H,Tu J P,Zhang C Q,et al.Net-structured NiO-C nanocomposite as Li-intercalation electrode material[J].J Electrochem Commun,2007,9(5):1 180-1 184.
[5] LIANG Ying(梁英),FAN Jing(范晶),JIA Zhi-Jie(贾志杰).负极材料NiO的制备及电化学性能[J].Chinese Journal of Inorganic Chemistry(无机化学学报),2007,23(1):97-100.
[6] Grugeon S,Laruelle S,Herrera-Urbina R,et al.Particle size effects on the electrochemical performance of copper oxides toward lithium[J].J Electrochem Soc,2001,148(4):A285-A292.

