E-钙粘蛋白、β-catenin和HER-2在恶性皮肤肿瘤中的表达及其意义
邵哲人 姜方震 满孝勇 包祺 王璐 钱欢 胡学庆
E-钙粘蛋白、β-catenin和HER-2在恶性皮肤肿瘤中的表达及其意义
邵哲人 姜方震 满孝勇 包祺 王璐 钱欢 胡学庆
目的 希望能够找到通过对皮肤肿瘤进行侵袭性评估的方法,来指导临床肿瘤扩大切除范围,以及切除后创面修复方法的选择。方法 选取包括正常皮肤、脂溢性角化症、皮肤基底细胞癌和皮肤鳞癌临床病理标本,石蜡包埋后连续切片,进行E-cadherin、β-catenin和 HER-2的免疫荧光染色,观察染色结果以评价不同病理类型肿瘤的侵袭性。结果 正常皮肤及SK皮肤表皮细胞高表达E-cadherin和β-catenin,而皮肤基底细胞癌与皮肤鳞癌的表达下降。皮肤基底细胞癌与皮肤鳞癌中HER-2的表达水平较正常皮肤及SK皮肤升高。结论 E-cadherin、β-catenin和HER-2在皮肤肿瘤中的表达是评估肿瘤侵袭性的重要指标,对于临床手术治疗具有指导性意义。
皮肤肿瘤 肿瘤侵袭性 上皮型钙粘蛋白 β-连环蛋白 2型人类表皮生长因子受体
皮肤肿瘤的局部侵袭和转移能力与发病率和死亡率相关。转移性皮肤肿瘤中,当肿瘤细胞脱离主要病灶,可横向或纵向侵袭,并通过周围的间质迁移,侵入血管和淋巴管形成肿瘤播散灶,这一过程与肿瘤细胞间黏附功能的降低有关。上皮型钙粘蛋白(E-cadherin)是重要的上皮细胞粘附分子,可与其胞内域相连接的β-连环蛋白(β-catenin)构成E-钙粘蛋白-连环蛋白复合体(E-cadherin/catenin)发挥细胞间黏附作用,对抑制皮肤肿瘤的侵袭转移具有重要意义。针对E-钙粘蛋白复合体调控机制的进一步深入研究,对于阐明皮肤肿瘤的侵袭转移有着重要的意义,有可能通过纠正E-钙粘蛋白和β-连环蛋白的表达和分布异常,以增强细胞之间黏附作用,从而降低肿瘤细胞的侵袭转移潜能,将为皮肤肿瘤的靶向治疗提供新的思路。
2型人类表皮生长因子受体(Human epidermal growth factor receptor type 2,HER-2) 由原癌基因HER-2/neu编码,对细胞的生长、分化及存活有着重要的调节作用。在乳腺癌、卵巢癌、肺腺癌、肾细胞癌等许多肿瘤中有不同程度的表达,但在皮肤肿瘤中的相关报道较少。研究表明,HER-2被激活后,可通过多种途径增强肿瘤细胞的浸润、转移能力,如促进肿瘤细胞增殖、抑制凋亡、增加基质金属蛋白酶(Matrix metal10proteinase,MMP)和血管内皮生长因子(Vascular endothelial growth factor,VEGF)等的表达。阐明HER-2与皮肤肿瘤浸润转移的关系,将有可能为延长患者生存期,减少肿瘤复发、转移的针对性治疗方案提供理论依据。
整形外科皮肤恶性肿瘤的临床治疗过程中,常面临肿瘤扩大切除范围,以及切除后创面修复方法的选择,肿瘤的侵袭性是重要的考虑因素之一。肿瘤侵袭性的强弱是其恶性程度的重要特质,直接关系到术后是否有肿瘤细胞的残留,以及是否存在短期内复发的可能。本研究拟通过对皮肤基底细胞癌(Basal Cell Carcinoma,BCC) 和皮肤 鳞 状 细 胞 癌(Squemous Cell Carcinoma,SCC) 组织中 E-钙粘蛋白、β-catenin和HER-2的表达来评估其侵袭性,以正常皮肤和脂溢性角化症(Seborrheic keratosis,SK)作为对照。通过对皮肤肿瘤侵袭性的评估,结合临床病例术后转归的分析,希望能够找到通过对皮肤肿瘤进行侵袭性评估的方法,来指导临床肿瘤扩大切除范围,以及切除后创面修复方法的选择。
1 材料与方法
1.1 实验材料
1.1.1 组织标本
包括正常皮肤、脂溢性角化症、皮肤基底细胞癌和皮肤鳞癌,均取自临床病理标本。
1.1.2 抗体及免疫组织荧光试剂
兔抗人 β-catenin(Santa Cruz,SC-7199);兔抗人 E-cadherin(Santa Cruz,SC-7870);兔抗人 HER-2(Santa Cruz,SC-284);荧光二抗 cy3 dunkey antirabbit(Jackson,715-165-150);DAPI(Roche,236276)。
1.1.3 主要仪器
荧光显微镜(Olympus IX71)及数码照相机CCD(DP72 和相关软件);石蜡切片机(LEICA,RM2135)。
1.2 实验方法
组织标本石蜡包埋后连续切片,二甲苯梯度乙醇脱蜡至水;去离子水漂洗3次,10 MM枸橼酸钠100℃中10 min抗原热修复,去离子水漂洗3次,10%胎牛血清37℃封闭1 h后倾去液体,分别滴加兔抗人 β-catenin(1∶100);兔抗人 E-cadherin(1∶100);兔抗人HER-2(1∶100)置湿盒内4℃冰箱孵育过夜。弃去一抗后去离子水漂洗3次,滴加Cy3 dunkey anti-rabbit荧光二抗;去离子水漂洗3次,荧光显微镜下检测染色结果,数码相机拍照。另有连续石蜡切片,二甲苯梯度乙醇脱蜡至水;去离子水漂洗3次,DAPI核衬染,去离子水漂洗3次,荧光显微镜下检测染色结果,数码相机拍照。
2 实验结果
2.1 E-cadherin
E-cadherin主要在表皮细胞的细胞膜上表达。实验结果提示,正常皮肤以及SK增厚的表皮层中E-cadherin表达清晰,荧光信号强。在BCC标本上,E-cadherin的表达较前述对照标本的表达减弱,而SCC标本E-cadherin的表达更弱,且信号不连续,说明随着肿瘤恶性程度的提高,E-cadherin的表达依次递减(图1)。

图1 E-cadherin在恶性皮肤肿瘤中的表达Fig.1 Expression of E-cadherin in manignent skin tumor
2.2 β-catenin
β-catenin主要表达在表皮细胞的细胞浆中。与E-cadherin的结果相似,正常皮肤与SK标本的表皮细胞内有β-catenin的强烈表达。BCC标本中βcatenin的表达减弱,在SCC标本中,我们观察到βcatenin的表达随着与角化珠的距离增大而逐渐减弱(图2)。
2.3 HER-2
HER-2是细胞膜受体,表达在表皮细胞的胞膜上。正常皮肤标本和SK皮肤标本上虽有表达,但BCC中HER-2的表达明显加强,而在SCC中HER-2的表达呈现弥漫性,表达范围较广,提示了SCC表达HER-2的特殊性(图3)。

图2 β-catenin在恶性皮肤肿瘤中的表达Fig.2 Expression of β-catenin in manignent skin tumor
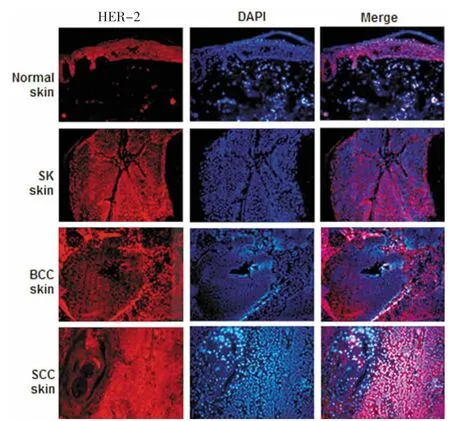
图3 HER-2在恶性皮肤肿瘤中的表达Fig.3 Expression of HER-2 in manignent skin tumor
3 讨论
3.1 E-cadherin与皮肤肿瘤侵袭性
越来越多的研究发现,细胞黏附分子在转移性癌症细胞的细胞连接中起着重要作用。而钙粘蛋白是一种介导同质细胞间相互粘附的Ca2+依赖性跨膜糖蛋白。可分为3个亚型:上皮型钙粘蛋白(E-cadherin)、胎盘型钙粘蛋白(P-cadherin)和神经型钙粘蛋白(N-cadherin)。E-cadherin在表皮黑色素细胞和角质形成细胞上表达增高,在胃癌、肝癌、乳腺癌和肺癌等癌细胞中表达降低。皮肤疾病中,天疱疮和毛囊角化症(Darier氏病)患者的皮肤病理示棘细胞层E-cadherin表达显著减少。E-cadherin表达减少或不稳定也见于皮肤鳞状细胞癌、恶性黑色素瘤和Paget病,但其在皮肤基底细胞癌中的表达目前尚无定论。
关于皮肤黑色素瘤的研究表明,黑色素细胞迁移粘附至基底膜后,将通过其细胞树突与角质形成细胞形成复杂的联系,角质形成细胞可控制黑素细胞的生长和表面受体的表达。信号受体,如E-钙粘蛋白、P-钙粘蛋白和桥粒芯糖蛋白(Desmoglein)的下调,是黑色素瘤细胞逃避角质形成细胞调控的主要机制之一[1]。经典的钙粘蛋白,即E-cadherin、N-cadherin和P-cadherin,可决定皮肤黑素细胞的定位。在痣和黑色素瘤发展过程中,两种生长因子信号通路下调,随之而来的是E-cadherin表达的变化,导致痣细胞和黑色素细胞在皮肤中重新定位[2]。
研究发现,使痣和黑色素瘤细胞中强制表达E-cadherin,可以重建角质细胞对黑色素细胞的控制,从而逆转黑色素细胞的恶性表型。即使在高度侵袭性黑素瘤细胞中,抑制肿瘤浸润和转移相关基因的表达对黑色素瘤的治疗有重要意义[2]。
3.2 β-连环蛋白与E-cadherin形成复合体参与皮肤肿瘤的侵袭调控机制
β-连环蛋白是一种胞内可溶性的多功能蛋白,其肽链的中部有12~14个由42个氨基酸残基组成的重复序列(称arm区域),该区域可以和多种蛋白受体结合而发挥功能。β-连环蛋白在细胞内存在有两种形式:①游离型,主要存在于细胞浆中,通过与大肠腺瘤样息肉蛋白(Adenomatous polyposis coli,APC)、糖原合成酶激酶-3β(Glycogen synthase kinase-3β,GSK-3β)和轴蛋白(Axin)形成的“破坏复合物”结合后,被GSK-3β和酪蛋白激酶1α(Casein kinase 1,CK1α)磷酸化,进而泛素化被蛋白水解酶降解,从而使其在细胞浆中维持一个较低的水平;②结合型,β-连环蛋白由胞浆转移至细胞膜下和E-cadherin形成复合体,参与细胞之间的粘附[3]。
研究表明,E-cadherin表达的变化可引起黑色素瘤细胞与环境的相互作用,并改变β-catenin信号。表皮中E-cadherin表达于黑色素细胞和表皮角质形成细胞上,使两者紧密联系[4]。黑色素细胞与基底细胞层未分化的表皮细胞接触,可抑制黑色素细胞增殖,抑制其表达黑色素瘤标记物,以及导致黑色素细胞产生更多树突[5]。另外,通过刺激β-catenin的信号通路,E-cadherin的表达可增加黑色素瘤生存能力[6]。
E-cadherin是参与细胞之间粘附连接的主要分子,发挥着维持细胞极性和结构完整性的功能。它的抑癌作用主要是通过与β-连环蛋白形成复合体介导同质细胞之间的相互粘附,抑制肿瘤细胞的迁移和侵袭性,同时E-cadherin竞争性和β-连环蛋白结合,降低细胞内游离型β-连环蛋白水平,从而抑制其参与Wnt信号通路细胞增殖基因的表达。E-cadherin复合体中无论钙粘蛋白本身或其组分的异常变化都可能引起细胞之间的粘附能力减弱以及肿瘤细胞的运动能力增强,从而导致细胞容易脱离、侵袭和转移[7]。
E-cadherin复合体功能异常可能通过以下几个环节参与皮肤肿瘤侵袭转移的调控。①基因突变:是引起蛋白表达水平改变和功能障碍的主要机制之一。多种消化道恶性肿瘤的研究报道,E-cadherin基因的点突变、缺失均可导致E-cadherin表达水平的下调和功能结合区域的改变,从而引起细胞之间连接疏松[8]。β-catenin基因突变能稳定β-catenin蛋白[9]或增加其核内聚集[10]。核内β-catenin的水平增加可使MITF及CCND1表达上升,激活异常的Wnt信号通路,影响其参与的粘附功能,从而促进黑色素瘤细胞增值和扩散[11]。②基因转录抑制:是E-cadherin表达下调的重要机制。E-cadherin启动子区域存在的E-box含有保守的5′-CACCTG序列,该序列为helix-loop-helix(HLH)转录因子家族的结合位点。在上皮肿瘤细胞中,当E-cadherin基因启动子的E-box结合转录抑制因子后可下调E-cadherin的表达。 这些转录抑制因子有 Slug[12]、Twist[13]、Snail和ZEB[14]等。此外,这些转录抑制因子和C D H 1基因的启动子结合,能够诱导上皮细胞向间质细胞表型的转化(Epithelial-mesenchymal transition,EMT),同时伴随E-cadherin向N-cadherin转化,使肿瘤细胞获得侵袭的能力[15]。③磷酸化:当E-cadherin和β-连环蛋白发生异常磷酸化时将改变其分子的带电性和(或)分子的空间构象,影响复合体的正常形成和功能[3]。关于黑色素瘤的研究显示,在Wnt信号途径中,WNTs分泌蛋白对神经嵴细胞,特别是黑色素细胞的发展有重要作用。WNT蛋白与及其受体结合,可灭活磷酸化β-catenin的GSK-3β激酶[16]。被酪氨酸磷酸化的β-catenin和E-cadherin失去联系,βcatenin转运至细胞核内,与T细胞因子/淋巴细胞增强 因 子 (T cell factor/lymphoid enhancer factor,Tcf/LEF)结合,参与细胞内基因的表达,引起细胞的增殖。但磷酸化的β-连环蛋白进入细胞核后,虽能与TcF/LEF相互作用,却不能和DNA结合,无法启动相应靶基因的转录。④细胞内异常分布:有报道显示,E-cadherin表达较高的肿瘤仍具有较高的侵袭转移能力,细胞内异常分布可能是原因之一[17]。β-连环蛋白在细胞膜和细胞核具有不同的生物功能,应用免疫组化方法对多数恶性肿瘤的研究结果大都显示β-连环蛋白的细胞内异常分布,如细胞膜上分布减少,出现核内的聚集[18]。⑤其他影响因素:磷酸化、糖基化、调节蛋白,如p120-catenin等。
E-cadherin复合体表达下调或/和功能丧失与皮肤肿瘤的分化、侵袭转移和预后密切相关。对上皮型钙粘蛋白和β-连环蛋白在皮肤肿瘤中的表达和动态平衡的研究,有助于更好地理解肿瘤细胞与角质形成细胞、成纤维细胞、血管内皮细胞和其周围微环境的联系,侵袭和转移的机制[3]。
3.3 HER-2与肿瘤侵袭的其他通路
HER-2蛋白是一种由原癌基因HER-2/neu编码的跨膜糖蛋白,由胞外区、跨膜区及胞内区构成。原癌基因HER-2/neu对于调节正常细胞的生长与分化是必须的,同时还与多条信号转导通路相关联[19]。HER-2可通过Ras/MAPK途经使转录因子ER81磷酸化,活化的ER81则直接与MMP-2启动子区结合而促进其转录。在转移潜能较高的HER-2阳性乳腺癌细胞中,HER-2能增强白明胶酶的表达[20]。白明胶酶(Gelatinases)属于基质金属蛋白酶(Matrix metal-loproteinase,MMP,包括 MMP-2 和 MMP-9),是MMP家族中锌依赖的内肽酶,能降解基底膜的主要成分Ⅳ型胶原,与肿瘤的浸润、转移密切相关。
细胞外基质(Extracellular matrix,ECM)的降解是浸润的重要起始之一。ECM降解后,HER-2可通过降低肿瘤细胞间的黏附作用,促进肿瘤细胞的浸润转移。激活的HER-2可磷酸化粘附分子βcatenin,后者通过裂解E-cadherin复合体,增强Wnt信号传导,可促进乳腺癌细胞的增殖和侵袭[21]。
HER-2还可通过促进Fnl4(Fibroblast growth factor-inducible 14)的表达[22]和增强肿瘤细胞对乙醇的敏感性等途径增强肿瘤细胞的浸润作用[23]。另外,在过表达HER-2的肿瘤中,表面热休克蛋白90(Heat shock protein 90,HSP90)在肿瘤细胞的浸润中起着重要作用。HSP90作为一种分子伴侣,参与各种蛋白的折叠、组装、细胞内定位和蛋白质水解。HSP90结合HER-2胞内段时,可稳定HER-2的结构。运用特异抗HSP90的单克隆抗体(Monoclonal antibody,mAb)4C5阻断HSP90与HER-2的结合,可抑制肿瘤浸润[24]。
综上所述,E-cadherin、β-catenin 和 HER-2 在皮肤肿瘤中的表达是评估肿瘤侵袭性的重要指标,对于临床治疗具有指导性意义。本实验结果提示,正常皮肤及SK皮肤表皮细胞高表达E-cadherin和β-catenin,而恶性肿瘤中两者的表达下降并与肿瘤的恶性程度(侵袭性)相关,HER-2的表达水平与肿瘤的侵袭性呈正相关。
皮肤恶性肿瘤的首选治疗方法是手术切除。因此,切除范围和切除后创面修复方法的选择,必须考虑肿瘤的侵袭性。恶性程度相对较低的肿瘤,其扩大切除的范围较小,一般选择距离肿瘤边缘0.5 cm确定切缘,也可以通过Mohs显微切除的方法进行。涉及面部等部位需考虑美容需求,一般考虑以皮瓣进行修复。对于具有较高侵袭性的肿瘤,如SCC和恶性黑色素瘤等,则扩大切除的范围应增加到2~3 cm,其扩大切除后创面修复方法的选择需视具体情况而定。运用皮瓣方法进行修复具有诸多优点,修复后的外观、弹性、质地以及功能恢复等均较佳。但是,有学者认为皮瓣修复将掩盖肿瘤的复发,不利于早期发现,而且手术过程会导致肿瘤细胞种植转移,因此主张进行皮肤移植修复。因此,我们需要术前对肿瘤的侵袭性进行评估,综合手术部位、功能重建和美容需求等因素来选择手术方案。
相同病理类型的恶性肿瘤,其表现与转归是不尽相同的,重要因素之一就是肿瘤的侵袭性。如果术前经过肿瘤活检能够确定病理诊断,同时通过E-cadherin、β-catenin和HER-2在皮肤肿瘤中的表达来对其侵袭性进行分级,对于手术方案的选择以及改善患者的预后是有实际意义的。我们将通过扩大样本量和长期随访等方法,进行更为深入的研究。
[1]Haass NK,Herlyn M.Normal human melanocyte homeostasis as a paradigm for understanding melanoma[J].J Investig Dermatol Symp Proc,2005,10(2):153-163.
[2]Herlyn M,Berking C,Li G,et al.Lessons from melanocyte development for understanding the biological events in naevus and melanoma formation[J].Melanoma Res,2000,10(4):303-312.
[3]Wang H,Zhou Q.E-cadherin/beta-catenin and the invasion and metastasis of lung cancer[J].Zhongguo Fei Ai Za Zhi.2010,13(3):254-259.
[4]Widlund HR,Horstmann MA,Price ER,et al.Beta-catenin-induced melanoma growth requires the downstream target Microphthalmiaassociated transcription factor[J].J Cell Biol 2002;158(6):1079-1087.
[5]Shtutman M,Zhurinsky J,Simcha I,et al.The cyclin D1 gene is a target of the beta-catenin/LEF-1 pathway[J].Proc Natl Acad Sci U S A,1999,96:5522-5527.
[6]Gottardi CJ,Wong E,Gumbiner BM.E-cadherin suppresses cellular transformation by inhibiting beta-catenin signaling in an adhesionindependent manner[J].J Cell Biol,2001,153(5):1049-1060.
[7]Takahashi Y,Nishikawa M,Suehara T,et al.Gene silencing of β-catenin in melanoma cells retards their growth but promotes the formation of pulmonary metastasis in mice[J].Int J Cancer,2008,123(10):2315-2320.
[8]Becker KF,Atkinson MJ,Reich U,et al.E-cadherin gene mutation provides clues to diffuse type gastric carcinomas[J].Cancer Res,1994,54(14):3845-3852.
[9]Rubinfeld B,Robbins P,El-Gamil M,et al.Stabilization of betacatenin by genetic defects in melanoma cell lines[J].Science,1997,275:1790-1792.
[10]Cowley GP,Smith ME.Cadherin expression in melanocytic naevi and malignant melanomas[J].J Pathol,1996;179(2):183-187.
[11]Sanders DS,Blessing K,Hassan GA,et al.Alterations in cadherin and catenin expression during the biological progression of melanocytic tumours[J].Mol Pathol,1999;52(3):151-157.
[12]Shih JY,Tsai MF,Chang TH,et al.Transcription repressor slug promotes carcinoma invasion and predicts outcome of patients with lung adenocarcinoma[J].Clin Cancer Res,2005,11(22):8070-8078.
[13]Yang J,Mani SA,Donaher JL,et al.Twist,a master regulator of morphogenesis,plays an essential role in tumor metastasis[J].Cell,2004,117(7):927-939.
[14]Chinnadurai G.CtBP,an unconventional transcriptional corepressor in development and oncogenesis[J].Mol Cell,2002,2(9):213-224.
[15]Bolós V,Peinado H,Pérez-Moreno MA,et al.The transcription factor Slug represses E-cadherin expression and induces epithelial to mesenchymal transitions:a comparison with Snail and E47 repressors[J].J Cell Sci,2003,116(Pt 3):499-511.
[16]Bienz M.Beta-catenin:a pivot between cell adhesion and Wnt signalling[J].Curr Biol,2005,15(2):R64-67.
[17]Rodríguez-Sastre MA,González-Maya L,Delgado R,et al.Abnormal distribution of E-cadherin and beta-catenin in different histologic types of cancer of the uterine cervix[J].Gynecol Oncol,2005,97(2):330-336.
[18]Nakopoulou L,Mylona E,Papadaki I,et al.Study of phospho-betacatenin subcellular distribution in invasive breast carcinomas in relation to their phenotype and the clinical outcome[J].Mod Pathol,2006,19(4):556-563.
[19]Schechter AL,Stern DF,Vaidyanathan L,et a1.The neu oncogene:an erb-B-related gene encoding a 185,000-Mr tumour antigen[J].Nature,1984,312(5994):513-516.
[20]Pellikainen JM,Ropponen KM,Kataja VV,et al.Expression of matrix metalloproteinase(MMP)-2 and MMP-9 in breast cancer with a special reference to activator protein-2,HER-2,and prognosis[J].Clin Cancer Res,2004,10(22):7621-7628.
[21]Wang K,Ma Q,Ren Y,et al.Geldanamycin destabilizes HER-2 tyrosine kinase and suppresses Wnt/beta-catenin signaling in HER-2 overexpressing human breast cancer cells[J].Oncol Rep,2007,17(1):89-96.
[22]Kleer CG,van Golden KL,Braun T,et a1.Persistent E-cadherin expression in inflammatory breast cancer[J].Mod Pathol,2001,14(5):458-464.
[23]Willis AL,Tran NL,Chatigny JM,et al.The fibroblast growth factor-inducible 14 receptor is highly expressed in HER-2-positive breast tumors and regulates breast cancer cell invasive capacity[J].Mof Cancer Res,2008,6(5):725-734.
[24]Sidera K,Gaitanou M,Stellas D,et al.A critical role for HSP90 in cancer cell invasion involves interaction with the extracellular domain of HER-2[J].J Biol Chem,2008,283(4):2031-2041.
Expression of E-cadherin,β-catenin and HER-2 in Manignent Skin Tumor
SHAO Zheren1,JIANG Fangzheng1,MAN Xiaoyong2,BAO Qi1,WANG Lu1,QIAN Huan1,HU Xueqing1.1 Department of Plastic Surgery;2 Department of,The Second Hospital of Zhejiang University School of Medicine,Zhejiang 310009,China.
ObjectiveTo instruct the extent of extended resection and choose the proper method of wound reparation after tumor removal through the assessment of tumor invasiveness.MethodsFour kinds of pathological specimens including normal skin,seborrheic keratosis,basal cell carcinoma and squamous cell carcinoma were used in this study.After paraffinembedded serial sections of all the specimens,immunofluorescent staining of E-cadherin,β-catenin,and HER-2 are carried out to observe the staining results in order to evaluate tumor invasiveness of different pathological types.ResultsThe expression of E-cadherin and β-catenin is higher in epidermal cells of the normal skin and seborrheic keratosis but decreased in that of basal cell carcinoma and squamous cell carcinoma.HER-2 expression in basal cell carcinoma and squamous cell carcinoma is higher than that in normal skin and increased skin SK.ConclusionE-cadherin,β-catenin,and HER-2 expression in skin tumors is an important indicator in the assessment of tumor invasiveness which plays a role in guiding clinical surgical treatment.
Skin Tumor;Tumor Invasiveness;E-cadherin;β-catenin;HER-2
R739.5
A
1673-0364(2012)05-0264-05
10.3969/j.issn.1673-0364.2012.05.005
浙江省教育厅科研计划项目(ZC200805548)。
310009 浙江省杭州市 浙江大学医学院附属第二医院整形外科(邵哲人,姜方震,包祺,王璐,钱欢,胡学庆);皮肤科(满孝勇)。
2012年8月16日;
2012年9月11日)

