IVF-ET术后流产患者绒毛和蜕膜组织凋亡及相关调控蛋白的表达
张先霞,王繁
(温州医学院,浙江 温州 325035,1.第二临床医学院;2附属第二医院 妇产科)
IVF-ET术后流产患者绒毛和蜕膜组织凋亡及相关调控蛋白的表达
张先霞1,王繁2
(温州医学院,浙江 温州 325035,1.第二临床医学院;2附属第二医院 妇产科)
目的:检测体外受精-胚胎移植(IVF-ET)术后早期自然流产患者绒毛和蜕膜组织凋亡及相关调控蛋白血管内皮生长因子(VEGF)、Bcl-2的表达,探讨其发病和基因调控机制。方法:采用免疫组织化学染色技术检测IVF-ET术后早期自然流产者(IVF-ET组)绒毛及蜕膜组织Bcl-2、VEGF的表达水平,并以同期正常早孕者(正常早孕组)的标本为对照。结果:VEGF主要表达于绒毛滋养细胞和血管内皮细胞胞浆。IVF-ET组VEGF表达明显低于正常早孕组,差异具有统计学意义(P<0.05)。Bcl-2主要在绒毛合体滋养细胞上表达。IVF-ET组滋养细胞及蜕膜细胞染色较浅,表达呈弱阳性,正常早孕组染色较深,表达强阳性,差异有统计学意义(P<O.05)。结论:IVF-ET术后早期自然流产者绒毛及蜕膜组织中VEGF及Bcl-2表达显著降低,提示早期妊娠中VEGF及Bcl-2的低表达可能是导致IVF-ET术后早期自然流产的原因之一。
血管内皮生长因子;Bcl-2;绒毛膜绒毛;蜕膜;体外受精-胚胎移植术;流产,自然
体外受精-胚胎移植(in vitro fertilization-embryo transfer,IVF-ET)作为人类辅助生殖中的重要技术,已成为不孕不育症的理想治疗措施之一。尽管IVF-ET技术水平逐渐提高,其分娩率目前仍只为22.8%~47.8%[1],而自然妊娠后的分娩率为80%~90%[2],因此对IVF-ET术后高流产率的研究具有重要的临床意义。目前国内有少量关于自然流产者绒毛及蜕膜组织中细胞周期和凋亡的研究报道,但IVF-ET术后自然流产患者绒毛及蜕膜组织中细胞凋亡及相关调控蛋白的表达情况国内外鲜见报道。我们通过常规组织切片及免疫组织化学染色观察IVF-ET术后自然流产及正常早孕者绒毛及蜕膜组织结构的形态学变化,检测和分析凋亡及相关调控蛋白血管内皮生长因子(vascular endothelial cell growth factor,VEGF)、Bcl-2的表达差异,探讨IVF-ET术后自然流产的发病和基因调控机制。
1 材料和方法
1.1 研究对象
1.1.1 IVF-ET组:选取2010年6月至2011年9月在温州医学院附属第二医院妇产科实施IVF-ET助孕术后无明显诱因出现自然流产的患者30例,年龄25~40岁,平均(28.92±3.23)岁,孕4~9周,平均(7.42±1.39)周。B超提示胚囊未见胚芽或未见原始心管搏动而确认为胚胎停育。流产后取绒毛及蜕膜组织。
1.1.2 正常早孕组: 选择同期自愿实施人工流产术的女性30例,年龄20~35岁,平均(27.07±3.91)岁,孕4~10周,平均(7.17 4±1.23)周。B超证实为宫内妊娠且符合孕周,可见胚芽及原始心管搏动。流产术后取绒毛及蜕膜组织。
所有研究对象均身体健康,无自身免疫、内分泌疾病,无生殖系统畸形、肿瘤和感染。月经规律(月经周期为28~30 d),3个月内未服用甾体类药物及抗早孕药物,未放置宫内节育器。同时男方精液正常,夫妇染色体核型正常。两组间年龄、孕周以及以往流产次数进行比较,差异均无统计学意义(P>0.05)。
1.2 方法
1.2.1 标本采集与处理:高压消毒并用焦碳酸二乙酯(DEPC)水处理收集标本所需的器皿及工具,于吸宫术后找出绒毛及蜕膜组织各5 g(约 2.0 cm×2.0 cm大小),用4 ℃ 0.9%氯化钠溶液洗净。标本置10%中性甲醛液中固定。送实验室取材石蜡包埋切片,常规染色病理组织学观察。
1.2.2 免疫组织化学染色:鼠抗人VEGF单克隆抗体和鼠抗人Bcl-2单克隆抗体工作液购自福建迈新和北京中杉生物公司。采用免疫组织化学技术Envision二步法,实验步骤按试剂盒说明书进行,最后经DAB显色,苏木素复染。用已知阳性片作阳性对照,以PBS代替一抗作阴性对照。
1.3 结果判定 由2名病理科医师独立观察切片中10个高倍视野(×400)。
Bcl-2阳性标准:Bcl-2定位于胞浆和胞膜内,表达阳性信号为棕黄色。根据显色程度分为4级:<10%或无着色为(-);10%~25%,淡黄色为(+);25%~40%,棕黄色为(++);>40%,棕褐色为(+++)。
VEGF阳性标准:VEGF定位于胞浆,表达阳性信号为棕黄色。按阳性细胞占总细胞的百分比分为4级:<5%为阴性(-);5%~25%为阳性(+);25%~50%为中度阳性(++);>50%为强阳性(+++)。阳性率统计以(++)及以上为标准。
1.4 统计学处理方法 统计软件采用SPSS11.0软件包。率的比较用x2检验,P<0.05为差异具有统计学意义。
2 结果
2.1 病理组织学观察 IVF-ET组:绒毛结构完整,少数绒毛水肿,部分绒毛间质轻度黏液变,部分见中央水池样改变,合体滋养细胞及细胞滋养细胞增生不明显;内膜腺体部分见分泌反应,腺体中度扩张,细胞单层排列,立方形或低柱状,未见明显AS现象;蜕膜细胞发育不完全,细胞质少,细胞平铺但嵌合不良,部分细胞核不规则;间质炎性细胞浸润较多,血管扩张充血。
正常早孕组:绒毛结构完整,少数绒毛水肿,间质轻度黏液变,未见中央水池样改变,合体滋养细胞及细胞滋养细胞明显增生,以细胞滋养细胞为主;内膜腺体扩大弯曲,腺腔扩张,内有分泌物,腺上皮细胞透亮,胞质丰富,呈簇状突起,A-S反应明显;蜕膜细胞肥硕,细胞平铺,胞质丰富,相互嵌紧呈砖砌状排列,核卵圆形,居中;间质炎性细胞少量浸润,血管扩张充血。
2.2 VEGF在绒毛及蜕膜组织中的表达与分布 VEGF主要表达于细胞胞浆中。在IVF-ET组:合体滋养细胞与部分细胞滋养细胞均可见表达,阳性率为67%;绒毛间质细胞和血管内皮细胞表达显著,几乎全部表达;蜕膜细胞部分表达,浅表层蜕膜细胞阳性较明显,底层表达弱阳性。在正常早孕组:合体滋养细胞和细胞滋养细胞阳性表达率高,达90%,个别细胞滋养细胞未见表达,染色程度较IVF-ET组强;绒毛间质细胞和血管内皮细胞均见强阳性表达;蜕膜细胞全层表达,染色强度深浅不一;腺体也表达。见图1-4。IVF-ET组与正常早孕组比较,差异有统计学意义(P<O.05),见表1。
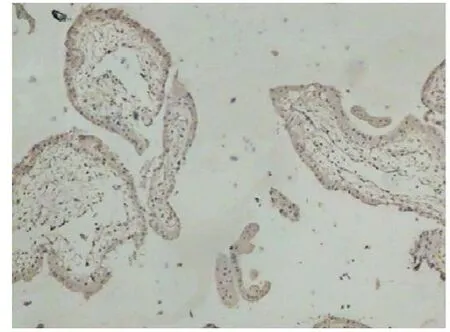
图1 VEGF在IVF-ET组绒毛中的表达(×200)

图2 VEGF在正常早孕组绒毛中的表达(×200)
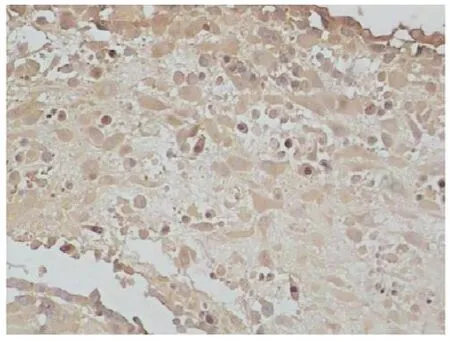
图3 VEGF在IVF-ET组蜕膜中的表达(×200)

图4 VEGF在正常早孕组蜕膜中的表达(×200)

表1 VEGF在两组绒毛及蜕膜组织中的表达(n=30)
2.3 Bcl-2在绒毛与蜕膜组织中的表达与分布 Bcl-2主要在绒毛及蜕膜细胞胞浆及胞膜上表达。两组均有明确表达。IVF-ET组:多表达在绒毛外围合体滋养细胞,围绕绒毛表达,细胞滋养细胞染色浅或不着色,表达弱阳性;蜕膜细胞表达弱阳性(见图5-6)。正常早孕组:表达部位与IVF-ET组相同,但滋养细胞和蜕膜细胞染色深,表达强阳性(见图7-8)。IVF-ET组与正常早孕组比较,差异有统计学意义(P<O.05),见表2。
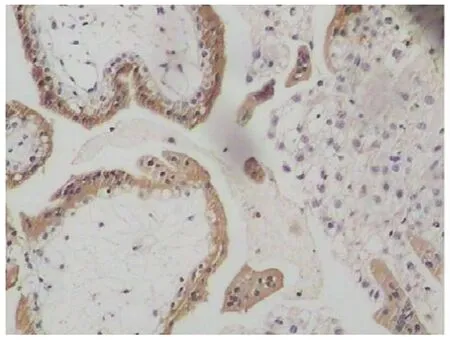
图5 Bcl-2在IVF-ET组绒毛中的表达(×200)
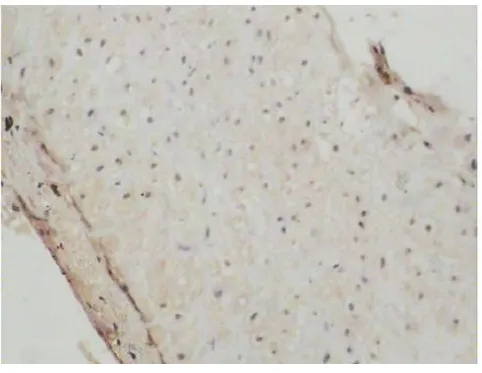
图6 Bcl-2在IVF-ET组蜕膜中的表达(×200)

图7 Bcl-2在正常早孕组绒毛中的表达(×200)

图8 Bcl-2在正常早孕组蜕膜中的表达(×200)

表2 Bcl-2在两组绒毛与蜕膜组织中的表达(n=30)
3 讨论
3.1 绒毛及蜕膜细胞组织学改变 为更好地适应胎儿的需要,胎盘通过蜕膜细胞及滋养层细胞的增殖与凋亡不断进行组织结构的改建,以达到相对稳定状态维持妊娠。合体细胞的凋亡增加可能影响胎盘的功能,抑制血管的发生,引起供血不足。蜕膜提供胚胎发育以营养支持, 来保护胚胎不受母亲的免疫反应并调整滋养层侵入子宫基质的深度[3]。若这种平衡状态被打破,将导致自然流产的发生。本研究比较了IVF-ET术后流产者与正常早孕者绒毛及蜕膜组织的病理组织学改变,发现两组间绒毛及蜕膜细胞结构及形态有明显不同。在IVF-ET组中绒毛滋养细胞增生不明显,腺体小,分泌反应低;蜕膜细胞发育不完全,细胞间嵌合不良。而正常早孕组,绒毛滋养细胞增生明显,腺体高度分泌反应,A-S现象多见;蜕膜细胞肥硕,细胞嵌合紧密。提示IVFET术后流产者可能存在某些机制,导致绒毛及蜕膜细胞结构及形态改变,细胞发育障碍,最终导致流产的发生。
3.2 VEGF在IVF-ET术后流产患者绒毛及蜕膜组织中表达下降的意义 VEGF和血管内皮细胞的特异性受体结合,具有强大的促内皮增殖、促血管生成作用。Hickey等[4]指出,血管生成对于人类子宫内膜的增殖和分化、胚胎植入以及妊娠维持十分重要。VEGF在受精卵着床过程中发挥重要作用,并参与整个妊娠期间胎盘生长过程的血管形成,妊娠妇女血中VEGF水平较非妊娠妇女有明显的升高,且孕中期时达到高峰。因此血管的新生和血管化是构建蜕膜毛细血管网以及胚胎生长发育的基础。VEGF单一等位基因的丢失或变异可导致胚胎在发育早期因血管异常而死亡[5]。Al-Khateeb等[6]研究173例早期习惯性流产患者发现,与正常早孕妇女相比,习惯性流产患者血清VEGF浓度明显降低,说明VEGF表达下降使血管生成障碍,最终导致胚胎难以植入。Sherer等[7]和Kaloglu等[8]的动物实验也证明了这一点。
本研究通过检测IVF-ET术后早期流产者和正常早孕者绒毛及蜕膜组织中VEGF的相对表达量的差异,探讨VEGF表达情况与妊娠失败的关系。结果显示,VEGF在正常早孕者的蜕膜及绒毛组织中表达量相对较高,而在IVF-ET术后早期流产者的绒毛及蜕膜中表达量较低。这说明一定水平的VEGF的表达对妊娠的维持具有保护作用,而在妊娠早期滋养细胞向子宫肌层侵入的关键时期,VEGF表达下降可能导致滋养细胞血管化不足,细胞过度凋亡而发生不可避免流产。因此,我们认为在保胎治疗中,先兆流产妇女补充外源性VEGF可能有利于维持妊娠,减少流产的发生。
3.3 Bcl-2与细胞凋亡 Bcl-2是Bcl-2基因家族中重要的细胞凋亡抑制基因,其功能主要是抑制细胞凋亡,延长细胞寿命,而不影响细胞周期和分化。Bcl-2蛋白家族是调节凋亡的中心,对组织正常的生长和细胞的动态平衡有着关键的作用[9]。对正常凋亡信号反应的改变是癌症的标志,故以往对Bcl-2蛋白的研究多集中在癌症方面。而妊娠早期,胚胎植入后,滋养层侵袭子宫内膜,这个侵袭的过程类似肿瘤侵润性生长的过程。我们研究发现,Bcl-2主要在早期绒毛合体滋养细胞及蜕膜细胞胞浆及胞膜上表达,而在细胞滋养细胞表达较低。分析原因可能为合体滋养细胞作为执行功能的分化终末细胞,凋亡的发生是其必然结局,故其量较细胞滋养细胞高。在IVF-ET组绒毛染色浅或不着色,蜕膜细胞表达弱阳性,而正常早孕组合体滋养细胞和蜕膜细胞染色均较深,表达呈强阳性,IVF-ET组阳性率明显低于正常早孕组,提示Bcl-2在抑制合体滋养细胞凋亡方面发挥重要作用,Bcl-2表达下降引起合体滋养细胞凋亡增加,所致胎盘屏障通透性的增加可能在流产的发生中发挥了重要的作用。
综上所述,VEGF表达异常,导致IVF-ET术后胎盘的血管发育不良供血不足,Bcl-2表达下降,导致细胞凋亡失衡,影响滋养细胞分化、浸润,以上两者最终影响胎儿和(或)胎盘的发育,导致流产的发生。至于两者之间的相关性,有待进一步研究。
[1] Malizia BA, Hacker MR, Penzias AS. Cumulative live-birth
rates after in vitro fertilization[J]. N Engl J Med, 2009, 360(3):236-243.
[2] 乐杰. 妇产科学[M]. 7版. 北京:人民卫生出版社, 2008:83-86.
[3] Plaisier M, Dennert I, Rost E, et al. Decidual vascularization and the expression of angiogenic growth factors and proteases in first trimester spontaneous abortions[J]. Hum Reprod, 2009, 24(1):185-197.
[4] Hickey M, Fraser IS. The structure of endometrial microvessels[J]. Hum Reprod, 2000, 15(3):57-66.
[5] Kashida S, Sugino N, Takiguchi S, et al. Regulation and role of vascular endothelial growth factor in the corpus luteum during mid-pregnancy in rats[J]. Biol Reprod, 2001, 64(1):317-323.
[6] Al-Khateeb GM, Mustafa FE, Sater MS, et al. Effect of the functional VEGFA-583C/T variant on vascular endothelial growth factor levels and the risk of recurrent spontaneous miscarriage[J]. Fertil Steril, 2011, 95(8):2471-2473.
[7] Sherer DM, Abulafia O. Angiogenesis during implantation and placental and early embryonic development[J]. Placenta,2001, 22(1):1-13.
[8] Kaloglu C, Bulut HE. Vascular endothelial growth factor production by rat granulated metrial gland cells and their morphological features in normal and pathological conditions[J]. Reprod Fertil Dev, 2007, 19(2):341-350.
[9] Bajwa N, Liao C, Nikolovska-Coleska Z. Inhibitors of the anti-apoptotic Bcl-2 proteins:a patent review[J]. Expert Opin Ther Pat, 2012, 22(1):37-55.
Human chorionic villi and deciduas apoptosis and related modulin expression of IVF-ET failure
ZHANG Xianxia*,WANG Fan.*The Second Clinical Medical Institute of Wenzhou Medical College,Wenzhou,325035
Objective:To investigate the human chorionic villi and deciduas apoptosis and related regulatory protein(VEGF,Bcl-2)expression in early spontaneous abortion after treatment of in vitro fertilization-embryo transfer(IVF-ET)and explore the pathomechanism of spontaneous abortion.Methods:The expression of VEGF and Bcl-2 in the chorionic villi and deciduas was detected and analyzed in 30 cases of early spontaneous abortion patients after in vitro fertilization-embryo transfer(IVF-ET)through immunohistochemisty method,Thirty cases of normal early pregnancy as control.Results:Immunohistochemistry displayed that VEGF mainly expressed in cytoplasm of villi trophocyte and vascular endothelial cell. The VEGF level of early spontaneous abortion after IVF-ET group was significantly lower than that of normal early pregnancy group(P<0.05). Bcl-2 mainly expressed in the villi syncytiotrophoblast.Trophoblasts and decidual staining were shallow and weakly positive in early spontaneous abortion after IVF-ET group. But trophoblasts and decidual of normal early pregnancy group were deeply stained,the expression was strong positive. Difference between two groups was significant(P<0.05).Conclusion:The expression of VEGF and Bcl-2 decreases significantly in both chorionic villi and deciduas of early spontaneous abortion after IVF-ET. We speculate that the reduction of the expression of VEGF and Bcl-2 in the deciduas and chorionic villi in early gestation stage may cause abortion.
VEGF;Bcl-2;chorionic villi;deciduas;IVF-ET;abortion,spontaneous
R71
A
1000-2138(2012)06-0545-04
2012-05-15
浙江省大学生科技创新活动计划(新苗人才计划)项目(2010R413028)。
张先霞(1988-),女,浙江新昌人,本科生。
王繁,副主任医师,Email:wangfan7510@sohu.com。
丁敏娇)
·论 著·

