饲料粗蛋白含量对刺参消化酶及消化道结构的影响
吴永恒, 王秋月, 冯政夫, 李彬斌, 朱 伟
(青岛农业大学 生命科学学院, 山东 青岛 266109)
饲料粗蛋白含量对刺参消化酶及消化道结构的影响
吴永恒, 王秋月, 冯政夫, 李彬斌, 朱 伟
(青岛农业大学 生命科学学院, 山东 青岛 266109)
本实验以鱼粉、酪蛋白以及藻粉等为主要原料配制了粗蛋白质量分数为12%、16%、20%、24%、28%、32%的6种半精制刺参(Apostichopus japonicus)饲料, 研究饲料中粗蛋白含量对刺参生长、蛋白酶和淀粉酶活性以及肠道结构的影响。结果表明, 刺参饲料中粗蛋白含量对刺参的生长、饲料系数、蛋白质效率以及消化道中蛋白酶和淀粉酶活性都有明显影响, 肠道蛋白酶和淀粉酶活性对饲料粗蛋白含量有适应性, 随饲养时间也有适应性变化。饲料中粗蛋白含量对刺参肠道结构也有一定的影响。
刺参(Apostichopus japonicus); 粗蛋白; 蛋白酶; 淀粉酶
蛋白质是水产动物重要的营养物质, 水产动物的生长速度与其所摄食饲料的粗蛋白含量有密切关系, 而对消化酶活性的研究有助于更准确地掌握水产动物对饲料中蛋白质的需求量, 并且更有助于探讨饲料中粗蛋白含量与消化酶活性的关系。
对刺参(Apostichopus japonicus)蛋白质营养及消化生理的研究尚处于初步阶段。朱伟等[1]通过饲养实验确定了刺参稚参饲料中的最适粗蛋白含量为18.21%~24.18%, 粗脂肪的适宜含量为 3%~5%, 为刺参人工配合饲料的研究提供了理论依据。刺参体内存在多种蛋白酶, 不同部位蛋白酶的活性也有所差异, 且随着季节而变化, 尤其水温的变化, 刺参的消化道形态和消化道内消化酶的活性有显著的变化,夏季刺参进入“夏眠”之后, 消化道变短、薄而细, 消化酶活性下降[2-3]。不同发育阶段刺参蛋白酶的活性也存在较大差异, 且蛋白酶活性与淀粉酶活性的比值反映出其食性的转换[4]。刺参的食性在发育过程中是不断变化的, 对刺参蛋白酶和淀粉酶活性随饲料中营养含量变化的研究有助于观察刺参对饲料中营养物质的消化吸收情况及其对营养物质的需求状况。作者对刺参消化道内的蛋白酶和淀粉酶活性与饲料中粗蛋白含量及刺参生长情况的关系进行了研究。
1 材料与方法
1.1 实验饲料
实验饲料以鱼粉、酪蛋白、酵母粉、马尾藻粉、麦麸、精炼鱼油、混合矿物质与混合维生素等为原料配制。以酪蛋白调节饲料中粗蛋白的含量, 共设计了6个粗蛋白水平, 分别为12%、16%、20%、24%、28%、32%, 见表1。将饲料原料混匀后加适量水搅拌, 经挤条机制成1.5 mm细条, 在60℃条件下烘干,至水分为 8.92%~9.15%, 然后粉碎成 120目颗粒待用。
1.2 饲养实验
实验在山东省青岛市平度养殖实验基地进行。实验用刺参平均体质量 2.5g。海水盐度为 30‰, 水温为 16℃±1℃。饲养期间连续充气, 水温控制在17℃±0.5℃, pH 7.8~8.2, 溶解氧不低于 5 mg/L,NH4+的质量浓度为0.038~0.070 mg/L。
实验刺参共分为 6组, 每组投喂不同粗蛋白含量的饲料, 在养殖期间收集粪便, 每 10天随机抽取实验海参8头测定刺参体内蛋白酶、淀粉酶活性。
1.3 生长指标的测定
增重率(%) = 净增重/试验初重×100%;
饲料系数 = 摄食量/净增重;
蛋白质效率 = 总增重/(摄食量×饲料蛋白质量分数%);
蛋白质利用率(%) = 饲料中蛋白质的量-粪便中蛋白质的量/饲料中粗蛋白的量×100%。
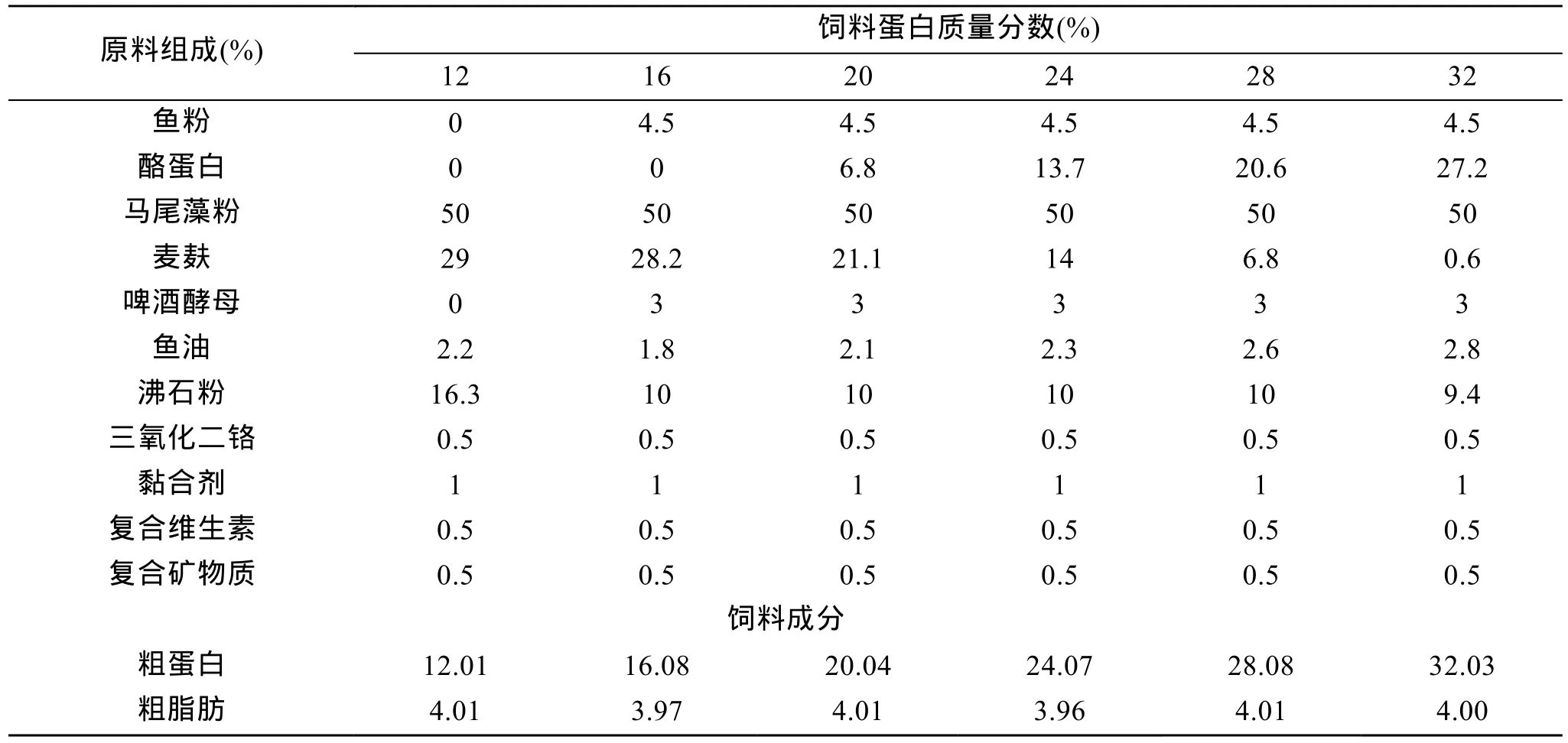
表1 实验基础饲料配方及营养成分Tab. 1 The formulation and nutritional composition of experimental diets
1.4 消化酶活性的测定
刺参取样前, 停食48 h, 使其排空消化道内的食物残渣, 将其放于冰盘内用剪刀沿刺参腹部剪开, 取出消化道, 剔除生殖腺及与消化道末端相连的呼吸树, 用滤纸吸去表面水分, 称重后加入10倍体积预冷的去离子水, 在冰浴条件下用高速匀浆机匀浆 10 min, 然后将匀浆液于高速冷冻离心机中(4℃, 10 000 r/min)低温离心30 min, 上清液即为粗酶液。
淀粉酶活性测定采用淀粉-碘显色法[5]。向试管中加入0.04%可溶性淀粉5 mL, 于37℃水浴中预热5 min, 加入粗酶液1.0 mL, 充分混匀后, 37℃水浴反应7.5 min, 再加入0.01 mol/L碘应用液5.0 mL终止反应, 然后稀释到50 mL立即充分混匀, 660 nm处比色。空白中不加酶液, 其他同测定管。淀粉酶活力单位定义为:pH为7.0, 在(37 ± 1)℃条件下保温30 min,100 mL酶液中的淀粉酶完全水解淀粉10 mg为一个淀粉酶活力单位。
蛋白酶活性采用福林-酚试剂法[6]。向试管中加入0.5%的酪蛋白溶液2.0 mL和pH7.2的磷酸缓冲液4.0 mL, 在40℃下保温5 min, 然后加入粗酶液1.0 mL, 保温20min, 立即加入10%三氯乙酸2.0 mL终止反应。取出常温离心(3 000 r/min)10 min后的上清液1 mL, 加入0.4 mol/L的碳酸钠溶液5.0 mL, 再加入1.0 mol/l的福林试剂1.0 mL, 于40℃恒温水浴中显色20 min, 然后在680 nm波长下比色测定, 对照管在加入粗酶液前加入三氯乙酸使酶失活, 其他同测定管。蛋白酶活力单位定义:在 pH7.2和 40℃下保温20 min, 1 g刺参消化道1 min水解酪蛋白产生1 μg酪氨酸即为1个蛋白酶活力单位。
1.5 组织切片的制作
将实验刺参停食 24 h, 使其排空消化道内的食物残渣, 沿腹中线的右侧解剖, 剔除与消化道末端相连的呼吸树。将肠道组织固定于Bouin’s液中, 常规石蜡连续切片, 切片厚度 5~7μm, H. E染色,Olympus显微镜观察、拍照。
2 结果
2.1 饲料粗蛋白含量对刺参生长及体成分的影响
2.1.1 饲料粗蛋白含量对刺参增重率及体成分的影响
由表2可见, 实验刺参的增重率随饲料中粗蛋白含量的变化而变化。在饲料中粗蛋白质量分数为16%、20%和 24%时, 增重率为分别为 101.98%,98.99%和 88.53%, 三者之间没有明显差异, 但明显高于粗蛋白质量分数为12%的处理(P< 0.05), 而当饲料中粗蛋白含量继续增加时, 实验刺参的增重率则下降, 当饲料粗蛋白质量分数为 28%和 32%时,增重率仅为60.40%和59.62%, 下降的幅度较大。实验刺参体内粗蛋白质量分数为 36.70%~38.39%, 各处理间差异不显著(P> 0.05); 粗灰分质量分数在40%~42%之间, 水分在 92%~93%之间, 各处理间差异均不显著(P> 0.05)。说明饲料中粗蛋白含量对刺参体内粗蛋白、粗灰分和水分含量没有明显影响。实验刺参体内粗脂肪质量分数在 4.7%~6.7%之间,但饲料粗蛋白从 12%到 28%时, 体内粗脂肪含量有下降的趋势, 详见表3。

表2 粗蛋白含量的饲料对刺参幼参生长的影响Tab. 2 Growth performance of Apostichopus japonicas fed the diets containing different protein levels
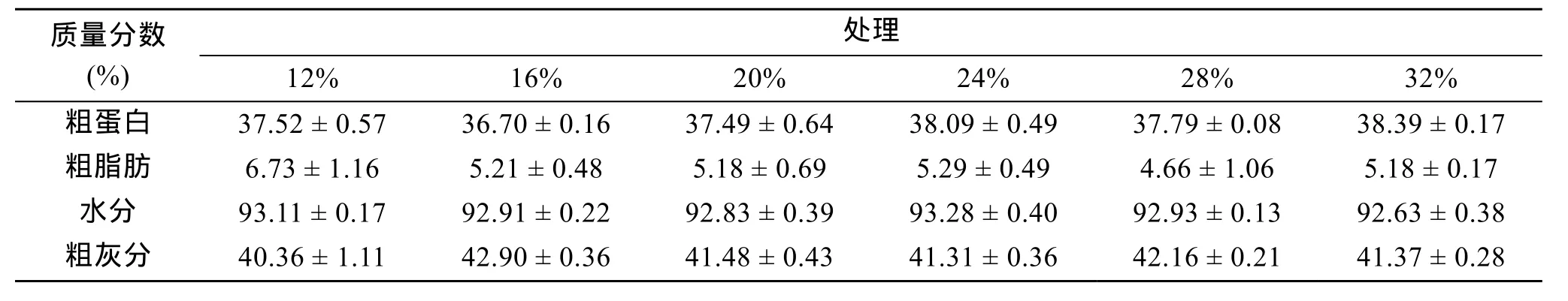
表3 不同蛋白含量饲料饲养后刺参体成分Tab. 3 Nutritional Compositions of Apostichopus japonicas with different protein level of experimental diets
2.1.2 不同粗蛋白含量饲料饲养下的饲料系数及蛋白质效率
在饲料中粗蛋白含量为16%、20%和24%时, 饲料系数分别为0.54, 0.55和0.59, 三者之间无明显差异, 都明显低于其余各处理。当饲料中粗蛋白含量进一步增加时, 饲料系数随之上升。蛋白质效率随粗蛋白含量的变化趋势非常明显, 各处理之间的蛋白质效率有显著差异(P< 0.05)。12%与16%处理的蛋白质效率分别为 12.57%和 11.98%, 无显著差异(P>0.05), 但随着饲料中粗蛋白含量的增加, 显著下降(P< 0.05)。
2.2 饲料中粗蛋白含量对刺参肠道蛋白酶和淀粉酶活性的影响
由图1和图2可以看出, 实验刺参消化道内蛋白酶和淀粉酶的活性明显受到饲料中粗蛋白含量的影响。当饲料中粗蛋白含量由12%增加到16%时, 实验刺参消化道蛋白酶活性明显升高, 由11.64 μg/(g·min)升高到16.02 μg/(g·min)。饲料中粗蛋白含量从16%升高到 24%过程中, 蛋白酶活性无明显变化, 为16.02~18.82 μg/(g·min)。之后, 随着饲料中粗蛋白含量的提高, 蛋白酶活性明显上升, 在饲料粗蛋白含量为 28%时达到最大值, 为 24.71 μg/(g·min)。这说明刺参对饲料中粗蛋白含量具有明显的适应性。实验刺参消化道内淀粉酶的活性也随着饲料中粗蛋白含量的升高, 呈明显上升的趋势。当饲料中粗蛋白含量为12%时, 淀粉酶活性为138.51 mg/(g·min), 当饲料粗蛋白达到 32%时, 淀粉酶活性达到最大值, 为218.38 mg/(g·min)。

图1 粗蛋白含量对刺参蛋白酶活性的影响Fig.1 Effect of crude protein on protease activity in sea cucumbers
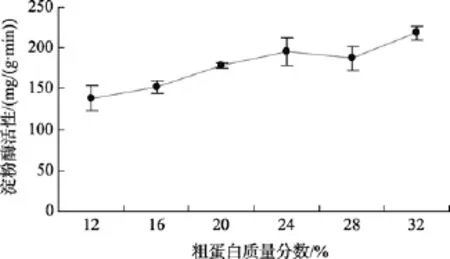
图2 粗蛋白含量对刺参淀粉酶活性的影响Fig.2 Effect of crude protein on amylase activity in sea cucumbers
刺参消化道蛋白酶活性随饲养时间的变化见图3。由图中可见, 各个处理实验刺参的消化道蛋白酶活性在饲养实验过程中的变化基本一致。在饲养实验的前10天, 实验刺参消化道内蛋白酶活性都呈现明显的上升趋势, 之后又逐渐降低, 并在饲养实验进行到 20天时降到最低, 而后略有回升, 并在饲养实验进行至40天的过程中保持比较平稳的水平。在饲养实验 40天至 56天过程中, 蛋白酶活性略有上升。各处理中, 饲料粗蛋白含量为 16%处理的肠道内蛋白酶活性变化幅度最小。由图4可见, 各组实验刺参之间淀粉酶在饲养实验进行中的变化趋势也基本相同。与蛋白酶的变化趋势所不同的是, 在饲养实验初期, 实验刺参消化道内淀粉酶活性明显降低, 并于饲养实验10天时达到淀粉酶活性最低。之后淀粉酶活性显著升高, 并在之后的饲养实验过程中保持相对平稳的变化趋势。饲料中粗蛋白含量16%的实验刺参的淀粉酶活性在饲养实验中变化幅度最小。
2.3 饲料粗蛋白含量对刺参消化道组织结构的影响
刺参的消化道管壁分为 4层:由内到外依次为黏膜层、黏膜下层、肌肉层和浆膜层(图5)[7]。从图5中可以看出, 前肠结缔组织薄, 肠绒毛长, 肌肉层也较薄。粗蛋白含量为 12%和 16%的刺参消化道的组织各层结构清晰, 黏膜细胞排列整齐, 前中后肠的组织结构在这两个处理中没有显著差异。但 32%粗蛋白含量的处理中中肠外层细胞和黏膜细胞轮廓不清晰, 说明组织结构受到影响(图5-C2)。

图3 刺参蛋白酶活性随养殖时间的变化Fig. 3 The change of protease activity during feeding
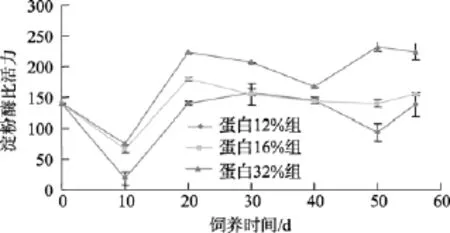
图4 刺参淀粉酶活性随养殖时间的变化Fig. 4 The change of amylase activity during feeding
3 讨论
从本实验的结果看, 刺参在饲料粗蛋白为 16%时即达到最大的生长速度, 而一直到粗蛋白含量为 24%时, 实验刺参的增重率都维持在最高水平(P<0.05),从饲料效率来看, 饲料粗蛋白在 16%~24%时, 其饲料系数最低, 饲料蛋白质效率最高, 说明饲料粗蛋白的适宜含量为 16%~24%。朱伟等[1]的研究认为, 刺参饲料的粗蛋白的适宜含量为18.21%~ 24.18%, 与本实验的结果基本一致。当饲料中粗蛋白含量高于24%时, 随着饲料中粗蛋白含量的上升, 刺参增重率逐渐下降,表明过高的粗蛋白不利于刺参的生长。在其他动物如罗非鱼[8]和凡纳滨对虾[9]中也有相同现象。
从图1和图2可以看出刺参摄食不同粗蛋白含量的饲料其消化道蛋白酶活性变化趋势。当刺参摄食不同粗蛋白含量的饲料后, 能够通过体内消化酶活性的变化来适应, 从而对饲料中粗蛋白进行更充分的消化和吸收, 因此可以认为刺参消化道内蛋白酶活性对饲料中粗蛋白含量有适应性变化, 即当饲料中粗蛋白含量高时, 刺参的消化道内的蛋白酶活性会随之增大。而且, 这种适应性不仅存在于低于刺参饲料粗蛋白最适含量(16%~24%)时, 而当饲料中粗蛋白含量高于 24%时, 也有此变化, 但此时虽然刺参肠道蛋白酶活性提高, 而增重率却没有相应地增加。罗氏沼虾消化酶活性对饲料蛋白质含量有适应性反应, 饲料蛋白含量的增加, 可显著影响罗氏沼虾稚虾类胰蛋白酶和胃蛋白酶的活性, 但不影响淀粉酶的活性[10]。这与罗氏沼虾蛋白酶活性与饲料蛋白含量关系的研究所得结论相一致,可能的原因是随着饲料中粗蛋白含量的提高使蛋白酶活性升高, 吸收到体内的蛋白质随之增加, 但过多的蛋白质不能用来合成自身组织而是被自身代谢而被消耗。当饲料中粗蛋白含量超过 28%时, 刺参肠道内蛋白酶活性随饲料中粗蛋白含量的提高而有所下降。在对宝石鲈、南方鲇中的研究中也发现了同样的现象[11-12], 这可能与消化道内蛋白酶活性的产物抑制作用有关, 还有待进一步研究。因此, 在配合饲料的研制过程中应考虑使饲料的粗蛋白含量与刺参自身的消化酶活性相适应, 以降低养殖成本, 提高饲料中蛋白质利用率。
刺参肠道内淀粉酶活性随饲料中粗蛋白含量的增加(碳水化合物含量减少)而逐渐升高。当饲料中粗蛋白含量为 32%时淀粉酶活性达到最大值。说明刺参淀粉酶活性对饲料中淀粉含量的适应程度较低。这一结果与罗氏沼虾, 中国对虾淀粉酶与饲料粗蛋白含量关系的研究中所得的结果相似[13]。
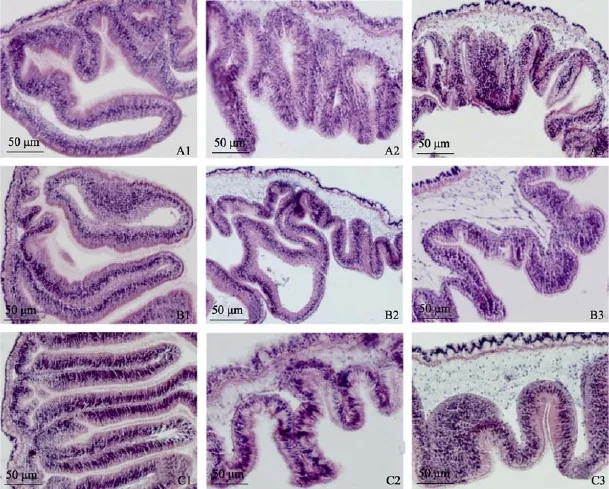
图5 实验刺参肠道横切Fig. 5 Transverse sections of sea cucumbers
在饲养实验过程中, 刺参肠道内消化酶活性的变化分为两个阶段。在第一个阶段(前 20d), 刺参蛋白酶活性呈现显著的先上升后下降的趋势, 淀粉酶活性呈现先下降后上升的趋势。两种消化酶活性都出现了较大幅度的变化, 但变化趋势截然相反, 这种现象可能与刺参对实验饲料的适应性有关。这与对中国对虾的研究得到的结论一致, 中国对虾体内消化酶活性的急剧变化与饲料改变后导致消化系统活动的应激作用有关。随着饲养时间的延长, 机体内消化酶的分泌量受其神经内分泌因素的调控, 与机体的新陈代谢水平逐渐相适应。本实验结果说明, 消化酶分泌量多少与活性的大小不仅与消化系统自身有关, 还与机体的整体代谢的调控水平相适应。在第二阶段(20 d后), 刺参对摄食的饲料逐渐适应, 消化酶活性变化趋于平稳。在该阶段, 蛋白酶活性在经历一个相对平稳期之后逐渐升高。饲料中粗蛋白质量分数 16%处理的实验刺参消化道内蛋白酶、淀粉酶活性在饲养实验过程中的变化最为平稳, 说明适宜的饲料粗蛋白含量引起的刺参体内的生理变化也最小。
作者选取了 12%、16%和 32%粗蛋白处理的刺参的横切面图进行了比较, 发现粗蛋白含量的变化引起的刺参肠道的组织结构的变化不大。尤其是在12%和16%中处理中前肠、中肠和后肠的组织结构均没有显著变化, 只是在 32%粗蛋白的处理中实验刺参中肠的外层细胞和黏膜细胞的轮廓模糊, 说明其结构收到了影响, 但其中的原因还有待进一步分析,也不能排除替代粗蛋白的饲料原料增加而造成的。有研究表明, 刺参消化管的长度和质量的季节变化与刺参消化道中蛋白酶、淀粉酶等主要消化酶活性的周年变化是一致的, 既当刺参摄食旺盛, 消化酶活性高时, 其消化管较长、较重; 反之, 在摄食和生长缓慢的时期, 消化道内各种酶活性低, 消化管较短、较轻[3]。由此推测, 饲料的营养成分和原料组成都会影响消化道的结构。
[1]朱伟, 麦康森, 张百刚, 王福振, 徐桂玉. 刺参稚参对蛋白质和脂肪需求量的初步研究[J]. 海洋科学, 2005,29(3):54-58.
[2]付雪艳. 海参(Apostichopus japonicus)消化蛋白酶的初步研究[D]. 青岛:中国海洋大学, 2004.
[3]王吉桥, 唐黎, 许重, 程骏驰. 仿刺参消化道的组织学及其 4种消化酶活性的周年变化[J]. 水产科学, 2007,26(9):481-484.
[4]唐黎, 王吉桥, 许重, 程骏驰. 不同发育期的幼体和不同规格刺参消化道中四种消化酶的活性[J]. 水产科学,2007, 26(5):275-277.
[5]上海市医学化验所. 临床生化检验(上册)[M].上海:上海科学技术出版社, 1982:31-35.
[6]崔龙波, 董志宁, 陆瑶华. 仿刺参消化系统的组织学和组织化学研究[J]. 动物学杂志, 2000, 35(6):2-4.
[7]中山大学生物化学教研室.生化技术导论[M].北京:人民教育出版社, 1978:53-55.
[8]Jauncey, K. The effects of warying dietary protein level on the growth, food conversion, protein utilization, and body composition of juvenile tilapias (Sarotherodon mossambicus) [J]. Aquoculture, 1982, 27:43-54.
[9]李广丽, 朱春华, 周歧存. 不同蛋白质水平的饲料对南美白对虾生长的影响[J]. 海洋科学, 2001, 25(4):1-4.
[10]董云伟, 牛翠娟, 杜丽. 饲料蛋白水平对罗氏沼虾生长和消化酶活性的影响[J]. 北京师范大学学报, 2001,37(2):96-99.
[11]邵庆均, 苏小凤, 许梓荣等. 饲料蛋白水平对宝石鲈生长和体组成影响研究[J]. 水生生物学报, 2004, 28(4):367-373.
[12]黄峰, 张桂营.不同蛋白含量饲料对南方鲇胃蛋白酶和淀粉酶活性的影响[J]. 水产生物学报, 2003, 5:451-455.
[13]吴垠, 孙建明, 周遵春等. 饲料蛋白质水平对中国对虾生长和消化酶活性的影响[J]. 大连水产学院学报, 2003,18(4):258-262.
The effect of dietary protein on the enzymes and intestinal structure ofApostichopus japonicus
WU Yong-heng, WANG Qiu-yue, FENG Zheng-fu, LI Bin-bin, ZHU Wei
(Life Science College, Qingdao Agriculture University, Qingdao 266109, China)
Feb., 26, 2011
sea cucumber (Apostichopus japonicus); crude protein; protease; amylase
To investigate the effect of dietary crude protein levels on the growth, protease or amylase activity, and the intestinal structure ofApostichopus japonicus, a feeding experiment was conducted with six semi-purified diets with protein content of 12%, 16%, 20%, 24%, 28%, and 32%. The results showed that growth performance, protease or amylase activity and the intestinal structure of sea cucumbers were significantly affected by dietary protein content. Intestinal protease or amylase activity could not only adapt for the diet crude protein, but also changed as feeding time. The histology observation showed that the mid-intestinal structure was affected by dietary content of crude protein.
S963.16; S986.2 文献标识码:A 文章编号:1000-3096(2012)01-0036-06
2011-02-26;
2011-05-12
青岛市科技计划资助项目(05-1-HY-79)
吴永恒(1985-), 男, 山东青州人, 硕士研究生, 研究方向为水产动物营养生理; 朱伟, 通信作者, 教授, 研究方向为水产动物营养与饲料, 电话:0532-86080640, E-mail:zhuw001@163.com
梁德海)

