许氏平鲉4个野生群体遗传多样性微卫星分析
王文琪, 张 毅,, 刘梦侠, 吴志昊, 王丽娟, 訾 珺, 关 健, 尤 锋
(1. 青岛农业大学 动物科技学院, 山东 青岛 266109; 2. 中国科学院 海洋研究所, 山东 青岛 266071;3. 山东海水养殖研究所, 山东 青岛 266002)
许氏平鲉4个野生群体遗传多样性微卫星分析
王文琪1, 张 毅1,2, 刘梦侠3, 吴志昊2, 王丽娟2, 訾 珺2, 关 健3, 尤 锋2
(1. 青岛农业大学 动物科技学院, 山东 青岛 266109; 2. 中国科学院 海洋研究所, 山东 青岛 266071;3. 山东海水养殖研究所, 山东 青岛 266002)
利用18对微卫星引物分析了荣成湾群体1、荣成湾群体2、即墨群体和龙口群体共4个许氏平鲉(Sebastes schlegeli)野生群体的遗传多样性。结果表明:4个群体的平均有效等位基因数分别为3.1、2.7、2.8和2.7, 平均期望杂合度分别为0.590、0.540、0.552和0.491, 平均多态信息含量分别为0.577、0.495、0.538和0.528。4个许氏平鲉群体均表现出较高的遗传多样性水平, 但也都存在杂合子缺失现象。Χ2检验显示, 4个群体中大部分微卫星位点偏离Hardy-Weinberg平衡(P<0.05)。群体间Fst值为0.04,说明遗传变异主要存在于群体内, 群体间的遗传分化程度较低。该研究结果将为许氏平鲉种质资源保护和合理利用以及人工增殖提供理论参考。
许氏平鲉(Sebastes schlegeli); 野生群体; 微卫星标记; 遗传多样性
许氏平鲉(Sebastes schlegeli), 又称黑, 俗称黑石鲈, 黑寨鱼, 是近海常见的暖温性底层鱼类。其肉质鲜美, 营养丰富, 生长快速, 具有较高的经济价值, 是中国北方海域重要的经济鱼种, 在海外市场也有一定销路[1]。对于许氏平鲉, 目前已进行过有关基础生物学[2]、消化生理[3]、营养摄食[4]、环境胁迫[5]、分子免疫[6]及性别分化[7]等方面的研究, 但是对许氏平 鲉群体遗传多样性的研究还很少, 特别在分子水平上, 仅见Yoon等[8]利用RAPD分析许氏平鲉和朝鲜平 鲉(S.koreanus)的群体遗传差异, 刘丽娟等[9]利用等位酶研究了山东4个野生群体和1个养殖群体的遗传多样性。由于近10年近海渔场环境的巨大变迁, 造成近海渔业资源进一步衰退, 势必对该物种的种群遗传结构产生影响。因此研究许氏平鲉的群体遗传多样性水平, 了解其种质资源状况, 对于合理开发利用许氏平鲉资源, 保持其可持续利用具有重要意义。
微卫星 DNA(Microsatellite DNA)标记具有丰富的多态性、重复性好、共显性等特性, 在动物的种群遗传分析、亲本鉴定、基因组作图、系统发育和遗传育种中具有优于其他标记的明显优势[10]。近年来也越来越多地应用到鱼类的群体遗传分析、育种的研究中。如Sekino等[11]利用微卫星遗传标记分析了日本沿海7个牙鲆(Paralichthys olivaceus)群体, 说明日本沿海牙鲆的群体结构不容乐观。Kumagai 等[12]利用微卫星标记对中日沿海的 7个三线鲈(Parapristipoma trilineatum)群体进行了分析, 结果显示中日群体之间存在着较大的遗传分化, 中国的两个群体也表现出很大的遗传分化, 然而日本的群体间无遗传分化。有关许氏平鲉的研究, 仅见韩国学者An等[13]和日本学者Yoshida等[14]进行的微卫星标记分离及其杂合度分析的报道。作者从上述 2篇文献中筛选获得的20对引物中选取18对引物, 对山东荣成湾、青岛 即墨和烟台龙口 4个许氏平鲉野生群体的遗传结构和遗传多样性水平进行了研究, 以期为许氏平鲉种质资源保护和合理利用以及良种选育提供理论参考。
1 材料与方法
1.1 实验材料
实验所分析的4个许氏平鲉群体分别是荣成湾群体1(SSRT)、荣成湾群体2(SSRC)、即墨野生群体(SSJM)和龙口野生群体(SSLK)。SSRC于2009年5月在山东荣成湾近岸海域垂钓所得, 共22尾,平均全长18.92 cm ±3.30 cm; SSRT是同年8月在荣成湾靠近外海的海域采用底拖网所得, 共30尾,平均全长18.61 cm ±3.55 cm; SSLK为5月由山东烟台龙口附近海域垂钓所得, 共 13尾, 平均全长6.42 cm ±0.73 cm; SSJM则是5月在山东青岛即墨附近沿海垂钓所得, 共 30尾, 平均全长 13.88 cm±1.52 cm。
1.2 基因组DNA的提取
基因组DNA采用高盐法[15]提取, 经Beckman DU 650型紫外分光光度计测定DNA浓度后, 用无菌双蒸水将模板稀释到20 mg/L, -20℃保存备用。
1.3 引物合成
从 An等[13]和 Yoshida等[14]文献中选取了 18对引物, 由上海生工生物工程技术服务有限公司合成, 引物的相关信息见表1。
1.4 PCR扩增和结果记录
扩增反应总体系为25 μL, 其中包括:50 ng的模板 DNA, 1×Buffer缓冲液, 100 μmol/L 的 dNTPs, 0.4 μmol/L的引物, 1.0 mmol/L的Mg2+, 1U的Taq DNA聚合酶。反应条件为94℃变性5 min, 然后94℃ 50 s,退火50 s, 72℃延伸50s, 35个循环, 最后72℃延伸7 min。PCR产物由1.5%琼脂糖电泳检测后, 4℃保存备用。8%非变性聚丙烯酰胺凝胶电泳, 电压为5V/cm。电泳完毕后银染检测。

表1 实验所用18对微卫星标记的核心序列、退火温度及其引物序列Tab. 1 Core repeats, annealing temperatures and primer sequences of the 18 microsatellite DNA loci used in the study
1.5 数据的统计分析
运用 POPGEN32软件计算等位基因数(number of alleles,A)、有效等位基因数(effective number of alleles,Ne)、观测杂合度(obsevered heterozygosity,Ho)、期望杂合度(expected heterozygosity,He)、遗传偏离指数(D)、群体遗传分化指数(Fst)和Nei's遗传距离。用 Arlequin进行 AMOVA分析, 根据 Botstein等[16]的方法计算每个微卫星位点的多态信息含量(polymorphism information content, PIC)。有关计算公式如下:
多态信息含量:
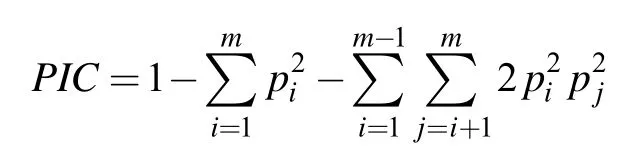
其中,pi和pj分别表示第i和第j个等位基因在群体中的频率,m为等位基因数。
D =(He-Ho) /He;
Ho=杂合子观察数/观察个体总数;
He= 1-ΣPi2,Pi为该位点上第i个等位基因的频率。
2 结果
2.1 微卫星PCR扩增结果和等位基因频率
用这18对微卫星引物对山东4个许氏平鲉群体进行了遗传变异分析, 部分扩增图谱如图1。每个位点在不同群体中的等位基因频率及其他遗传参数见表2。在4个群体中, Kss18A位点所有个体均表现为单态性。其余17个微卫星位点中每个位点检测到的等位基因数2~10个。
2.2 群体内的遗传变异
这 4个群体的平均期望杂合度、平均观测杂合度、平均等位基因数、平均有效等位基因数和平均多态信息含量等指标见表3、表4。平均有效等位基因数分别为 3.1(SSRT)、2.8(SSJM)、2.7(SSRC)、2.7(SSLK), 平均期望杂合度在0.540~0.590范围内。4个群体的平均多态信息含量最高的是 SSRT, 为0.577; 最低的是SSRC, 为0.495。4个群体都表现出较高的遗传多样性水平。Χ2检验显示, 除 Kss18位点, 在SSRT、SSJM、SSLK群体中有13个位点偏离了Hardy-Weinberg平衡, SSRC群体中有14个位点偏离Hardy-Weinberg平衡(P<0.05)。从遗传偏离指数(D)看出, 大多数位点在4个群体中表现为杂合子缺失。
2.3 群体间的遗传变异
AMOVA分析结果表明, 群体间的遗传变异占总遗传变异的4%, 群体内的遗传变异占总遗传变异的96%(表5), 这表明4个群体间的遗传分化较弱。表6、表7分别列出4个群体相互间的遗传相似性、遗传距离和遗传分化指数。由表6可见, 最大遗传距离在SSRT和SSLK之间, 为0.135; 最小遗传距离在SSRC和SSLK之间, 为0.017。群体间Fst值均小于0.05。4个许氏平鲉群体间没有产生明显的遗传分化,群体间的遗传分化程度较低。
3 讨论
微卫星DNA由于具有在基因组中广泛而随机分布、多态性高、共显性标记、可重复性好、容易检测等优点, 已经成为分子系统学、种群遗传学及生态学研究中最重要的分子标记之一。群体的遗传多样性, 是物种适应多变的环境条件, 维持长期生存和进化的遗传基础。本研究中对许氏平鲉4个群体遗传多样性水平进行了研究。各群体内遗传变异程度如平均多态信息含量(PIC)由大到小依次为SSRT(0.577)、SSJM(0.538)、SSLK(0.528)、SSRC(0.495)。Botstein等[16]首先提出了衡量基因变异程度的多态信息含量指标, 他们认为当PIC>0.5时, 该位点为高度多态性位点; 0.25<PIC<0.5时, 该位点为中度多态性位点;PIC<0.25时, 为低度多态性位点。许氏平鲉4个群体的PIC差异不大, 都在0.5左右, 表明它们的遗传变异程度总体上处于一个较高的水平, 遗传多样性较为丰富, 选择潜力大。

图1 4 个许氏平鲉群体部分个体在微卫星标记Ssc69位点的电泳图谱Fig. 1 Electrophoresis pattern of microsatellite markers amplified by Ssc69 locus from partial individuals in four stocks of Sebastes schlegeli
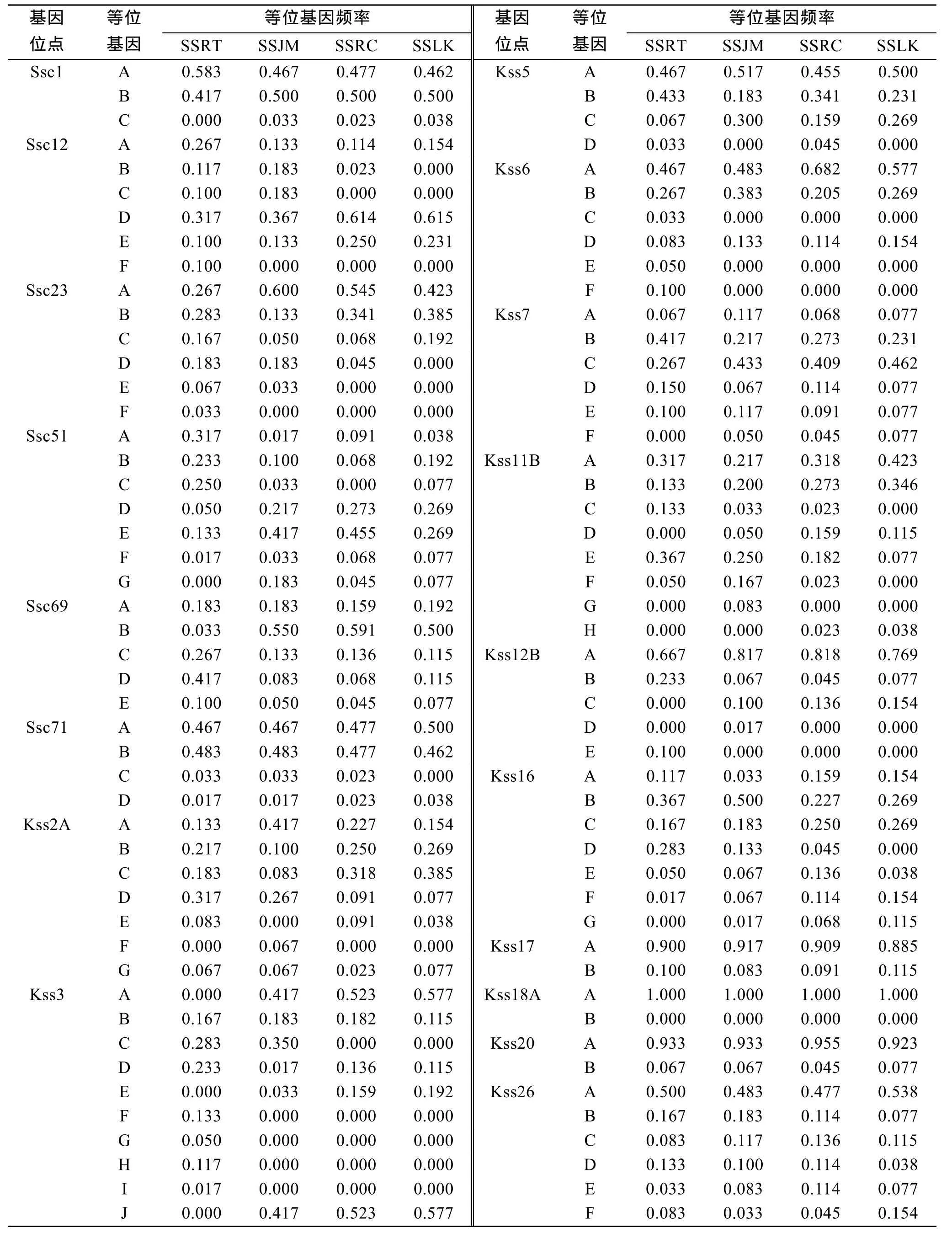
表2 4个许氏平鲉群体18个微卫星位点的等位基因频率Tab. 2 Allele frequencies of 18 microsatellites loci among four stocks of Sebastes schlegeli
这4个群体的平均期望杂合度(He)在0.447~0.590, 平均为 0.53, 其与 Yoshida等[14]用 14个微卫星位点分析的日本海域许氏平鲉期望杂合度(He=0.31~0.95)和An等[13]利用6个微卫星位点分析韩国沿海许氏平鲉的期望杂合度(He=0.072~0.897)基本相符。在其他海洋鱼类中, Norris等[17]对大西洋鲑(Salmo salar)的微卫星标记检测得到平均杂合度为 0.70, Zatcoff等[18]得到不同群体博氏喙鲈(Mycteroperca bonaci)的平均杂合度为 0.637~0.876,DeWoody等[19]对12种海洋鱼类进行了微卫星分析,得到的平均杂合度为0.77。由此可见, 海洋鱼类普遍具有较高的杂合度水平, 但本研究 4个许氏平鲉群体的平均杂合度为 0.53低于上述各种海洋鱼类, 也发现这 4个群体在大多数位点都存在杂合子缺失现象。究其原因, 可能是许氏平鲉是一种岩礁性鱼类,不进行长距离的洄游[20], 相对狭小的生活环境, 会使其不能进行更大范围的基因交流, 导致其在一定区域内有近交情况, 从而降低了其遗传变异。
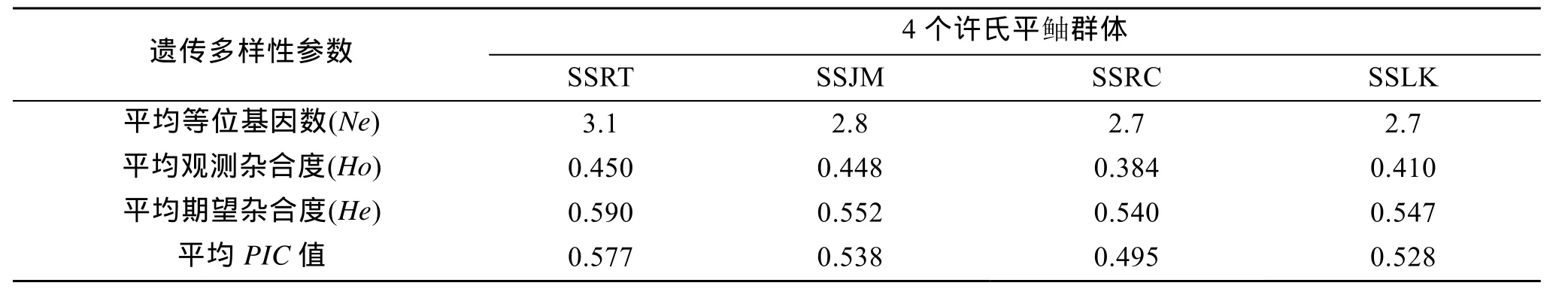
表3 4个许氏平鲉群体的遗传多样性参数Tab. 3 Genetic diversity value in four S. schlegeli stocks
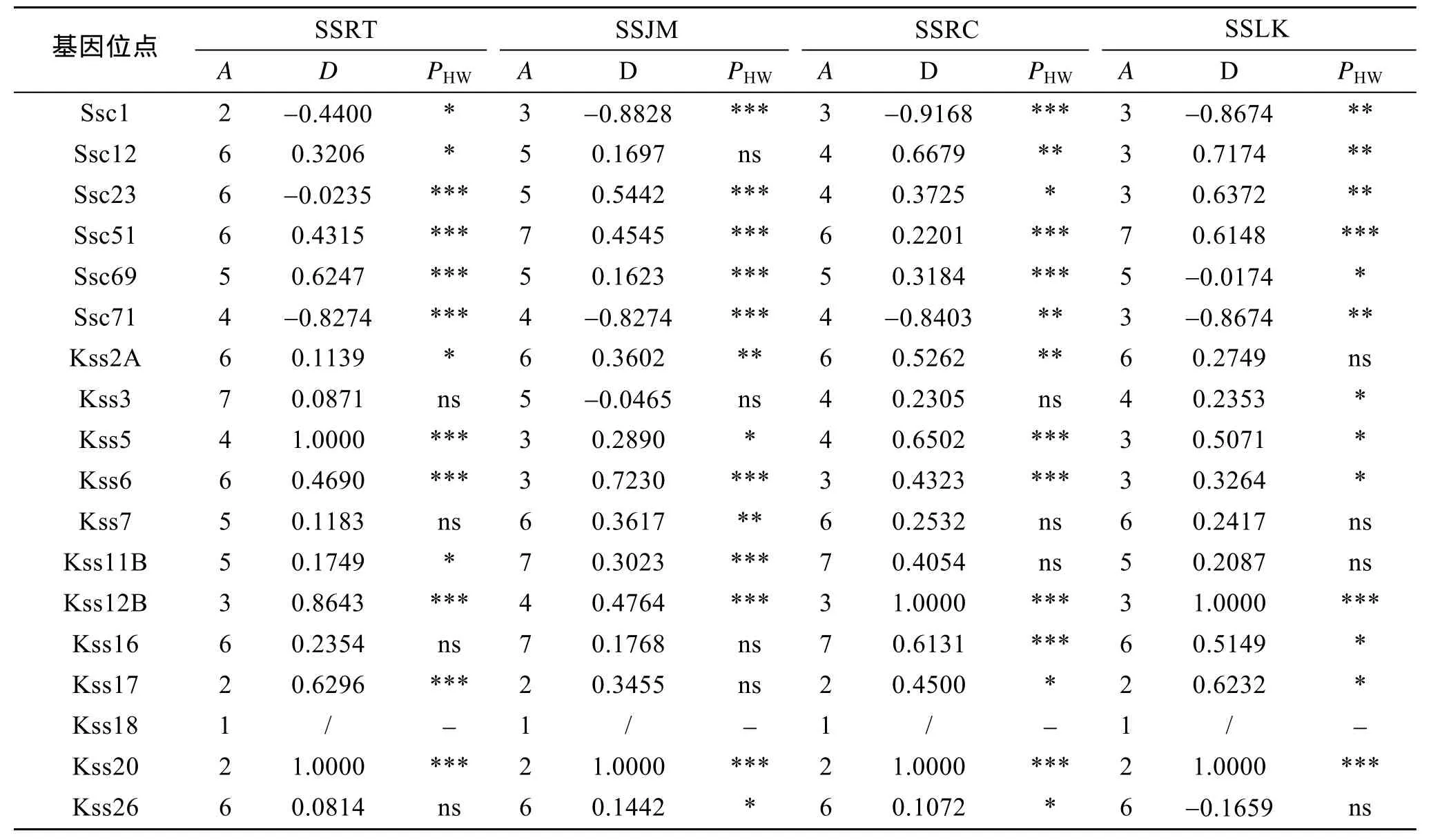
表4 18个微卫星位点的等位基因数、遗传偏离指数和H-W检测Tab. 4 Number of alleles(A), genetic deviation index(D), and H-W of the 18 microsatellite loci assessed for the four S.schlegeli stocks
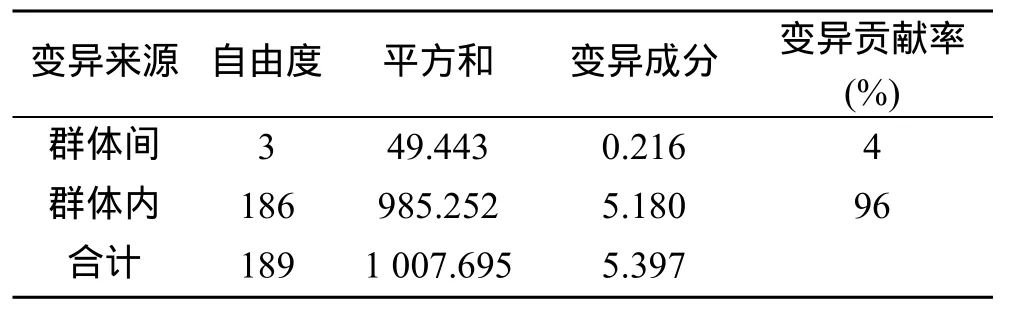
表5 4个许氏平鲉群体的AMOVA分析结果Tab. 5 AMOVA analysis of the four S.schlegeli stocks
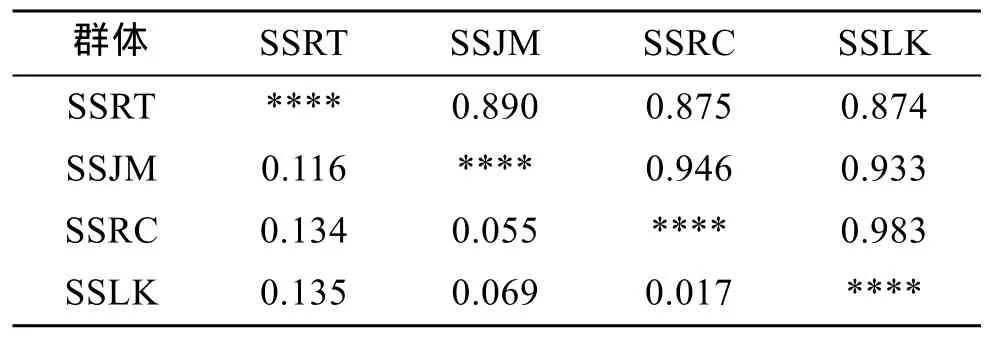
表6 许氏平鲉4个群体的遗传相似性和遗传距离Tab. 6 Genetic identity and distance among four S.schlegeli stocks
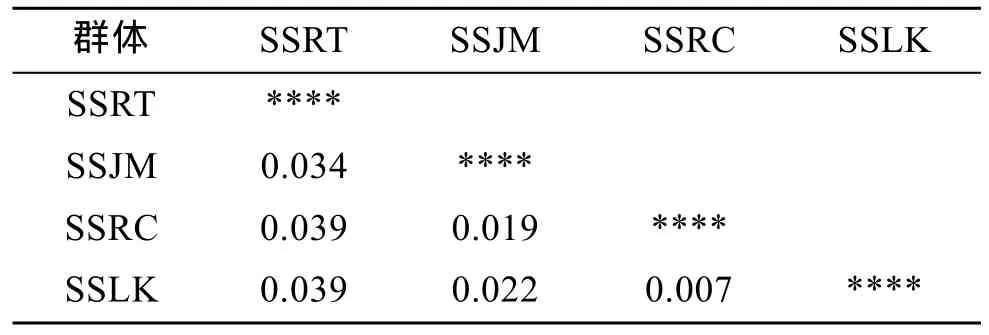
表7 许氏平鲉4个群体的Fst值Tab. 7 Fst values of pairwise comparison among 4 S.schlegeli stocks
作者通过各位点Fst的分析, 发现来自群体内的遗传变异是96%, 来自群体间的遗传变异只有4%。通过不同群体Fst值的配对比较以及群体间的遗传距离和遗传相似性, 总体说明了 4个群体间的遗传分化程度较低。
所有自然资源保护计划的最终目的就是为了防止过度捕捞的物种灭绝[21], 环境受人类活动的影响变化越来越快, 因此必须要保持动物自身的遗传适应力。群体的遗传多样性越高, 对环境的适应能力就越强, 进化的潜力也越大。人工增殖放流计划也是一种自然资源的保护计划, 所以保护现有的野生群体的遗传多样性, 就要保持其较高的杂合度和基因丰富度[22]。本研究所分析的 4 鲉个许氏平 群体都具有丰富的遗传多样性, 而且其群体间低程度的遗传分化, 使得荣成湾放流许氏平鲉的放流鱼种可以用即墨、龙口、荣成湾任何一个地方的野生种群来作为亲本进行繁育。但是在人工增殖放流过程中要保持较高的群体遗传多样性需要一个合理的养殖管理方法。繁育过程中应当保证亲本的更新, 避免近交影响,能够定期对养殖放流种群做遗传结构的评估, 避免因放流种群遗传多样性下降而导致自然资源中多样性的降低。作者利用微卫星标记得到的 4个许氏平鲉群体的遗传学数据为种质资源保护和合理利用提供理论参考, 也能为大规模的人工增殖放流提供科学依据。
[1]吴立新, 王 岩, 秦克静. 许氏平鲉人工育苗的初步试验[J]. 水产科学, 1994,13(4):7-9.
[2]Park C W, Yoon H S. Effects of night lighting on growth of juvenile rockfish(Sebastes schlegeli)in sea cages[J]. Journal of Applied Ichthyology, 2008, 24(3):354-355.
[3]万军利. 野生与养殖许氏平鲉消化酶活力的比较[J].生态学杂志, 2010, 29(5):1035-1038.
[4]OH S Y, NOH C H, Kang R S, et al. Compensatory growth and body composition of juvenile black rockfish(Sebastes schlegeli) following feed deprivation[J].Fisheries Science, 2008, 74(4):846-852.
[5]Kim W S, Kim J W, Lee J H, et al. Effects of sodium cyanide(NaCN)on the endogenous rhythm of the oxygen consumption rate in the black rockfishSebastes schlegeli[J]. Ocean Science Journal, 2008, 42(2):107-113.
[6]Kim M Y, Jang J H, Lee J W, et al. Molecular cloning and characterization of peptidoglycan recognition proteins from the rockfish,Sebastes schlegeli[J]. Fish &Shellfish Immunology, 2010, 28(4):632-639.
[7]Lee C H, Na O S, Yeo I K, et al. Effects of sex steroid hormones and high temperature on sex differentiation in black rockfish,Sebastes schlegeli[J]. J Kor Fish Soc,2000, 33:373-377.
[8]Yoon J M, Choi Y, Kim J Y. Genetic differences and variation in black rockfish(Sebastes schlegeli) and Hwanghae rockfish(S. koreanus) from the Yellow sea[J].Genes and Genomics, 2007, 29(4):437-445.
[9]刘丽娟, 任利华, 姜向阳, 等. 黑鲪(Sebastes schlegeli)遗传多样性的等位酶研究[J]. 海洋与湖沼,2009, 40(4):479-483.
[10]O’Connell M, Wright J M. Microsatellite DNA in fishes[J]. Rev Fish Biol Fish, 1997, 7:33l-363.
[11]Sekino M, Hara M. Application of microsatellite markers to population genetics studies of Japanese flounderParalichthys olivaceus[J]. Mar Biotechnol, 2001, 3:572-589.
[12]Kumagai K, Barinova A A, Nakajima M, et al, Genetic diversity between Japanese and Chinese threeline grunt(Parapristipoma trilineatum) examined by microsatellite DNA markers[J]. Mar Biotechnol, 2004, 6:221-228.
[13]An H S, Park J Y, Kim M J, et al. Isolation and characterization of microsatellite markers for the heavily exploited rockfishSebastes schlegeli, and cross-species amplification in four relatedSebastesspp[J]. Conserv Genet, 2009, 10:1 969-1 972.
[14]Yoshida K, Nakagawa M, Wada S. Multiplex PCR system applied for analysing microsatellite loci of Schlegel’s black rockfish,Sebastes schlegeli[J]. Molecular Ecology Notes, 2005, 5:416-418.
[15]汪永庆, 王国新, 徐来祥, 等. 一种动物基因组DNA提取方法的改进[J]. 动物学杂志, 2001, 36(1):27-29.
[16]Botstein D, White R L, Skolnick M. Construction of a genetic linkage map in man using restriction fragment length polymorphisms[J]. Am J Hum genet, 1980, 32:314-331.
[17]Norris A T, Bradley D G, Cunningham E P. Microsatellite genetic variation between and within farmed and wild Atlantic salmon(Salmo salar)populations[J].Aquaculture, 1999, 180:247-264.
[18]Zatcoff M S, Ball A O, Chapman R W. Characterization of polymorphic microsatellite loci from black grouper,Mycteroperca bonaci(Teleostei:Serranidae)[J]. Mol.Ecol Notes, 2002, 2:217-219.
[19]DeWoody J A, Avise J C. Microsatellite variation in marine, freshwater and anadromous fishes compared with other animals[J]. J Fish Biol, 2000, 56:461-473.
[20]朱龙, 隋凤美. 许氏平鲉的生物学特征及其人工养殖[J]. 现代渔业信息, 1999, 14(4):21-25.
[21]Man A, Law R, Polunin N V C. Role of marine reserves in recruitment to reef fisheries:a metapopulation model[J]. Biol Conserv, 1995, 71:197-204.
[22]Meffe G K. Conservation genetics and the management of endangered species[J]. Fisheries, 1986, 11:14-23.
Microsatellite analysis of genetic diversity in four wild stocks of black rockfishSebastes schlegeli
WANG Wen-qi1, ZHANG Yi1,2, LIU Meng-xia3, WU Zhi-hao2, WANG Li-juan2, ZI Jun2, GUAN Jian3, YOU Feng2
(1. College of Animal Science and Technology, Qingdao Agriculture University, Qingdao 266109, China; 2. Institute of Oceanology, the Chinese Academy of Sciences, Qingdao 266071, China; 3. Shandong Provincial Mari-culture Institute, Qingdao 266002, China)
Mar, 11, 2011
Sebastes schlegeli; wild stock ; microsatellite DNA ; genetic variation
The genetic diversity of four wild stocks of black rockfishSebastes schlegeliincluding Rongcheng stock 1, Rongcheng stock 2, Jimo stock and Longkou stock, was investigated using 18 microsatellite DNA loci. The results showed that the mean effective numbers of alleles(Ne) were 3.1, 2.7, 2.8 and 2.7, respectively. The values of mean expected heterozygosity(He) were 0.590, 0.540, 0.552 and 0.491, respectively. And the values of mean polymorphism information content(PIC) were 0.577, 0.495, 0.538 and 0.528, respectively. These four stocks had abundant genetic diversity, but most loci were also found to be significantly deviated from HWE in which heterozygote absence was apparent according to the results of chi-square test (P<0.05). Genetic differentiation and hierarchical partition of genetic diversity were evaluated byFst, which indicated high values of variation within four stocks and low levels of genetic variation among stocks (Fst=0.04). The results would provide basic data for the conservation and utilization of naturalS.schlegelibreeds, and for its artificial releasing.
Q953 文献标识码:A 文章编号:1000-3096(2012)01-0010-07
2011-03-11;
2011-05-22
国家海洋公益性行业科研专项(200805069)
王文琪(1970-), 女, 山东莱阳人, 博士, 主要从事水产养殖研究, 电话:0532-86080565, E-mail:wenqiwang@qau.edu.cn; 王文琪和张毅对该论文的贡献相当; 尤锋, 通信作者, E-mail:youfeng@qdio.ac.cn
致谢:本研究所分析的荣成湾底拖网群体样品(SSRT)的采集得到中国科学院海洋研究所线薇薇老师、李文龙老师的帮助, 谨此一并致谢。
谭雪静)

