高强度聚焦超声制备DC瘤苗及其对BALB/c小鼠肿瘤治疗作用的实验研究*
杨 雪 叶 欣 刘丽霞 葛忠民 陈祥明 田瑞华
(1.泰山医学院附属泰山医院肿瘤内科,山东 泰安 271000,2.山东省省立医院,山东 济南 250001,3. 义马矿务局总医院,河南 义马,472000)
树突状细胞(DC)是体内最强的抗原提呈细胞,捕获抗原提呈给 T、B 淋巴细胞从而参与细胞免疫和T细胞依赖的体液免疫反应,在抗肿瘤免疫应答中起关键作用。肿瘤患者体内由于肿瘤的调变可以降低 DC 提呈功能,使淋巴细胞杀伤肿瘤的效率减弱。近年来,以DC为基础的免疫治疗作为一种主动特异性细胞免疫治疗, 通过体外抗原负载的 DC 提高抗原提呈能力,激活细胞毒 T 细胞的杀伤能力,而达到治疗肿瘤的目的。本研究用高强度聚焦超声(HIFU)制备肿瘤抗原致敏DC,然后将其回输体内,激发针对肿瘤的主动特异性细胞免疫,观察HIFU辐照法制备的DC瘤苗对BALB/c小鼠肿瘤治疗作用。
1 材料与方法
1.1试剂和仪器
小鼠重组GM-CSF、IL-4购自Promega公司,分装为10 ng/l,-80 ℃保存备用;RPMI-1640完全培养基由RPMI-1640(Hyclone公司)、10%胎牛血清(Hyclone公司)组成,4 ℃保存备用;荧光素标记的大鼠抗小鼠单抗CD11c购自PharMingen公司,4 ℃保存;流式细胞仪(FACS Calibur,BD公司)及分析软件(Cellquest, BectonDicsion公司);普通倒置光学显微镜(Olympus IX70)及电子显微镜(JEM-1200EX)。
1.2动物及细胞株
BALB/c(H-2kd)小鼠,雄性,6~8周龄,体重18~20 g,购自山东省医科院实验动物中心[实验动物等级:SPF级,许可证号SCXK(鲁)]。标准饲料喂养,自由饮水。CT-26肿瘤细胞为BALB/c小鼠来源的结肠癌细胞。
1.3实验方法
1.3.1小鼠骨髓DC的诱导培养 小鼠骨髓DC的培养参照本实验室方法[1-2]。颈椎脱位法处死小鼠,取股骨骨髓细胞,加Tris-NH4Cl裂解红细胞,收集细胞。用含10%胎牛血清的RPMI-1640培养基配制成1106/ml的细胞悬液,接种于6孔培养板,加GM-CSF 10 ng/ml、IL-4 1 ng/ml,每孔4 ml。置于37 ℃、体积分数为5% CO2、饱和湿度的培养箱中培养2~3 d。弃去悬浮细胞,保留贴壁细胞的培养板中加入4 ml含10%胎牛血清、GM-CSF 10 ng/ml、IL-4 1 ng/ml的新鲜培养基继续培养2~5 d后,收集悬浮细胞即为小鼠骨髓来源的树突状细胞。按CD11c磁珠分离试剂盒的操作程序进行阳性选择分离,获得CD11c阳性DC,计数备用。
1.3.2肿瘤抗原制备和DC瘤苗的制备 HIFU制备肿瘤抗原:取对数生长期的CT26结肠癌细胞,调整细胞浓度为5×106/ml,分装到聚乙烯试管中,每管2 ml,HIFU焦点定位于细胞悬液中央,启动治疗系统采用1000 W/cm2×30 s辐照CT-26细胞,对辐照后细胞裂解液以1800 转/min,离心10 min,取上清液,经0.2 μm的滤器过滤除菌后,收集备用。冻融抗原的制备:常规培养并收集CT-26结肠癌细胞,调整细胞浓度为5×106/ml,细胞冷冻到-80 ℃,而后复温,循环4次,对细胞裂解物离心以1800 转/min,离心10 min,取上清液,经0.2 μm的滤器过滤除菌后,收集备用。
把上述两种方法制备的CT-26肿瘤抗原分别加入第5天扩增培养的DC悬液中共培养24 h,DC与抗原的比例为1∶10(抗原的量以抗原制备前肿瘤细胞的数量计算),获得HIFU辐照、反复冻融等方法负载肿瘤抗原制备的DC瘤苗。
1.3.3DC瘤苗的体内治疗作用
荷瘤小鼠模型的建立:将对数生长期、重悬于RPMI1640的CT-26结肠癌细胞接种于BALB/c小鼠左背侧部皮下(5×105/只)。一般4~6天可在注射部位皮下触及生长出的肿瘤,瘤体逐渐长大。
体内治疗的实验方法:第一阶段:取正常6~8周龄雄性BALB/c小鼠32只,分为4组(8只/每组):HIFU致敏DC组(HIFU组)、冻融法致敏DC组(冻融组)、单纯DC细胞组(单纯DC组)和等量的无血清培养液组(阴性对照组)。四组分别给予一次性皮下(左背侧部)注射对数生长期的小鼠CT-26结肠癌细胞 (5×105/只),7天后,再在每只小鼠皮下(右侧腋下)HIFU辐照法制备的DC瘤苗(5×105/只)、反复冻融法制备的DC瘤苗(5×105/只)、单纯的DC细胞(5×105/只)和等量的无血清培养液组(250 μl),给予治疗接种,14天后,给与加强治疗接种一次。3周时处死全部小鼠,剥离肿块,称重(g)、测量瘤体大小(cm3, 游标卡尺体外测量肿瘤长径L和短径S,根据公式V=1/2LS2 ,粗略计算肿瘤体积)。第二阶段:取正常6~8周龄雄性BALB/c小鼠80只,分为4组(20只/每组),分组及接种方法同上,每天9时清查死亡小鼠,观察小鼠生存时间。
1.4统计学分析

2 结 果
2.1DC形态学观察 培养过程中每天2次观察细胞形态,在第2~3天时见有集落形成;第4~5天,有部分树突状细胞从集落脱落下来,悬浮于培养基中;到第5~8天,有大量DC悬浮,CD11c磁珠分离典型的DC为低密度大细胞,圆形或不规则形,表面有丰富的伸长毛刺,悬浮不贴壁。其它特征见文献[3]。
2.2DC瘤苗的主动免疫作用
2.2.1各组三周时瘤体重量、体积和小鼠净重的变化 见表1


分组肿瘤重量瘤体体积小鼠净重AHIFU组1.83±0.931.29±0.9122.85±1.68B冻融组2.38±0.831.98±1.3921.05±2.36C单纯DC组2.96±0.762.93±1.2818.72±2.69D阴性对照组3.32±0.723.36±1.7216.75±1.75
注:四组瘤体重量:HIFU组、冻融组与单纯DC组、阴性对照组比较均有显著性差异(P均<0.01),HIFU组与冻融组比较亦有显著性差异(P<0.05);四组肿瘤体积:HIFU组、冻融组与单纯DC组、阴性对照组比较均有显著性差异(P均<0.01),HIFU组与冻融组比较亦有显著性意义(P<0.05);四组小鼠净重:HIFU组、冻融组与单纯DC组、阴性对照组比较均有显著性差异(P均<0.01),HIFU组与冻融组比较亦有显著性差异(P<0.05)。
2.2.2各组小鼠生存时间和生存率 见表2。
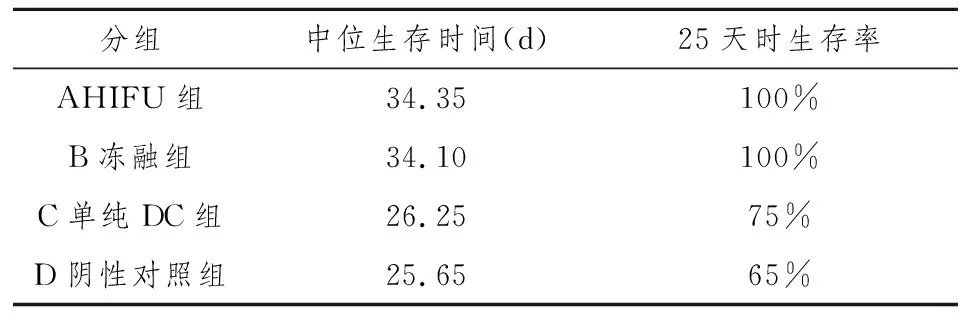
表2 各组小鼠生存时间和生存率(n=20)
注:HIFU组和冻融组与单纯DC组和阴性对照组生存时间比较:统计学均有显著性差异(P<0.01)。
3 讨 论
肿瘤的免疫治疗是继手术、放疗、化疗之后于20世纪90年代逐渐发展、成熟起来的一种新的肿瘤治疗方法。其基本理论依据是:通过调节或增强机体固有的内在性防御机制(主要为机体对肿瘤细胞的免疫监视和免疫排斥)来抑制或杀伤肿瘤细胞,或通过抑制肿瘤细胞转化,促进恶性细胞分化来降低肿瘤的恶性程度。树突状细胞是目前发现的功能最强大的专职抗原呈递细胞,由于其具有激活初始T细胞的能力,因而被认为是机体免疫的始动者,在抗肿瘤免疫方面起着重要的作用。表达高水平的共刺激分子,能在体内外直接激活初始T细胞,促进T辅助细胞和CTL的生成,也能促进B细胞生成抗体[4]。随着分子生物学技术和肿瘤疫治疗基础理论研究的发展,利用DC免疫特性对肿瘤进行物治疗已成为当今研究的热点[5-7]。DC疫苗即肿瘤特异性主动免疫治疗,在国内外发展十分迅猛,已有DC治疗黑色素瘤、肾癌、前列腺癌、肝癌、脑胶质瘤的临床报道。其基本原理是:通过体外分离、提取肿瘤特异性抗原或肿瘤相关抗原,制备不同形式的DC疫苗注射到肿瘤或肿瘤患者体内,使DC细胞充分发挥其抗源提呈能力,使机体T淋巴细胞致敏、活化,生成肿瘤特异性细胞毒性T淋巴细胞,专一性地结合并杀伤肿瘤细胞。
HIFU的作用机制主要是利用超声波可以穿透软组织并可以聚焦的物理特性,将体外电声换能器产生的多束超声波,借助水介质耦合进入人体并聚焦于体内肿瘤病灶内,在焦点处形成超声损伤区从而出现[8-9]:①高温效应:高强度聚焦超声可以在瞬间(0.5~1.0秒内)使聚焦区组织的温度升至65℃~100℃,产生不可复的凝固性坏死。②空化效应:组织中或细胞内的极微小气泡随着超声波不断交替的正负压而被压缩、膨胀,再压缩、再膨胀直至最后的崩溃,极微小气泡在崩溃时产生冲击波,使局部组织产生瞬间空化效应,造成细胞膜性结构(主要为细胞器)的不可逆损伤,甚至可以使细胞破碎。③机械效应:HIFU的机械震荡作用破坏了靶区细胞及其支持结构。④声化学效应:HIFU使细胞局部肿瘤细胞产生化学反应,例如使H2O分解为H+和OH-,损伤肿瘤细胞。⑤破坏肿瘤滋养血管:HIFU使可以破坏2 mm以下的小血管,使肿瘤组织发生继发性缺血坏死。虽然HIFU作用机制比较复杂,但其主要作用机制是高温效应和空化效应。
空化效应对肿瘤组织的直接破坏作用减轻了机体的肿瘤负荷,使肿瘤/宿主优势得以改善,激发了机体免疫系统的抗肿瘤效应。一方面可能增加膜脂流动性,使镶嵌在细胞膜脂质双层中的肿瘤抗原暴露增加,另一方面使肿瘤细胞破裂,细胞浆和细胞核内的肿瘤抗原充分暴露和释放,使细胞膜蛋白表达率增高,从而改变了肿瘤细胞的免疫原性,加强了机体对肿瘤组织的免疫反应,并且在HIFU治疗肿瘤的过程中,可促进肿瘤组织合成热休克(HSP),HSP可剌激机体免疫系统,提高机体免疫功能。同时CD4/CD8比例也有明显变化,提示HIFU治疗可以诱发宿主细胞免疫功能加强[10]。
目前主要使用的抗原类型有肿瘤特异抗原、肿瘤相关抗原、全细胞性抗原等。全细胞性肿瘤抗原易于获取和制备,有较大的临床应用潜力。全细胞性抗原因其获取方法不同可分为以下三种:①肿瘤细胞裂解物;②肿瘤细胞提取物;③未经处理的肿瘤细胞。本课题利用HIFU辐照CT-26肿瘤细胞获得肿瘤细胞裂解液(制备肿瘤抗原),加入到第5天培养扩增的DC悬液中共培养24小时,可制备出肿瘤全细胞DC疫苗。
本研究利用HIFU辐照肿瘤细胞负载DC,制备全肿瘤细胞DC疫苗。首先制备荷瘤小鼠模型,给小鼠接种同种族CT-26结肠癌细胞,7天后分别经腹腔注射HIFU辐照制备的DC瘤苗,一周后以相同剂量加强治疗,观察肿瘤生长情况。三周后处死小鼠,剥离肿瘤,称重及测量大小结果显示,HIFU组、冻融组、单纯DC组、阴性对照组四组肿瘤重量(g)、体积(cm3)小鼠净重两两相比,均有显著性差异。说明HIFU辐照法及反复冻融法制备的DC疫苗能够有效地抵抗肿瘤的生长,使肿瘤生长慢,重量、体积较阴性对照组小,并且HIFU辐照法制备的DC疫苗抗肿瘤作用有大于冻融法。造成这种趋势的原因还不十分清楚,可能是因为HIFU辐照法具有高温和空化等多种效应,获取的肿瘤细胞裂解液使抗原暴露得更充分,或者可以产生多种复杂的抗原(HSP、三分子复合体等)[11],从而提高了肿瘤细胞的免疫原性,能够更有效地致敏DC,刺激T细胞发挥抗肿瘤作用。
四组小鼠“主动治疗”后的生存时间的评估,用Kruskal-Wallis 生存分析,结果显示,HIFU组中位生存时间为34.35天,冻融组中位生存时间为34.10天,生存时间明显延长, 两组生存时间没有显著性差异。单纯DC组,阴性对照组中位生存时间分别为26.25天和25.65天,接种肿瘤细胞30天时,小鼠全部死亡。前两组和后两组比较差异有显著性意义(P<0.05)。说明HIFU辐照法和反复冻融法制备的瘤苗均有一定的治疗作用,可以明显延长小鼠的生存时间。
总之,本试验采用HIFU辐照法制备的肿瘤抗原负载DC的方法是“肿瘤全细胞抗原负载DC”方法的一种,即“肿瘤细胞裂解液负载DC”法。用HIFU辐照法制备的DC瘤苗,对肿瘤具有良好的治疗作用,可以提高小鼠的生存质量,延长小鼠的生存时间。为此我们有理由相信:随着许多高新技术的出现,各种理论和技术的交叉、融合、渗透;随着HIFU作用机理的深入研究、治疗机型的不断改进以及基础和临床应用的不断深入开展;随着对DC基础研究的不断深入和临床上的应用,HIFU辐照法获取肿瘤抗原致敏DC,制备的全肿瘤细胞DC疫苗将成为临床预防和治疗肿瘤重要方法。更重要的是可以进一步设想,由于HIFU治疗肿瘤时,辐照肿瘤组织,促进肿瘤抗原的暴露,在治疗时单纯接种DC又可起到肿瘤疫苗作用。从而为HIFU的广泛、深入应用提供依据,为肿瘤顽症治疗开辟新途径。
[1] 叶欣, 邹玉红,刘丽霞,等. 高强度聚焦超声制备肿瘤抗原致敏DC及其体外诱导T细胞产生IFN-γ的研究 .中华医学超声杂志(电子版),2006,3:5-10.
[2] 叶欣,刘爱华,宋文刚,等. 人脐血清代替胎牛血清体外培养脐血树突状细胞.中国输血杂志, 2004, 17:317-319.
[3] Kennedy JE. High-intensity focused ultrasound in the treatment of solid tumours Nat Rev Cancer. 2005,5(4):321-327.
[4] KashefE,RobertJP,TraversariC.Transplantation for hepatoce lluar carcinoma[J].Semin Oncol,2001,10:497.
[5] BarnettCC,CurleySA.Ablative techniques for heapto Cellular carcinoma[J].SeminOncol, 2001,28(5):497.
[6] KumamotoT,MoritaA,LisaH.Recent advances in den Dritic cell vaccines for cancertreatment[J].Dermatol,2001,28(11):658.
[7] 叶欣,费兴波,何申戌. 高强度聚焦超声治疗肿瘤[J]. 国外医学(肿瘤学分册), 2004,31:38-40.
[8] Shwan Ahmed,Bronagh Lindsey and John Davies. Emerging minimally invasive techniques for treating localized prostate cancer[J]. BJU International 2005,96:1230- 1234.
[9] 邹玉红,叶欣.高强度聚焦超声热疗与肿瘤免疫[J].中华医学超声杂志(电子版),2005,2:45-47.
[10] 司海鹏,向理科,王震等.高强度聚焦超声治疗VX2 骨肿瘤的免疫变化[J].中华实用外科杂志,2003,20(9):823-824.
[11] Zhenlin Hu, Xiao Yi Yang,Yun bo Liu,etal.Release of endogenous danger signals from HIFU-treated tumor cells and their stimulatory effects on APCs. [J]Biochemical and Biophysical Research Communications 2005 ,335:124-131.
- 山东第一医科大学(山东省医学科学院)学报的其它文章
- 康复新液治疗复发性口腔溃疡临床观察*

