木霉制剂对海州香薷生长和铜吸收的影响
田 晔 ,滕 应,赵 静,李振高,马文亭 ,张明旭 ,骆永明 ,3* (.安徽理工大学地球与环境学院,安徽 淮南 300;.中国科学院南京土壤研究所,土壤环境与污染修复重点实验室,江苏 南京 0008;3.中国科学院烟台海岸带研究所,山东 烟台 64003)
铜(Cu)是生物体内基本的微量营养元素之一,但过量的Cu会对生物体产生毒性[1].植物修复是Cu污染土壤修复的重要手段之一[2-3].海州香薷(Elsholtzia splendens Nakai)是中国原生Cu耐性/富集植物,因其生物量较大且对 Pb、Zn污染土壤亦有较强适应性,成为目前Cu污染土壤修复的常用植物[4-5].但高Cu浓度引起的植物生长缓慢,生物量小甚至死亡及土壤Cu有效性低等问题限制了海州香薷对Cu的提取[6-7].目前微生物强化已是植物修复研究的热点[8],微生物可通过促进植物生长和提高植物对重金属吸收能力两方面增强植物对土壤重金属的积累量[8-9],达到强化重金属污染土壤的植物修复的目的.目前,用于强化植物修复效应研究的微生物主要为具重金属抗性的细菌和真菌.细菌主要见于植物促生细菌(PGPR),真菌主要见于丛枝菌根真菌(AMF)[10].Cu污染土壤通常pH值偏酸性,而真菌比细菌更适应酸性环境.但由于丛枝菌根真菌难分离纯化及纯培养,一定程度上限制了其应用.木霉属(Trichoderma)真菌在土壤中分布广泛、生物量大,环境适应性强,在酸性土壤上生长良好,且易于分离纯化和培养,目前主要在农业生产中用于促进植物生长、诱导植物产生抗病性等[11-12].另外,Anand等[13]、沈薇等[14]和胡亮等[15]研究表明,木霉在摇瓶条件下对重金属Cu、Pb和Zn均有较强抗性.因此推断木霉属真菌具有强化Cu污染土壤的植物修复效应的潜力.
里氏木霉 FS10-C(Trichoderma reesei FS10-C)是本课题组从Cu污染土壤中筛选出的1株抗Cu木霉,白色棉絮状菌丝、绿色孢子、产黄色素,已送由中国微生物菌种保藏管理委员会普通微生物中心保藏(保藏编号:CGMCC NO.3970).目前国内外关于木霉与植物生长及木霉与重金属关系的研究常见于哈茨木霉(Trichoderma harzianum)、绿色木霉(Trichoderma virens)和深绿木霉(Trichoderma atroviride)[16-18],尚未见关于里氏木霉对海州香薷生长和重金属吸收影响的相关研究.本课题组前期研究证实,该株木霉具ACC脱氨酶、解磷作用和产铁载体等促生活性;且摇瓶条件下,在pH值2~10,Cu浓度≤600mg/kg时均可生长发育,100mg/kg和200mg/kg浓度下Cu积累率分别可达50.6%和30.3%;另外,课题组前期对该株木霉的生物安全性评价研究亦表明该菌及其代谢产物均对人畜无害.由此推测里氏木霉FS10-C可作为一株强化Cu污染土壤植物修复作用的候选菌.
为便于保存和施用,拟将该株木霉制备成固体生物制剂.许传坤等[19]的研究表明,向土壤中添加额外能源物质及其他有机物质能降低或全部解除土壤对木霉的抑制作用.据此,经前期固体基质的物料筛选,本研究选择苜蓿粉作为固体基质制备木霉制剂并采用温室盆栽试验,探讨施加木霉制剂对外源Cu土壤上海州香薷生长及Cu吸收能力的影响.以期为海州香薷修复Cu污染土壤提供参考.
1 材料与方法
1.1 材料
供试土壤为南京栖霞山无污染的黄棕壤,风干研磨过2mm筛.土壤pH值6.6,有机质含量21.3g/kg,碱解氮含量162.3mg/kg,速效磷含量11.7mg/kg,速效钾含量 82.2mg/kg,阳离子交换量16.5cmol/kg, Cu全量30.0mg/kg, Zn全量77.4mg/kg, Pb全量87.4mg/kg,Cd未检出.
海州香薷种子采自铜陵铁头山铜矿区.
Cu污染土壤的制备:外源添加不同浓度CuSO4·5H2O,拌入基肥(尿素、磷酸氢二钠和氯化钾按N:0.15g/kg, P:0.10g/kg土,K:0.30g/kg施入).调节土壤水分至田间持水量的60%,老化15d后制备成0, 100, 200, 400mg/kg外源Cu浓度土壤.
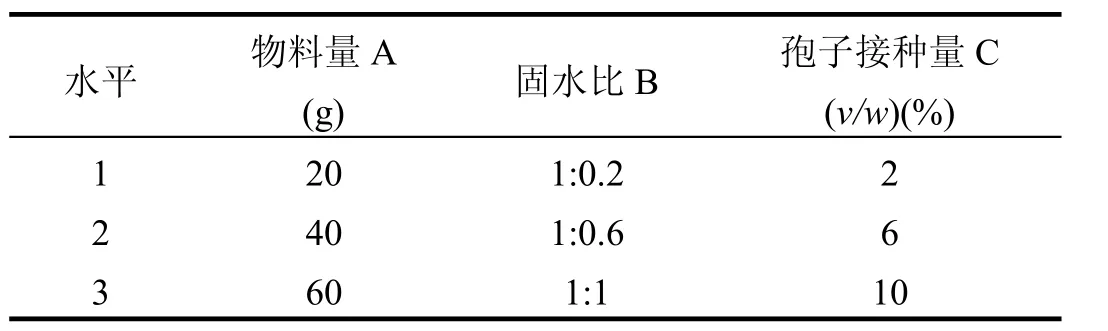
表1 木霉制剂发酵条件正交试验的因素与水平Table 1 Factors and levels of orthogonal experiments for optimizing fermentation conditions of Trichoderma sp.preparation
木霉制剂的制备:木霉制剂由本实验室筛选保存的抗铜里氏木霉FS10-C的孢子悬液经灭菌苜蓿粉固体发酵制成.发酵条件经正交试验设计优化筛选.筛选方案是:选取物料量(A)、固水比(B)和孢子接种量(C)3个因素,每个因素设3个水平,按照制剂孢子浓度筛选最佳发酵条件.各因素与水平设置见表1.发酵过程为:把苜蓿粉按一定固水比加入去离子水(表1),调匀后装入直径15cm玻璃培养皿中,灭菌制成灭菌基质.无菌条件下,接种定量的孢子悬液(106cfu/mL)于灭菌基质中(表1),28℃恒温培养,第3d起每天搅动1次,7d后混匀待用.木霉制剂采用血球计数板计数孢子浓度(cfu/g),4℃保存待用.
1.2 盆栽试验设计与实施
每盆2.5kg土.每个土壤外源Cu水平均设3个处理:空白(只种海州香薷)、灭菌基质 (种海州香薷+施加灭菌苜蓿粉)、木霉制剂(种海州香薷+施加木霉制剂),每个处理 3个重复.按土壤质量的4%将木霉制剂拌入土壤中,表层覆土平衡 3d后播种.海州香薷的种子用75%的乙醇消毒,无菌水冲洗.采用培养皿法发芽,待种子露白萌发后播入盆中,每盆播 15粒.播种后每天补充去离子水达田间持水量的60%,待苗齐、苗壮后定苗.盆栽试验在温室进行,6月19日播种,10月20日收获.
1.3 盆栽试验测定指标和方法
海州香薷收获前测株高,分地上部和根分别收获.植物样用自来水和去离子水冲洗后擦干,105℃下杀青 30min,80℃烘干至恒重后,分别测量植物地上部和根干重(g).将地上部和根分别用不锈钢粉碎机粉碎,HNO3-HClO4(3:2,V/V)消解后测Cu浓度.土样风干过20目筛,与 1mol/L NH4OAc(pH值7)混合(土液比1:5),180r/min震荡16h,3600r/min离心5min,上清液过滤测土壤有效态Cu含量.Cu含量采用火焰原子吸收分光光度计测定.
1.4 数据分析
采用EXCEL2003和SPSS 12.0进行图表制作和方差分析等数据处理.
2 结果与分析
2.1 木霉制剂制备的最佳条件
正交试验结果显示,木霉制剂发酵的最佳条件为A1B3C2,即物料量 20g、固水比为1:1和孢子接种量为6%时发酵效果最佳.木霉制剂为绿色,孢子含量大于109cfu/g.
木霉对营养的要求不严格,可分解利用纤维素、半纤维素、几丁质等为碳源[12].苜蓿含丰富的碳水化合物、多种矿物元素及维生素[20],具备木霉增殖所需的营养条件.本研究结果证实,以灭菌苜蓿粉为基质,不同于一般的泥炭等基质仅机械地将微生物吸附于基质上,而是以苜蓿粉为营养来源和繁殖场所进行木霉增殖,可通过颜色深浅初步判断木霉制剂孢子含量,施用方法可参照一般固体菌肥.因此该里氏木霉制剂具有制备方法简单、孢子密度大且易施用等应用优点.
2.2 木霉制剂对海州香薷生长的影响
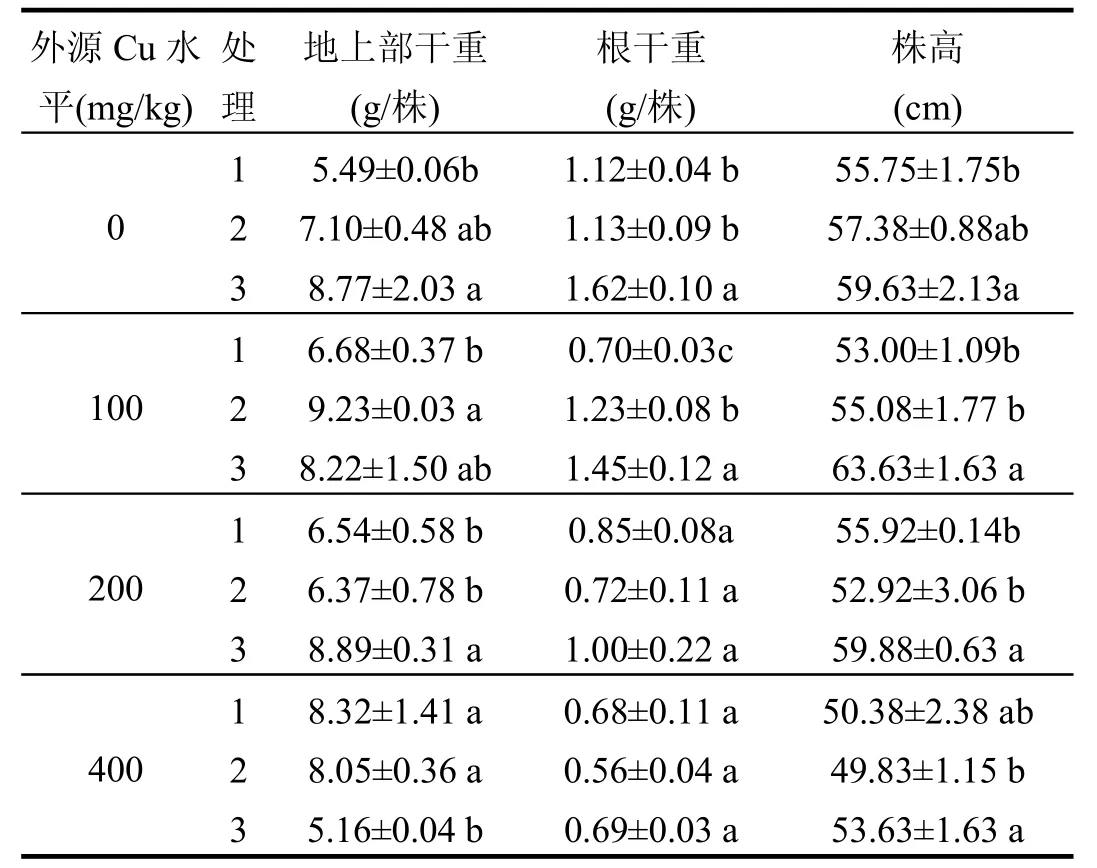
表2 木霉制剂对海州香薷生物量的影响Table2 Effect of Trichoderma.sp preparation on biomass of Elsholtzia splendens
施加木霉制剂后,除400mg/kg外源Cu土壤上地上部干重外,各Cu处理下,香薷生物量均呈增加趋势(表2).其中与空白组相比,未加Cu时株高、地上部干重和根干重分别增加7.0%、59.8%和44.2%(P<0.05), 100mg/kg外源Cu土壤上株高和根干重分别增加20.0%和108.5%(P<0.05),200mg/kg外源Cu土壤上株高和地上部分别增加7.1%和35.9%(P<0.05).
结果表明该木霉制剂在无污染和低Cu污染土壤上下可促进海州香薷茎叶和根系发育,具有促进海州香薷生长的作用且主要是里氏木霉FS10-C作用的结果.Hoyos-Carvajal等[21]和Contreras-Cornejo等[22]的研究表明,木霉属真菌具解磷能力,可产铁载体、吲哚乙酸(IAA)和赤霉素等促生物质.Rudresh等[23]发现木霉菌可在液体培养条件下溶解难溶性磷酸盐,提高植物对磷元素的利用,改善土壤的营养环境,促进植物生长.本课题组前期研究证实里氏木霉 FS10-C具ACC脱氨酶、解磷和产铁载体等促生活性,而本研究显示出的里氏木霉FS10-C对海州香薷生长的促进可能与该株木霉的这些促生活性有关.
400 mg/kg外源Cu土壤上,木霉制剂组根干重和株高增加不显著,且地上部生物量反而低于空白对照,可能与此时木霉制剂极显著提高了海州香薷的Cu积累量,在一定程度抑制了海州香薷的生长和根际土著微生物有作用,使海州香薷生物量未见显著增加.
而灭菌基质组海州香薷仅在不加Cu和100mg/kg外源Cu土壤上生物量有高于空白组的趋势,且除 400mg/kg 外源Cu土壤上地上部干重显著高于木霉制剂组外(P<0.05),其余生物量指标均呈小于木霉制剂组的趋势.这是由于灭菌基质由苜蓿粉制成,施加苜蓿粉相当施加有机物料.在无外源Cu和低外源Cu水平(≤100mg/kg)土壤中,苜蓿粉分解释放有机质可加强海州香薷根际的土著土壤微生物、土壤酶及土壤激素等促进植物生长的活性.但随着Cu浓度升高,土壤中土著微生物数量减少或死亡且伴随土壤酶和土壤激素等逐渐失活,失去其促进植物生长的活性.
2.3 木霉制剂对Cu污染土壤有效态Cu的影响
施加木霉制剂,各浓度外源Cu土壤NH4OAc提取态Cu含量分别增加42.9%、48.0%和27.5%(图1),均显著高于空白组(P<0.05).而灭菌基质组土壤Cu有效性均显著降低(P<0.05).
结果表明,木霉制剂可提高土壤Cu有效性,发挥土壤Cu活化作用.而灭菌基质组土壤Cu有效性的降低则提示灭菌基质在一定程度上起到钝化土壤Cu的作用.这可能是灭菌苜蓿粉作为有机物料,可降低土壤外源Cu的有效性,其结果与王果等[24]、陈建斌等[25]和陆晓辉等[26]加入稻草、紫云英、玉米秸秆等土壤Cu的重金属有效性降低的研究结果一致.由此也可推断该木霉制剂对土壤Cu的活化作用是由里氏木霉FS10-C及其代谢产物的作用产生.
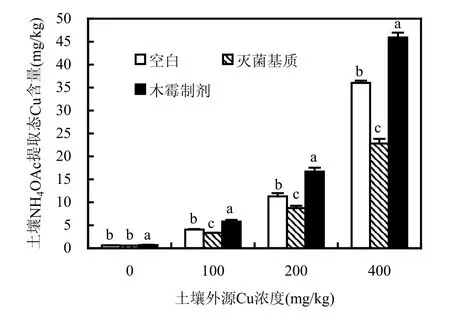
图1 木霉制剂对Cu污染土壤Cu有效性的影响Fig.1 Effect of Trichoderma.sp preparation on Cu phytoavailability of Cu contaminated soil
文献报道木霉代谢过程可产生如柠檬酸等有机酸代谢产物[13,27].本课题组对里氏木霉FS10-C的前期研究发现,该株木霉在液体培养过程中降低了培养基pH值,可能是该株木霉在生长过程中产生的酸性代谢产物导致.据此推测木霉FS10-C对土壤Cu的活化作用可能是与木霉FS10-C代谢过程产生的铁载体和有机酸等生物源螯合剂与土壤Cu发生螯合作用的结果[28],其具体机制有待于进一步研究.
2.4 木霉制剂对海州香薷Cu含量的影响
如图2所示,施加木霉制剂后,海州香薷地上部Cu含量在200,400mg/kg外源Cu土壤上均呈增加趋势,且在400mg/kg外源Cu土壤上高于空白组112.0%(P<0.05);根Cu含量在100,400mg/kg外源Cu土壤上分别显著高于空白组22.4%和13.3%(P<0.05).
而灭菌制剂组,海州香薷根Cu含量在各添加各外源Cu浓度土壤上均呈降低趋势;地上部Cu含量仅在200mg/kg外源Cu土壤上时增加,但差异不显著(P>0.05).
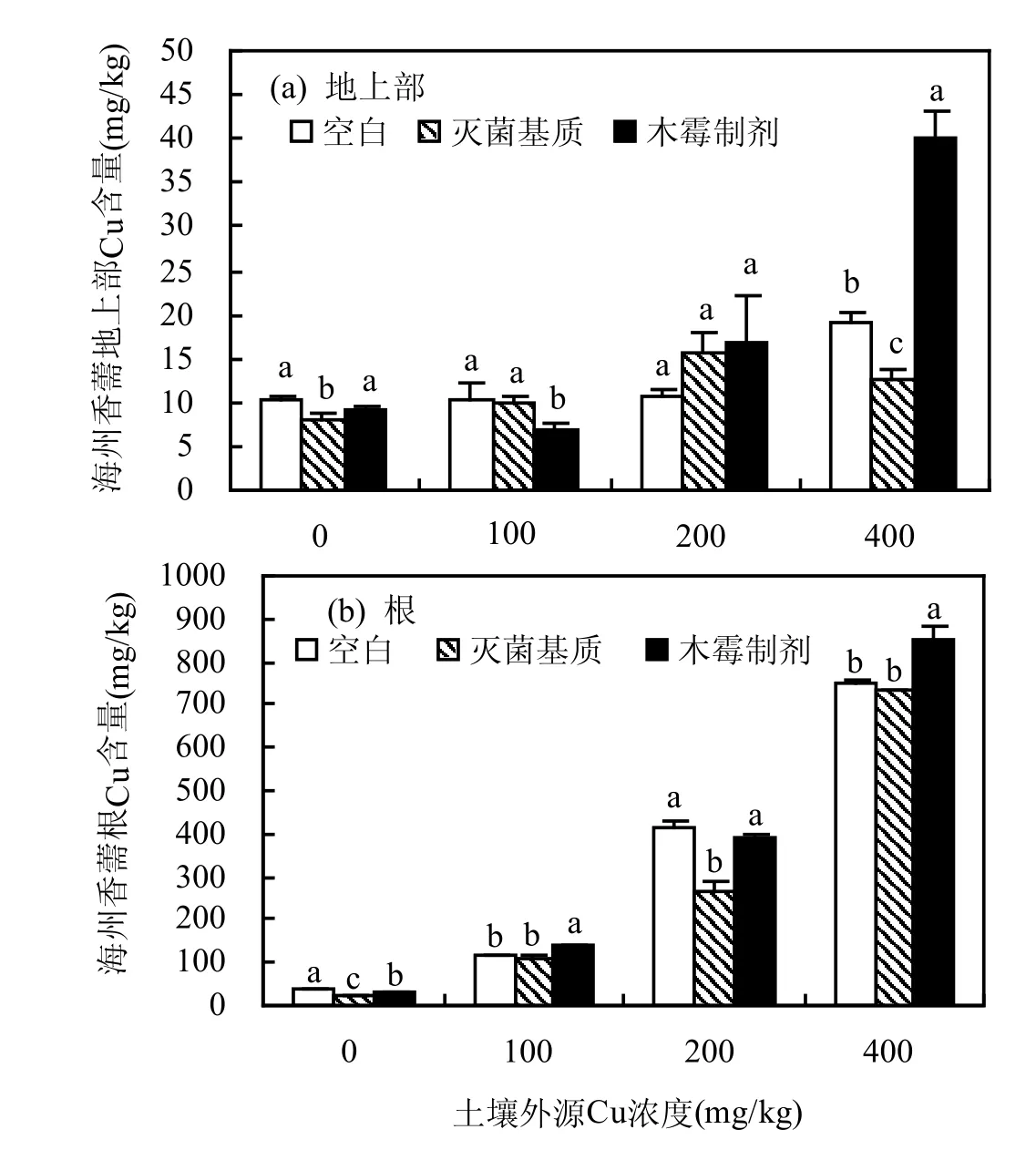
图2 木霉制剂对Cu污染土壤上海州香薷Cu含量影响Fig.2 Effect of Trichoderma sp. preparation on Cu concentration of Elsholtzia splendens
2.5 木霉制剂对海州香薷Cu积累量的影响
施加木霉制剂后,在各外源Cu浓度土壤上单株海州香薷Cu积累总量均呈增加趋势(图3).且在0,100, 400mg/kg外源Cu土壤上分别比空白组显著增加 32.9%、75.3%和19.9%(P<0.05).其中,根Cu积累量在0, 100, 400mg/kg土壤上分别增加16.9%、155%和16.0%(P<0.05);地上部Cu积累量在 0,200,400mg/kg外源Cu土壤上分别增加44.7%、114.3%和32.5%(P<0.05),而在 100mg/kg外源Cu土壤上下降16.1%,但差异并不显著.
100mg/kg外源Cu土壤上,木霉制剂组海州香薷地上部Cu积累量虽略有下降的原因,推测与此时木霉在土壤中活性较高相关.一方面,木霉制剂通过提高海州香薷生物量和土壤Cu有效性极显著提高了根Cu积累量;另一方面,由于木霉对Cu的吸附作用对海州香薷根部的Cu产生固持作用,因此限制了根Cu向地上部的转移,导致地上部Cu积累量略有下降,这其实也是该株木霉增强海州香薷Cu抗逆性的体现之一.
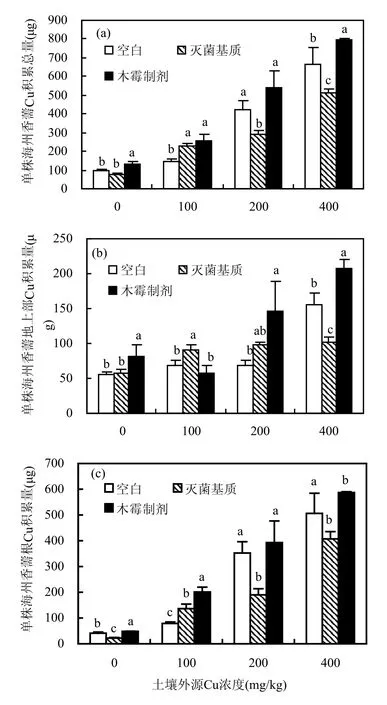
图3 木霉制剂对Cu污染土壤上海州香薷Cu含量影响Fig.3 Effect of Trichoderma sp. preparation on Cu accumulation of Elsholtzia splendens
灭菌制剂组,单株总Cu积累量和根Cu积累量仅在100mg/kg外源Cu土壤上增加,而在200,400mg/kg外源Cu土壤上均显著降低(P<0.05).且除100mg/kg外源Cu土壤上地上部外,所有Cu积累量指标均低于木霉制剂组.可见木霉制剂对海州香薷Cu积累作用主要是里氏木霉FS10-C及其代谢产物的作用.
3 结论
3.1 施加木霉制剂可在无污染,100和200mg/kg外源Cu土壤上提高海州香薷株高以及地上部和根的生物量,促进海州香薷生长.
3.2 木霉制剂具有活化土壤Cu作用,在100和400mg/kg外源Cu土壤上可不同程度提高海州香薷整株、地上部和根的Cu积累量(除100mg/kg外源Cu土壤上,地上部Cu积累量略有降低外).
3.3 里氏木霉 FS10-C制剂可通过促进海州香薷生长和提高土壤Cu的植物有效性增强海州香薷Cu吸收能力,强化海州香薷对Cu污染土壤的修复效应,是一种颇具研究潜力的生物修复剂.
[1]Yang X E, Long X X, Ni W Z, et al. Assessing copper thresholds for phytotoxicity and potential dietary toxicity in selected vegetable crops [J]. J. Environ. Sci. Health B, 2002, 37(6):625- 635.
[2]施 翔,陈益泰,吴天林,等.7个柳树无性系在Cu/Zn污染土壤中的生长及对Cu/Zn 的吸收 [J]. 中国环境科学, 2010,30(12):1683-1689.
[3]骆永明.污染土壤修复技术研究现状与趋势 [J]. 化学进展,2009,21(2/3):558-560.
[4]施积炎,陈英旭,林 琦,等.根分泌物与微生物对污染土壤重金属活性的影响 [J]. 中国环境科学, 2004,24(3):316-319.
[5]Song J, Zhao F J, Lou Y M, et al. Copper uptake by Elsholtzia splendens and Silene vulgaris and assessment of copper phytoavailability in contaminated soils [J]. Environ. Pollut., 2004,128:307-315.
[6]李锋民,熊治廷,胡洪营.海州香薷对铜的蓄积及铜的毒性效应[J]. 环境科学, 2003,24(3):30-34.
[7]倪才英,陈英旭,骆永明.土壤-植物系统铜污染与修复的研究进展[J]. 浙江大学学报(农业与生命科学版), 2003,29(3):237-242.
[8]Karami A, Shamsuddin Z. Phytoremediation of heavy metals with several efficiency enhancer methods [J]. African Journal of Biotechnology, 2010,9(25):3689-3698.
[9]滕 应,骆永明,李振高.污染土壤的微生物修复原理与技术进展 [J]. 土壤, 2007,39(4):497-502.
[10]Karimi A, Khodaverdiloo H, Sepehri M, et al. Arbuscular mycorrhizal fungi and heavy metal contaminated soils [J].African J. Microbiol. Res., 2011,5(13):1571-1576.
[11]Mas N, Kam A E, Mae H. Evaluation of Trichoderma species as biocontrol agents for damping-off and wilt diseases of Phaseolus vulgaris L. and efficacy of suggested formula [J]. Egypt J.Phytopathol., 2008,36(1-2):81-93.
[12]Vinale F, Sivasithamparam K, Ghisalberti E L. Trichodermaplant-pathogen interactions [J]. Soil Biol. Biochem., 2008,40(1): 1-10.
[13]Anand P, Isar J, Saran S, et al. Bioaccumulation of copper by Trichoderma viride [J]. Biores. Technol., 2006,97:1018- 1025.
[14]沈 薇,杨树林,李校堃,等.木霉(Trichoderma sp. )HR-1 活细胞吸附Pb(II)的机理 [J]. 中国环境科学, 2006,26(1):101-105.
[15]胡 亮,王吉坤,王鲁民.绿色木霉对 Zn2+的吸附特性研究 [J].化学与生物工程, 2007, 24 (8):38-40.
[16]Sharon E, Chet I, Spiegel Y. Trichoderma as a biological control agent [J]. Progress in Biological Control, 2011,11:183-201.
[17]Kredics L, D Czi I, Antal Z, et al. Effect of heavy metals on growth and extracellular enzyme activities of mycoparasitic Trichoderma strains [J]. Bulletin of Environmental Contamination and Toxicology, 2001,66(2):249-254.
[18]Yap C, Yazdani M, Abdullah F, et al. Is the high Cu tolerance of Trichoderma atroviride isolated from the Cu-polluted sediment due to adaptation? an in vitro toxicological study [J]. Sains Malaysiana, 2011,40(2):119-124.
[19]许传坤,莫明和,张克勤.土壤对木霉生防菌株的抑制作用及这种作用的解除 [J]. 南京师大学报, 2004,27(2):77-80.
[20]李志强,李新胜.苜蓿干草的碳水化合物营养特性 [J]. 中国奶牛, 2005,(1):34-36.
[21]Hoyos-Carvajal L, Ordua S, Bissett J. Growth stimulation in bean(Phaseolus vulgaris L.) by Trichoderma [J]. Biological Control,2009,51:409-416.
[22]Contreras-Cornejo H A, Macías-Rodríguez L, Cortés-Penagos C,et al. Trichoderma virens, a plant beneficial fungus, enhances biomass production and promotes lateral root growth through an auxin-dependent mechanism in Arabidopsis [J]. Plant Physiology,2009,149:1579-1592.
[23]Rudresh D L, Shivaprakash M K, Prasad R D. Tricalcium phosphate solubilizing abilities of Trichoderma spp. in relation to P uptake and growth and yield parameters of chickpea(Cicerarietinum L.) [J]. Canadian Journal of Microbiology, 2005,51(3):217-222.
[24]陆晓辉,黎成厚,涂成龙.有机物料对黄壤性质及外源铜有效性的影响 [J]. 安徽农业科学, 2009,37(6):2613-2616.
[25]陈建斌.有机物料对土壤的外源铜和镉形态变化的不同影响[J]. 农业环境保护, 2002,21(5):450-452.
[26]王 果,陈建斌,高 山.稻草和紫云英对土壤外源铜的形态及生态效应的影响 [J]. 生态学报, 1999,19(4):551-556.
[27]Benitez T, Rincon A M, Limon M C, et al. Biocontrol mechanisms of Trichoderma strains [J]. Int. Microbiol., 2004,7:249-260.
[28]Rajkumar M, Ae N, Prasad M N, et al. Potential of siderophoreproducing bacteria for improving heavy metal phytoextraction [J].Trends Biotechnol., 2010,28(3):142-149.

