低温脂肪酶基因在毕赤酵母中的表达研究*
刘 羽,王能飞*,黄亦钧,林学政,沈继红
(1.中国海洋大学,山东 青岛266003;2.国家海洋局 第一海洋研究所,山东 青岛266061;3.青岛康地恩生物科技有限公司,山东 青岛266061)
低温脂肪酶基因在毕赤酵母中的表达研究*
刘 羽1,2,王能飞1,2*,黄亦钧3,林学政2,沈继红2
(1.中国海洋大学,山东 青岛266003;2.国家海洋局 第一海洋研究所,山东 青岛266061;3.青岛康地恩生物科技有限公司,山东 青岛266061)
将已有的低温脂肪酶基因克隆至表达载体pPICZα上,并转化毕赤酵母X-33。在低温条件下诱导培养6d后,发酵液中可检测到低温脂肪酶活力。重组酵母发酵液加入二硫苏糖醇后单位酶活力达到32U/mL,与未加入该试剂的原始菌株相比提高4倍以上。对重组脂肪酶的酶学性质研究表明,其最适pH为8.0,最适温度为35℃,50℃温浴30min后,仍有30.04%的活性。以不同碳链长度的4-Nitrophenyl Ester为底物检测其底物特异性,结果显示其较适合作用于短链底物。重组酵母能够在BMMY培养基中胞外分泌表达带有His标签的重组脂肪酶,经镍柱纯化后,SDS-PAGE检测可得到大约35kDa的单一蛋白质条带。
低温脂肪酶;重组蛋白;毕赤酵母;组氨酸标签
脂肪酶(EC∶3.1.3.3)是一类水解油脂的酶类,可催化油水界面的甘油三酯水解生成甘油及长链脂肪酸。脂肪酶可应用于食品加工、油脂化学、精细化工、手性化合物拆分、高分子材料制备、生物柴油合成、去污剂添加剂等诸多工业领域[1]。工业中使用的脂肪酶多为中温酶,其最适作用温度为50℃。与中温酶相比,低温脂肪酶的优点是活化能较低,在低温条件下具有高酶活[2]。低温脂肪酶在节能环保方面具有良好的应用潜力,因而成为酶学研究新的热点。
迄今,已有部分低温脂肪酶基因被克隆并在大肠杆菌中表达[3]。然而,低温脂肪酶在大肠杆菌中易形成没有生物学活性的包涵体。如何实现该重组蛋白异源表达的高效性,依然是低温微生物应用研究领域的热点和难点。毕赤酵母表达系统是近年来发展迅速、应用广泛的一种真核表达系统[4]。毕赤酵母能将产生的外源蛋白分泌到培养基中,不会产生包涵体,有利于产物的纯化。另外,作为一种低等真核生物,毕赤酵母除了具有生长迅速、易于培养、遗传操作简单等原核生物的特点外,还能对外源蛋白进行糖基化、蛋白折叠和形成二硫键等翻译后修饰,有利于异源基因的高效表达[5-7]。现已有许多人如李娜,Holmquis等[8-9]成功将脂肪酶在该系统中高效表达。
本研究以南极菌株Psychrobactersp.G的低温脂肪酶基因为模板,利用PCR技术将该低温脂肪酶基因克隆至表达载体pPICZα中,成功构建可用于毕赤酵母表达系统的重组质粒并在毕赤酵母X-33中表达,从而为批量培养和实际应用奠定基础。
1 材料与方法
1.1 材 料
1.1.1 菌株和质粒
本研究所用菌株和质粒见表1。将所有E.coli菌株置于LB培养基中37℃培养。抗生素终浓度为:每毫升含氨苄青霉素100μg,博来霉素40μg用于选择大肠杆菌;博来霉素80μg用于重组的毕赤酵母工程菌。

表1 菌株和质粒Table 1 Strains and Plasmids
1.1.2 试 剂
TaqDNA聚合酶,DNA连接酶,各种限制性内切酶和DNA胶回收试剂盒均购自TaKaRa公司;其它化学试剂均为国产分析纯。
1.1.3 培养基
LB培养基:ρ(酵母膏)=5g/L;ρ(蛋白胨)=10g/L;ρ(NaCl)=10g/L;固体培养基加ρ(琼脂粉)=14 g/L;pH=7.0;
YPD培养基:ρ(蛋白胨)=20g/L;ρ(酵母粉提取物)=10g/L;ρ(葡萄糖)=20g/L;pH=5.8(用3 mol/L HCl调节),固体培养基中ρ(琼脂粉)=14g/L;
YPDS培养基:向YPD培养基中加入山梨醇,ρ(山梨醇)=180g/L;
BMGY和BMMY 培养基:ρ(蛋白胨)=20g/L;ρ(酵母粉提取物)=10g/L;ρ(YNB)=13.4g/L;c(pH6.0磷酸缓冲液)=100mmol/L;ρ(生物素)=4×10-4g/L;φ(甘油)(BMGY)=1%或φ(甲醇)(BMMY)=0.5%;
“万金油buffer”:C(Tris)=50mmol/L,pH=7.9;C(EDTA)=0.5mmol/L;C(NaCl)=50mmol/L;ρ(甘油)=50g/L。
1.2 方 法
1.2.1 PCR引物
根据脂肪酶基因序列(由林学政克隆提供,GenBank登录号为GU247897)设计引物:

以上引物由上海生工生物工程有限公司合成。
1.2.2 表达载体的构建
以948P1,948P2为引物,以质粒pUC118-Lip-948为模板,进行PCR扩增。PCR反应条件:95℃4 min;95℃40s,58℃40s,72℃1min,30个循环;72℃7min。PCR产物纯化后进行EcoRI/Xba I双酶切;同样,也对质粒pPICZα进行EcoRI和XbaI双酶切。然后切胶回收,将目的基因和载体于16℃过夜连接;然后转化E.coliDH5α,在低盐LB培养基(含40μg/mL博来霉素)上筛选转化子并进行菌落PCR验证转化子,获得表达载体pICZα-Lip。
1.2.3 在毕赤酵母中表达
利用SalI对载体pICZα-Lip进行酶切,然后切胶回收。制备毕赤酵母电转化感受态细胞;加5μL线性载体到80μL毕赤酵母感受态细胞培养液中,电击后的感受态细胞涂布于YPDS平板(含80μg/mL博来霉素);挑选转化子,利用特异引物(948P1和948P2)和毕赤酵母通用引物进行菌落PCR筛选阳性转化子。挑取阳性克隆接种于BMGY液体培养基中,30℃振荡培养过夜,3 000r/min离心5min收获菌体,再将其悬浮于BMMY培养基,20℃连续培养3~6d,每隔12h向BMMY培养基补加甲醇至终浓度0.5%,诱导重组低温脂肪酶的表达。
1.2.4 表达产物的SDS-PAGE分析
将重组酵母的发酵液于4℃,3 000r/min离心10min,保留上清液。取10mL上清液,进行亲和层析,纯化带有His-tag的重组低温脂肪酶:上清液与50%的Ni Sepharose 6Fast Flow填料混合,室温低速震荡1h。用结合缓冲液(每升含20mmol NaH2PO4,0.5mol NaCl,20mmol咪唑,pH7.4)洗去杂蛋白,用洗脱缓冲液(每升含20mmol NaH2PO4,0.5mol NaCl,500mmol咪唑,pH7.4)洗脱目的蛋白,进行SDS-PAGE检验蛋白纯度和测定脂肪酶活性。
SDS-PAGE电泳方法参照 Laemmli[10]的研究。
1.2.5 重组脂肪酶的性质
测定脂肪酶活性,选择酶活力较高的重组酵母,诱导培养后取其发酵液,检测其酶学性质。
1.2.5.1 最适作用pH
以4-Nitrophenyl Esters(C4)为底物,测试重组脂肪酶在不同pH条件下的酶活力。pH值5~7为磷酸钠缓冲液,pH值7~9为Tris-HCl缓冲液。
1.2.5.2 最适作用温度
选择最适作用pH,以4-Nitrophenyl Esters(C4)为底物,测定重组脂肪酶在不同温度条件下的酶活。
1.2.5.3 温度稳定性
将酶液分别在不同温度放置30min后取出,选择最适pH,以4-Nitrophenyl Esters(C4)为底物,在最适温度下测剩余酶活力。
1.2.5.4 最适作用底物
在最适作用pH,最适作用温度下,分别以不同C链长度的4-Nitrophenyl Esters作为底物,测定酶活。
1.2.6 重组低温脂肪酶的活性分析
参照中华人民共和国轻工业部颁布标准GB/T1803—93(2002)中工业酶制剂通用的试验方法,将温度设定为35℃。酶活单位定义:在反应条件下,每分钟水解三丁酸甘油酯释放出1μmol脂肪酸所需要的酶量为一个脂肪酶国际单位(IU)。
2 结果与分析
2.1 脂肪酶基因的PCR扩增
通过PCR扩增得到约1 000bp条带(图1);克隆后测序分析表明该序列与先前获得的低温脂肪酶序列一致。对PCR产物和质粒pPICZα分别进行EcoRI和XbaI双酶切;然后将回收的酶切产物连接过夜,获得表达质粒pPICZα-Lip。
2.2 脂肪酶基因在毕赤酵母X-33中的表达
pPICZα-Lip线性化后电转导入毕赤酵母X-33中,涂布于博来霉素质量浓度为80μg/mL的YPDS平板上,30℃放置3d后得到转化子。挑选6个转化子,利用特异引物(948P1和948P2)和毕赤酵母通用引物(5′AOX1primer和3′AOX1primer)进行菌落PCR验证转化子。结果表明特异引物扩增出约900bp目的条带(图2a);而通用引物(5′AOX1primer和3′AOX1primer)扩增出约1 500bp条带(图2b)。由于通用引物扩增含信号序列、目的基因和尾部His-tag标签,所以扩增条带大于目的脂肪酶基因。因此,所挑选的均为阳性菌落。对特异引物(948P1和948P2)扩增结果进行测序验证,测序结果表明扩增无误。
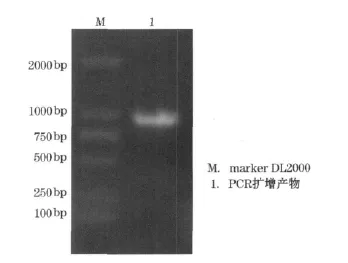
图1 PCR扩增的脂肪酶基因的琼脂糖凝胶电泳Fig.1 Agarose gel electrophoresis of gene encoding cold-adapted lipase by PCR

图2 菌落PCR验证Fig.2 Confirmation of recombinant P.pastoris Colonies PCR
2.3 转化酵母的诱导表达
将1株带有抗性基因的阳性重组菌落命名为P.pastorisLip-1。对转化子 Lip-1进行诱导表达利用0.5%甲醇诱导6d,于4℃3 000r/min离心10min,然后取上清。经镍柱纯化,电泳显示获得目的重组蛋白,分子量在35kDa左右,与预测低温脂肪酶分子量一致(图3)。
2.4 重组低温脂肪酶的酶活分析
以4-Nitrophenyl Esters为底物,测定诱导培养上清液的脂肪酶活性。结果显示,对照菌株X-33中也存在一定的酶活,约为0.4IU;而重组菌株Lip-1上清酶活达15IU,说明重组脂肪酶成功实现了表达。加入还原剂DTT,则使酶活增加了1倍(表2)。在某些情况下,EDTA和甘油可能会对酶活力有促进作用,因此在测试酶活时也尝试将标准方法的缓冲液换成含有EDTA和甘油的“万金油buffer”。由实验结果来看,确实能对酶活力有一定程度的促进作用。

图3 纯化的重组脂肪酶SDS-PAGE分析Fig.3 SDS-PAGE analysis of purified recombinant lipase

表2 重组脂肪酶的活力检测Table 2 The detection of activity of recombinant lipase
2.5 重组低温脂肪酶的性质
以4-Nitrophenyl Esters为底物,研究不同pH值对Lip-1表达的重组脂肪酶酶活影响。结果显示,最适脂肪酶活性的pH值为8.0;pH值在7.0~8.5之间,脂肪酶活性都在最高活性的50%以上;当pH值大于9.0时,脂肪酶活性开始显著下降(图4)。最适温度分析显示,重组后脂肪酶的最适作用温度为35℃,且在15℃仍有约60%的酶活力,表现低温酶特性。在50℃孵育30min后仍有将近30%的酶活,温度稳定性较好(图5)。以不同C链(C4~C16)长度的4-Nitrophenyl Esters为底物检验重组脂肪酶底物特异性。结果显示,该重组低温脂肪酶降解短C链的4-Nitrophenyl Esters底物时脂肪酶酶活最高,而底物C链越长活性却越低;8C链活性为42%,12C链活性约为30%,18C链活性仅不到20%(见图6)。

3 讨 论
巴斯德毕赤酵母表达系统具有很多表达外源蛋白的优势,调控机理严格,分泌效率高,质粒能在基因组的特定位点稳定整合,重组转化筛选简单,易于进行高密度发酵,外源蛋白表达量高,还能对外源蛋白进行翻译后的修饰,并可将其分泌到培养基中,使分离纯化较为简便[11]。本研究中X-33表达出的活性脂肪酶,上清酶活力为32U/mL,比原始菌株提高1倍,表明毕赤酵母对本实验原始菌株Psychrobactersp.G来说,是一种有效的脂肪酶表达系统。
研究发现,加入一定量的DTT后可以使酶活有一定程度的提高,因为它能使蛋白质保持还原状态,更易使酶活中心暴露,起到稳定作用。本研究采用的“万金油buffer”对酶活力的提高有一定作用,是由于其含有甘油和EDTA,所以对蛋白质有保护稳定的作用。
Catoni报道的重组脂肪酶最适作用温度为25~37℃,高于37℃就急剧失活[12],而本研究中重组脂肪酶的最适作用温度为35℃,在50℃孵育30min后,仍能保持30%以上的酶活力,温度稳定性较好,最适作用pH值为8,比较适合作用于短链的底物。
本研究成功实现了低温脂肪酶在毕赤酵母中的表达,具有在实际生产领域中应用的潜力。下一步可以优化重组毕赤酵母的发酵条件,以降低培养成本并尝试在发酵罐中进行高密度发酵,为实现大规模发酵做准备。
(References):
[1]HASAN F,SHAH A A,HAMEED A.Industrial applications of microbial lipases[J].Enzyme and Microbial Technology,2006,39(2):235-251.
[2]LIU W L,ZHANG G H,CHEN Q,et al.Gene cloning and expression of a cold-adapted lipase fromBrachybacteriumsp.DB5isolated from glacier soil[J].Journal of Agriculture Science and Technology,2009,11(6):55-62.刘万利,张国华,陈强,等.冰川土壤来源Brachybacteriumsp.DB5低温脂肪酶基因的克隆与表达[J].中国农业科技导报,2009,11(6):55-62.
[3]JOSEPH B,RAMTEKE P,THOMAS G.Cold active microbial lipase:some hot issues and recent deveplopments[J].Biotechnol.Adv.,2008,26(5):457-470.
[4]XU S W,LIN Y,HAN Z L,et al.High level expression ofRhizomucor mieheilipase gene inPichia pastoris[J].Food and Fermentation Industries,2008,34(11):10-14.徐苏炜,林影,韩振林,等.米黑根毛霉脂肪酶基因在毕赤酵母中的高效表达[J].食品与发酵工业,2008,34(11):10-14.
[5]HONG F,MEINANDER N Q,JONSSON L J.Fermentation strategies for improved heterologous expression of laccase inPichia pastoris[J].Biotechnology and Bioengineering,2002,79(4):438-449.
[6]SREEKRISHNA K,BRANKAMP R G,KROPPK E,et al.Strategies for optimal synthesis and secretion of heterologous proteins in the methylotrophic yeastPichia pastoris[J].Gene,1997,190(1):55-62.
[7]ROMANOS M.Advances in the use of Pinchia pastoris for high-level gene expression[J].Current Opinion in Biotechnology,1995,6(5):527-533.
[8]LI N,YUAN L L,ZHANG W Y,et a1.The total gene synthesis ofAspergillus nigerlipase and the construction experssion inPcihia pastoris[J].Chemistry and Bioengineering,2010,27(6):45-49.李娜,袁利玲,张玮莹,等.黑曲霉脂肪酶全基因合成及其在毕赤酵母中的表达[J].化学与生物工程,2010,27(6):45-49.
[9]HOLMQUIST M,TESSIER D C,CYGLER M.High-level production of recombinant Geotrichum candidum lipases in yeastPichia pastoris[J].Protein Exp.Purif.,1997,11:35-40.
[10]LAEMMLI U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227(5259):680-685.
[11]FU J H,YAO B,YANG H M,et a1.Cloning and expression of a cold-adapted lipase gene fromGeotrichum candidumch-3inPichia pastoris[J].Biotechnology,2007,17(5):25-29.付建红,姚斌,杨浩萌,等.白地霉ch-3低温脂肪酶基因的克隆与表达[J].生物技术,2007,17(5):25-29.
[12]CATONI E,SCHMIDT-DANNERT C,BROCCA S,et a1.Overexpression of lipaseA and B ofGeotrichum candiduminPichia pastoris:High-evel production and some properties of functional expressed lipase B[J].Biotechnology Techniques,1997,11(9):689-695.
Expression of the Cold-adapted Lipase Gene inPichia pastoris
LIU Yu1,2,WANG Neng-fei1,2,HUANG Yi-jun3,LIN Xue-zheng2,SHEN Ji-hong2
(1.Ocean University of China,Qingdao 266003,China;2.First Institute of Oceanography,SOA,Qingdao 266061,China;3.Continent Biotech Co.Ltd.,Qingdao 266061,China)
The cold-adapted lipase(CAL)gene was inserted into expression vector pPICZα,and transferred intoPichia pastorisX-33.After 6dcultivation under low temperature,lipase activity was detected in the fermentation broth.The lipase activity in the cultures of recombinedPichia pastorisreached to 32U/mL after inducement with DTT.The enzyme activity increased more than four times compared to those without adding DTT.The optimal temperature and pH for lipase activity were 35℃and pH8,and 30.04%of lipase activity still retained after incubating at 50℃for 30min.The recombinant CAL showed a preference to shorter carbon chain than the medium and long chain when tested with 4-nitrophenyl esters.The CAL with His tag was secreted extracellularly by the recombinedPichia pastorisin the BMMY medium and being purified by Ni2+-NTA affinity chromatography.The purified protein showed a single band of about 35kDa on SDS-PAGE.
cold-adapted lipase;recombinant protien;Pichia pastoris;His-tag
Ocboter 7,2010
Q933
A
1671-6647(2012)01-0155-08
2010-10-07
国家高技术发展研究计划项目——极地特殊海洋微生物资源利用的关键技术研究(2007AA091905);海洋公益性行业科研专项——盐生植物生产纤维素乙醇与电厂废气联产生物柴油研究与示范(201005031),利用极地微生物生产低温纤维素酶关键工程化技术开发与应用研究(201005020-8),绿潮藻纤维素乙醇的制备技术研究(201105028-02);国家海洋局海洋生物活性物质重点实验室开放基金——南极冰藻L4Psbo基因在盐度和光照胁迫的表达差异研究(MBSMAT-2009-02);“十二五”国家科技计划课题——微藻减排燃煤烟气及二氧化碳和炼制生物柴油的关键技术和产业化示范(2011BAD14B04)
刘羽(1986-),女,山东枣庄人,硕士,主要从事极地微生物低温酶方面研究.E-mail:xixiyu117@163.com
*通讯作者,E-mail:wangnengfei@fio.org.cn
(王佳实 编辑)

