合成生物学在微生物传感器中的应用
施冬艳,何珣,陈怡露
(南京工业大学生物与制药工程学院,江苏南京 210009)
生物传感器[1]起源于20世纪中期,1962年Clark等[2]提出了把酶与电极结合来测定酶底物的设想,1967年Updike和 Hicks[3]研制出世界上第一支葡萄糖氧化酶电极,标志着生物传感器的诞生。生物传感器是一种精密的分析器件,它结合了一种生物或生物衍生敏感部件(如组织、微生物细胞、细胞器、细胞受体、酶、抗体、核酸等)与一只理化换能器(如电化学电极、光学检测部件、气敏电极、热敏电阻等),能够产生间断或连续的数字电信号,信号强度与被分析物含量成正比,从而对被分析物进行定量和定性的测定。根据生物敏感部件的不同,可以把生物传感器分类为组织传感器[4]、微生物传感器[5-6]、细胞器传感器[7]、免疫传感器[8]、酶传感器[9-10]、DNA 传感器[11],其中酶传感器和微生物传感器研究得最多,应用也最为广泛。
微生物传感器因为其成本低、操作简便、设备简单的特点而成为近年来生物传感器领域研究的热点,主要应用于生物工业[12-13]、环境监测[5]以及临床医学[14-15]等领域。谢佳胤等[16]曾指出,生物传感器商品化要具备以下条件:足够的敏感性和准确性、易操作、价格便宜、易于批量生产、生产过程中进行质量监测。表1比较了各种生物传感器选择性、稳定性等多项性能。
由表1可以看出,微生物传感器最大的优点是成本低、操作简便、设备简单,相比其他生物传感器具有独特的可取之处,因此其市场前景十分巨大和诱人。

表1 各种生物传感器的性能对比Tab 1 The properties of all kinds of biosensor
作者拟通过分析目前微生物传感器的研究手段和遇到的问题,探讨合成生物学这一新兴交叉学科在研究微生物传感器中的应用,并通过对应用实例的分析阐述其研究思路和发展前景。
1 微生物传感器
1.1 概念及原理
微生物传感器[17]是生物传感器的一个重要分支,它使用微生物活细胞或细胞碎片作为敏感材料,利用其体内的各种酶系及代谢系统来测定和识别被分析物,原理见图1。
如图1所示,微生物传感器的一般原理大致可以分为3种情况:(1)样品中的物质会诱导启动微生物细胞中特定的启动子,进而使得报告基因转录、翻译成可被检测的报告蛋白;(2)微生物与底物作用,在同化样品中有机物的同时,微生物细胞的呼吸活性有所提高,反应中会消耗氧或生成二氧化碳,两者都是可检测物质;(3)微生物与底物作用后生成各种可检测到的电极敏感代谢产物。在微生物数量和活性保持不变的情况下,它消耗的溶解氧量或所产生的电活性物质、二氧化碳、报告蛋白的量反映了被检测物质的量,再借助气体敏感膜电极(如溶解氧电极、氨电极、二氧化碳电极等)或离子选择电极(如pH玻璃电极等)以及微生物燃料电池检测出溶解氧和二氧化碳、电活性物质、报告蛋白的变化,便能得出待测物质的量。
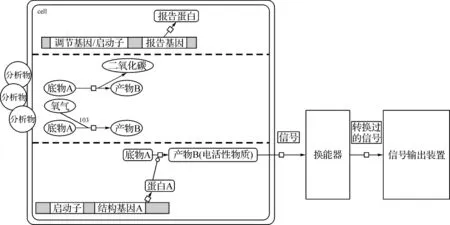
图1 微生物传感器工作原理示意图Fig 1 Principle of microbial sensor
1.2 微生物传感器研究面临的困难
微生物具有价格低廉、无需考虑辅助因素、微生物成分可再生等优点,尤其适用于发酵控制和需群酶顺序作用的反应。但是目前微生物传感器的制备仍然存在许多困难与不足之处,限制了它的进一步市场化[18]。如:(1)由于微生物细胞中含有多种酶,可同时对多种底物响应而产生干扰,使得微生物传感器的选择性不尽如人意,响应时间比酶传感器要长[19];(2)用于环境监测时测定对象中的毒害因素如重金属和有毒有机物是影响微生物寿命的关键因素[20],也是微生物传感器市场化的主要控制因素,但是目前筛选天然抗性菌株的工作量很大,且具有盲目性和局限性;(3)环境中污染物的数量越来越多,而目前构建的报告菌株的广谱性还远远不够;(4)由于微生物细胞保,输方式也有待改进。
为了解决上述问题,使微生物传感器能得到更好的应用和推广,需要更具创新性的理念和技术,特别是交叉学科的研究。合成生物学,这一曾被《Nature》杂志誉为是“将生物领域基础研究转化为实际社会生产力,连接基础学科与实际应用学科的高科技领域”[21],是近年来生物技术领域备受瞩目的新兴学科。合成生物学正是以设计合成人工基因组并制造出具有指定功能可自我繁殖的活细胞,完成或优化自然细胞所不能完成的任务为目标,有望为微生物传感器目前遇到的局限和困难提供创新性的解决办法[22-23]。
2 合成生物学
2.1 简介
2009《 · 》 “Focus on Synthetic Biology”的合成生物学专辑[24],包括社论、进展综述、前景展望、产业发展、专利产权、政府监管等16篇论文。社论指出:合成生物学通过计算机设计,用4种化学品(A、G、T和C 4种核苷酸)进行基因合成,然后“即插即用”到具有最小化基因组的底盘生物中,可以想象我们在将来能够毫不费力地创造不同形式的生命,这项突破性的技术具有改变生物工程的潜力。与基因工程把一个物种的基因延续、改变并转移至另一物种不同,合成生物学的目的在于建立人工生物体系,让它们像电路一样运行。
合成生物学领域有3大内容和目标:(1)有别于以往拆解生命的方式,其借由建构生命来了解生命,合成基因组简化的“底盘微生物”[25];(2)将基因工程、代谢工程等所使用的部件标准化[26],使其能与现有系统相结合,创造出更多功能更复杂的系统;(3)成为跨领域的交叉学科,将分子生物学、基因工程、计算机领域的系统设计和系统控制理论、统计学、信息学等应用到生物系统,开拓重组生物与工程的交集,产生真正可由程式控制的生物。
合成生物学发展的主要历程如表2所示。

表2 合成生物学主要发展历程Tab 2 The main development of synthetic biology
2.2 应用前景
基因工程注重重组DNA技术的产业化设计与应用,包括上游技术和下游技术两大组成部分。上游技术包括基因重组、克隆和表达的设计与构建(即重组DNA技术);下游技术则涉及基因工程菌或细胞的大规模培养以及基因产物的分离纯化过程。
而合成生物学的目标,则是试图采用从自然界分割出来的标准生物学部件(可被修饰、重组乃至创造),进行理性(设计)的重组(乃至从头合成)以获得新的生命(生物体)。
目前合成生物学应用最典型的例子就是Keasling研究小组合成青蒿素,他们对青蒿基因及其代谢途径进行了设计组装与精密调控,使得大肠杆菌及酵母细胞合成青蒿酸(青蒿素前体)的能力提高了几个数量级,大幅降低了青蒿酸的生产成本[29]。另外,MIT化工系Gregory研究组[32]运用合成生物学手段利用大肠杆菌合成紫杉醇,他们把紫杉醇代谢途径分成大肠杆菌固有的异戊烯焦磷酸上游模块和异源的萜类化合物
,水平,最终使得紫杉二烯(紫杉醇的前体物)产量较改造前提高了15 000倍。
合成生物学在其他领域也都具有不错的应用前景,包括新药研发和改进药物[33]、生物基产品制造[34-35]、可再生和可持续能源的利用[36]、环境污染的生物治理以及用于环境中检测有毒化学物质的生物传感器[37-38]等。
2.3 生物安全
合成生物学虽具有巨大的生命力和广阔应用前景,但随着这个领域的发展,合成生物学的安全性问题也越来越多,包括致病感染性疾病的威胁[39]、生态平衡的破坏[40]以及伦理、法律[41]等。我们在看到合成生物学的美好前景的同时,也要认真应对这些潜在风险[42],制定并完善合成生物学法规体系与管理制度,预防恶意的行为,周到地考虑对人类、其他物种、自然界环境的影响。
2010年美国生物伦理研究委员会发表了《新方向:合成生物学和新出现技术的伦理》的研究报告[43]、 、可。《自然》、《科学》等杂志,《纽约时报》等媒体,“生物工业组织”等产业协会也作出了积极的反应。这些都为合成生物学的发展提供了极好的氛围和机会。在各国相关法规约束以及各国科学家自身努力下,合成生物学一定会得到更快、更健康的发展。
2.4 合成生物学在微生物传感器中的应用
2.4.1 应用思路 就合成生物学的研究内容和目标,我们可以看出其技术思路有望突破目前微生物传感器研究中遇到的一些局限,为微生物传感器的发展作出新贡献[44-45],比如说:
(1)相关领域的研究者们一直在寻找选用能对污染物起响应的更加特异和有效的新调控部件[46-47],在未来我们可以运用这些生物部件提高微生物传感器的灵敏性。
最小基因组的研究也给微生物传感器带来了新的进展,最小基因组可以减少背景噪音,提高微生物传感器的选择性。而提高微生物传感器的灵敏性和选择性都能减少响应时间。
(2)对环境中的有毒有机物,我们可以找到相关的酶并对其进行强表达,将解毒和报告结合起来,既解除环境中有毒物质对微生物细胞的生存危害又能检测到有毒物。
(3)为了解决保存和运输的问题,我们可以尝试选用孢子微生物,然后用孢子作为微生物传感器的保存形式[38,48]。
(4)合成生物学的思路是将“基因”或者生物部件连接成网络。我们可以尝试将两个报告基因这样的部件组装在一起形成双报告基因,这样可以拓宽微生物工程菌株的检测范围,提高传感器的广谱性和方便性。
2.4.2 应用实例 目前,国际上已经开展了应用合成生物学开发微生物传感器的相关研究,其中一个例子就是爱丁堡大学的Joshi研究小组设计和构建出的一种能够监测水中砷含量的工程菌[38]。而在爱丁堡大学之前已有许多研究者从酶学和生物学的角度对砷检测进行了研究。其中一种方法是用乙酰胆碱酯酶(Ach)做成的电极来感应砷,Sanllorente-Mendez等[49]用该法研究出可以检测到1.1×10-8mol·L-1砷的Ach/SPCE生物传感器,虽然这一研究很成功,但是4℃的保存条件使得这一装置很难运输。而Sarkar等[50]将L-半胱氨酸用聚丙烯酰胺固定在工作的电极上,以此来检测砷浓度,砷的检测浓度低至1~30 μg·L-1且和信号呈线性关系。但是,该装置中昂贵的铂电极为这一装置的商业化带来很大的困难[51]。而微生物传感器为这些问题的解决提供了可能性[52]。Tani等[53]利用带有ars启动子和gfp的重组大肠杆菌制成了一种微生物传感器系统,但该装置需要紫外系统来读出结果,限制了它的方便性。而Yoshida等[54]运用一种光合细菌Rhodopseudomonas palustris作为出发菌株,该菌在响应砷污染物时会发生肉眼可见的颜色变化,但该结果只起到了定性的作用。上述研究虽颇有成就,但是还不能满足一个优良的微生物传感器所需的条件,即成本低、简单、保存方便、高选择性、可在贫困地区使用等。爱丁堡大学的研究成果突破了原先的局限,为微生物传感器的发展打开了新局面。
爱丁堡大学的Joshi利用具有感知水中砷离子功能的启动子,设计了相应的微生物传感器。该启动子在有砷离子存在的情况下能改变细胞的代谢反应,并最终改变溶液的pH。利用微生物作为检测器,不仅可以大大降低成本,且较之其他砷离子检测器而言,利用pH的变化作为砷离子存在与否的信号很容易被pH检测仪甚至更方便的pH试纸检测到,使仪器的实用性得到极大的提高[38]。
该砷离子生物检测系统[55]如图2所示,整个系统只有在砷离子或乳糖存在时才有响应。装置1中的启动子3为组成型常开启动子,下游lacI基因表达的产物LacI抑制启动子4的启动。
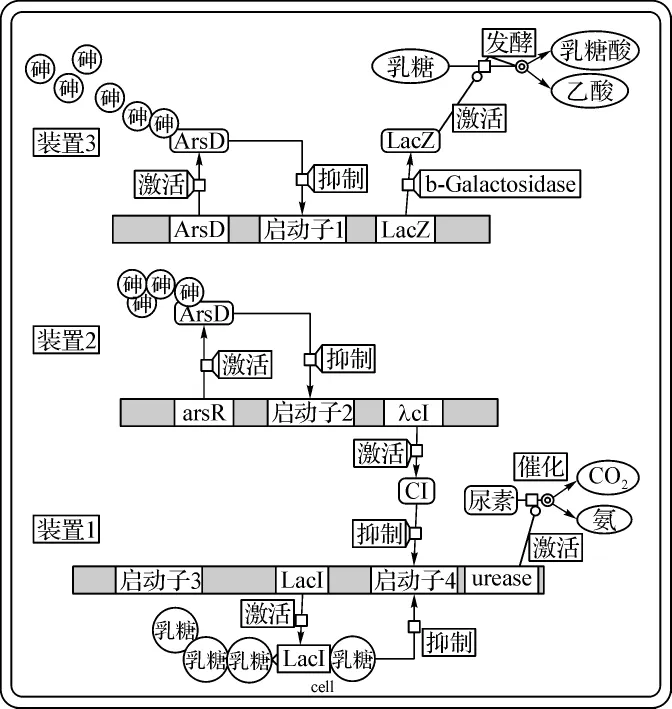
图2 砷传感器示意图Fig 2 The sketch map of arsenic biosensor
(1)当环境中只有乳糖存在而无砷离子存在时,乳糖与LacI结合,解除LacI对启动子4的抑制,启动子4顺利启动,其下游的尿素酶基因表达产生尿素酶。尿素酶催化尿素转化为氨和二氧化碳,环境的pH升高,其值约为9~10。
(2)当环境中的砷离子浓度较低(如5 μg·L-1)时,响应低浓度砷离子的高敏感装置2启动。砷离子与ArsR结合,解除其对启动子2的抑制,下游的λcI基因顺利表达,产生的CI蛋白抑制装置1的启动子4,关闭尿素酶基因的表达,阻止其对尿素的催化作用。此时由于没有相应酸或碱的产生,系统的pH维持在中性状态(由于少量残余尿素的存在,pH可能会略高于中性),即pH约为7。
(3)当环境中砷离子浓度较高(如20 μg·L-1)时,响应高浓度砷离子的装置3启动。砷离子与ArsD结合,解除其对启动子1的抑制,下游的lacZ基因顺利表达,lacZ基因编码的β-半乳糖苷酶催化乳糖的发酵,使其分解为乙酸和乳糖酸,此时pH约为4.5。最终通过溴百里酚蓝显色剂显色来显示不同的pH。如图3所示。该模型不但达到了半定量的水平,可区分无砷、低浓度砷、高浓度砷3种状态,而且可以用细胞冻干粉和风干的细胞作为保存方式,且常温下保质期至少为几周,极大提高了保存和运输的方便性。

图3 溴百里酚蓝作为pH指示剂的砷分析Fig 3 Arsenic assays conducted with bromthymol blue as pH indicator
爱丁堡大学的研究成果无疑给合成生物学领域注入了一支强心剂,不仅证明了合成生物学的研究思想是可行的,还显示出了合成生物学的独特优势。现在合成生物学正在发展阶段,还有很多问题需要解决,但是我们相信随着技术的不断成熟,合成生物学定能为人类作出不可小觑的贡献。
3 发展前景
微生物传感器由于酶源丰富且稳定、周期短成本低、应用广泛等优点一直是相关领域研究的热点,而快速发展的合成生物学手段能较好地弥补目前微生物传感器的缺陷,进一步推进微生物传感器的研究发展。未来必将是交叉学科发挥作用的时代,微生物传感器和合成生物学的结合定能为这一领域带来突破性的进展,从而造福人类。
[1]HEIM S,SCHNIEDER I,BINZ D,et al.Development of an automated microbial sensor system[J].Biosens Bioelectron,1999,14(2):187-193.
[2]CLARK L C,LYONS C.Electrode systems for continuous monitoring in cardiovascular surgery[J].Ann N Y Acad Sci,1962,102:29-45.
[3]UPDIKE S D,HICKS G P.The enzyme electrode[J].Nature,1967,214:986-988.
[4] LENG H J,LIN Y Z.Development of a novel deformationbased tissue softness sensor[J].Ieee Sensors J,2009,9(5-6):548-554.
[5]VAIOPOULOU E,MELIDIS P,KAMPRAGOU E,et al.On-line load monitoring of wastewaters with a respirographic microbial sensor[J].Biosens Bioelectron,2005,21(2):365-371.
[6]ZHANG Y,ANGELIDAKI I.Submersible microbial fuel cell sensor for monitoring microbial activity and BOD in groundwater:Focusing on impact of anodic biofilm on sensor applicability[J].Biotechnol Bioeng,2011,108(10):2339-2347.
[7]MACASKILL A F,RINHOLM J E,TWELVETREES A E,et al.Miro1 is a calcium sensor for glutamate receptor-dependent localization of mitochondria at synapses[J].Neuron,2009,61(4):541-555.
[8]UNTERHOLZNER L,KEATING S E,BARAN M,et al.IFI16 is an innate immune sensor for intracellular DNA[J].Nat Immunol,2010,11(11):997-1004.
[9]CAMPAS M,MARTY J L.Enzyme sensor for the electrochemical detection of the marine toxin okadaic acid[J].Anal Chim Acta,2007,605(1):87-93.
[10]ISHIGE Y,SHIMODA M,KAMAHORI M.Extended-gate FET-based enzyme sensor with ferrocenyl-alkanethiol modified gold sensing electrode[J].Biosens Bioelectron,2009,24(5):1096-1102.
[11]CANETE S J P,LAI R Y.Fabrication of an electrochemical DNA sensor array via potential-assisted“click”chemistry[J].Chem Commun,2010,46(22):3941-3943.
[12]KOYUNCU D,ERDEN P E,PEKYARDIMCI S,et al.A new amperometric carbon paste enzyme electrode for ethanol determination[J].Analytical Letters,2007,40(10):1904-1922.
[13] HNAIEN M,LAGARDE F,JAFFREZIC-RENAULT N.A rapid and sensitive alcohol oxidase/catalase conductometric biosensor for alcohol determination[J].Talanta,2010,81(1-2):222-227.
[14]SCOGNAMIGLIO V,STAIANO M,ROSSI M,et al.Proteinbased biosensors for diabetic patients[J].J Fluorescence,2004,14(5):491-498.
[15]陈涉,靳刚.无标记椭偏成像蛋白质芯片生物传感器及其生物医学应用[J].东南大学学报:医学版,2011,30(1):99-104.
[16]谢佳胤,李捍东,王平,等.微生物传感器的应用研究[J].现代农业科技,2010(6):11-15.
[17]NAKAMURA H,SHIMOMURA S M,KARUBE I.Development of microbial sensors and their application[J].Adv Biochem Eng Biotechnol,2008,109:351-394.
[18]HEATHER S.Whole-cell bacterial biosensors and the detdction of bioavailable arsenic[R].Washington:U.S.Environ Protection Agency,2003:1-19.
[19]JONATHAN M R,ERIN K.Noise in gene expression:origins,consequences,and control[J].Science,2005,309(5743):2010-2013.
[20]HAUKE H,MONA C W,JAN R.Whole-cell living biosensors-are they ready for environmental application[J].Appl Microbiol Biotechnol,2006(70):273-280.
[21]BALL P.Synthetic biology-Designs for life[J].Nature,2007,448(7149):32-33.
[22]ROBIN T,JAN R.Bacterial biosensors for measuring availability of environmental pollutants[J].Sensors,2008(8):4062-4080.
[23]ERNESTO A,SUBHAYU B,DAVID K K,et al.Synthetic biology:new engineering rules for an emerging discipline[J].Mol Syst Biol,2006(2):1-14.
[24]PRATHER K L,JARAMILLO A.Editorial:Focus on synthetic biology[J].Nature Biotechnology,2009,4(10):1367.
[25]ZHANG L Y,CHANG S H,WANG J.Synthetic biology:From the first synthetic cell to see its current situation and future development[J].Chin Science Bulletin,2011,56(3):229-237.
[26]SMOLKE C D.Building outside of the box:iGEM and the BioBricks Foundation[J].Nat Biotechnol,2009,27(12):1099-1102.
[27]GARDNER T S,CANTOR C R,COLLINS J J.Construction of a genetic toggle switch in Escherichia coli[J].Nature,2000,403(6767):339-342.
[28]ELOWITZ M B,LEIBLER S.A synthetic oscillatory network of transcriptional regulators[J].Nature,2000,403(6767):335-338.
[29]MARTIN V J,PITERA D J,WITHERS S T,et al.Engineering a mevalonate pathway in Escherichia coli for production of terpenoids[J].Nat Biotechnol,2003,21(7):796-802.
[30]GIBSON D G,BENDERS G A,ANDREWS-PFANNKOCH C,et al.Complete chemical synthesis,assembly,and cloning of a Mycoplasma genitalium genome[J].Science,2008,319(5867):1215-1220.
[31]GIBSON D G,GLASS J I,LARTIGUE C,et al.Creation of a bacterial cell controlled by a chemically synthesized genome[J].Science,2010,329(5987):52-56.
[32]PARAYIL K A,XIAO W H,KEIGH E G,et al.Isoprenoid pathway optimization for taxol precursor overproduction in Escherichia coli[J].Science,2010,330:70-74.
[33]NEUMANN H,NEUMANN-STAUBITZ P.Synthetic biology approaches in drug discovery and pharmaceutical biotechnology[J].Appl Microbiol Biotechnol,2010,87(1):75-86.
[34]CONNOR M R,ATSUMI S.Synthetic biology guides biofuel production[J].J Biomed Biotechnol,2010:1-9.
[35] DELLOMONACO C,FAVA F,GONZALEZ R.The path to next generation biofuels:successes and challenges in the era of synthetic biology[J].Microb Cell Fact,2010,9:1-15.
[36]SCHMIDT C W.Synthetic biology environmental health implications of a new field[J].Environ Health Perspect,2010,118(3):A118-A123.
[37]JOSHI N,WANG X,MONTGOMERY L,et al.Novel approaches to biosensors for detection of arsenic in drinking water[J].Desalination,2009,248(1-3):517-523.
[38]de MORA K,JOSHI N,BALINT B L,et al.A pH-based biosensor for detection of arsenic in drinking water[J].Ana Bioanal Chem,2011,400(4):1031-1039.
[39]KELLE A.Ensuring the security of synthetic biology towards a 5P governance strategy[J].Syst Synth Biol,2009,3(1/4):85-90.
[40] SCHMIDT M.Diffusion of synthetic biology:a challenge to biosafety[J].Syst Synth Biol,2008,2(1/2):1-6.
[41]LIN Q S.Synthetic biology[J].Chin Bulletin Sciences,2005,17(5):1-10.
[42]CHECK E.Synthetic biologists face up to security issues[J].Nature,2005,436(7053):894-895.
[43]Presidential Commission for the Study of Bioethical Issues.NEW DIRECTIONS-The ethics of synthetic biology and emerging technologies[R/OL].[2010-12].http://www.bioethics.gov/documents/synthetic-biology/PCSBI-Synthetic-Biology-Report-12.16.10.pdf.
[44]GU X,TRYBIŁO M,RAMSAY S,et al.Engineering a novel self-powering electrochemical biosensor[J].Syst Synth Biol,2010(4):203-214.
[45]FANG W,CHIH-MING H.Aptamer-based electrochemical biosensor for Botulinum neurotoxin[J].Anal Bioanal Chem,2009(393):1943-1948.
[46]JAN R,SHIMSHON B.Where microbiology meets microengineering:design and applications of reporter bacteria[J].Nat Rev Microbiology,2010(8):511-522.
[47] HOWARD S,TAMSIR A,VOIGT C.Engineering Bacterial Signals and Sensors[J].Contrib Microbiol,2009(16):1-32.
[48]AMOL D,PATRIZIA P,SYLVIA D.Construction of spores for portable bacterial whole-cell biosensing systems[J].Anal Chem,2007(79):9391-9397.
[49] SANLLORENTE-MENDEZ S,DOMINGUEZ-RENEDO O,Arcos-Martinez M J.Immobilization of acetylcholinesterase on screen-printed electrodes.Application to the determination of arsenic(Ⅲ)[J].Sensors,2010,10(3):2119-2128.
[50] SARKAR P,BANERJEE S,BHATTACHARYAY D,et al.Electrochemical sensing systems for arsenate estimation by oxidation of L-cysteine[J].Ecotoxicol Environ Saf,2010,73(6):1495-1501.
[51] SARKAR P,BANERJEE S,BHATTACHARYAY D,et al.Electrochemical sensing systems for arsenate estimation by oxidation of L-cysteine[J].Ecotoxicol Environ Saf,2010,73(6):1495-1501.
[52]DAUNERT S,BARRETT G,FELICIANO J S,et al.Genetically engineered whole-cell sensing systems:coupling biological recognition with reporter genes[J].Chem Rev,2000,100(7):2705-2738.
[53]TANI C,INOUE K,TANI Y,et al.Sensitive fluorescent microplate bioassay using recombinant Escherichia coli with multiple promoter-reporter units in tandem for detection of arsenic[J].Biosci Bioeng,2009,108(5):414-420.
[54]YOSHIDA K,INOUE K,TAKAHASI Y,et al.Novel carotenoid-based biosensor for simple visual detection of arsenite:characterization and preliminary evaluation for environmental application[J].Appl Environ Microbiol,2008,74(21):6730-6738.
[55]CAI Y Z,BRYONY D,HONGWU M,et al.Modeling the arsenic biosensor system[J].BMC Syst Biol,2007,1(Suppl 1):83.

