依诺肝素钠相对分子量的EP与USP分析方法对比研究
伯小霞,崔慧斐
(1.山东大学 药学院,山东 济南 250012;2.(山东大学)国家糖工程技术研究中心,山东 济南 250012;3.东营天东生化工业有限公司,山东 东营 257067)
依诺肝素钠相对分子量的EP与USP分析方法对比研究
伯小霞1,3,崔慧斐1,2
(1.山东大学 药学院,山东 济南 250012;2.(山东大学)国家糖工程技术研究中心,山东 济南 250012;3.东营天东生化工业有限公司,山东 东营 257067)
目的 以国产依诺肝素钠和其原研药为样品,比较欧洲药典(EP)和美国药典(USP)测定依诺肝素钠相对分子质量(Mr)方法的差异,为国内该品种的药典标准制定提供参考。方法 采用这两种方法分别检测了10批国产依诺肝素钠原料药和2批原研药注射液LOVENOX的Mr情况。结果 USP方法测得平均Mr均较EP方法结果偏高在200以内,Mr2 000以下组分比例EP方法偏高,而Mr2 000~8 000组分比例USP方法偏高,但差距均在4%以内。国产依诺肝素钠Mr与原研药的基本一致。结论 EP和USP方法分析依诺肝素钠Mr结果较为接近。
依诺肝素钠;相对分子量质量;欧洲药典;美国药典
依诺肝素钠是一种低分子肝素钠盐,系通过对猪肠黏膜肝素的苄基酯衍生物进行碱解聚β-消除而获得。与其他低分子肝素一样,依诺肝素钠也有相对分子质量(Mr)及分布要求,并作为其鉴别的重要一项。依诺肝素钠平均Mr范围为3 800~5 000,Mr小于2 000的级分比例应为12.0% ~20.0%,2 000~8 000的级分比例应为68.0% ~82.0%。
欧洲药典(EP)和美国药典(USP)中均收录了依诺肝素钠,都采用高效凝胶渗透色谱进行Mr的检测,其具有简便、快速和重现性好的特点[1],但两者的分析方法却并不完全相同[2-3]。本文采用这两种药典方法分析了国产依诺肝素钠和原研药LOVENOX注射液的Mr情况。
1 仪器与试药
高效液相色谱仪(Waters515泵,2487紫外检测器,2414示差检测器,7725i手动进样器,81437柱温箱);Empower工作软件;Sartorius电子天平;Millipore超纯水机。
低分子肝素Mr测定用对照品(批号2.0,数均分子质量3 800)、EDQM依诺肝素钠对照品(批号4.0),欧洲药品质量管理局(EDQM);USP依诺肝素钠Mr校正对照品A(批号F0H193)、USP依诺肝素钠Mr校正对照品B(批号F0H241)、USP依诺肝素钠对照品(批号F0I110,标示Mr4 432),美国药典委员会(USP);10批依诺肝素钠(批号KE110414等),东营天东生化工业有限公司;2批Lovenox依诺肝素钠注射液(批号7880,7881),赛诺菲-安万特公司;其余为国产优级纯或色谱纯试剂。
2 方法
2.1 EP 分析方法[2]
2.1.1 试液的配制 流动相:2.84%硫酸钠溶液(用稀硫酸调节pH至5.0)。
对照品溶液:精密称取欧洲药典低分子肝素Mr测定用对照品适量,用流动相制成每1 mL约含10 mg的溶液。
供试品溶液:称取依诺肝素钠适量,用流动相稀释成每1 mL约含10 mg的溶液。
2.1.2 色谱条件与系统校正 以TSKguardcolumn-SWXL和TSKgelG2000SWXL为色谱柱;柱温为30℃;进样量为 25 μL;流速为 0.5 mL/min;紫外检测器连接色谱柱出口,示差检测器连接紫外检测器出口;检测波长为234 nm。进样1%葡萄糖溶液,记录示差色谱图,计算理论板数与对称因子,理论板数应大于20 000,对称因子应为 0.8 ~1.5。进样 0.04%叠氮化钠溶液,准确测量紫外检测器和示差检测器之间的时间差。
2.1.3 分析计算 参考 EP7.0版低分子肝素 Mr鉴别项下方法计算[2]。
2.1.4 EP 分析方法的验证
2.1.4.1 精密度试验 按上述的方法操作,计算得RSD≤2.0%。
2.1.4.2 准确度试验 进样两针EDQM依诺肝素钠对照品,其结果在标准范围内且两针对照品的Mr分布差值≤0.5%,Mr的差值≤50。
2.2 USP 分析方法[3]
2.2.1 试液制备 流动相:0.5 mol/L硝酸锂溶液。
USP依诺肝素钠对照品溶液:取USP依诺肝素钠对照品适量,用流动相稀释成每1 mL约含10 mg的溶液。
USP依诺肝素钠Mr校正对照品A和B:移取流动相1 mL到USP依诺肝素钠Mr校正对照品A和B瓶中,溶解混匀。
供试品溶液:取依诺肝素钠适量,用流动相稀释成每1 mL约含10 mg的溶液。
2.2.2 色谱条件 以 TSKguardcolumnSWXL和 2根TSKgelG2000SWXL为色谱柱;进样量为20 μL;流速为0.6 mL/min;运行时间:50 min。
2.2.3 分析计算 参考USP 33版依诺肝素钠Mr鉴别项下方法计算[3]。平行样Mr相差不超过50,对照品Mr计算结果与标示的Mr偏差小于150,则通过系统适用性试验。同样的方法,计算Mr分布。平行样分布值相差不超过0.5%。
2.2.4 USP 分析的验证
2.2.4.1 精密度试验 按上述的方法操作,计算得RSD≤2.0%。
2.2.4.2 准确度试验 进样两针USP依诺肝素钠对照品,每一针的Mr与标签上标示的Mr(4 432)相差不超过150,两个对照品Mr之差不超过50。
2.3 采用EP和USP方法对10批依诺肝素钠和2批Lovenox注射液进行分析
按照EP和USP的检验方法,分别分析10个批次的依诺肝素钠样品和2批赛诺菲-安万特的Lovenox依诺肝素钠注射液样品。
3 结果
3.1 标准品谱图
EP和USP标准品谱图见图1~3。
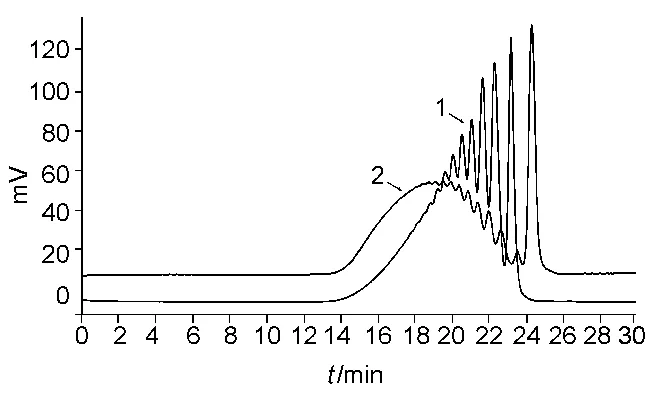
图1 EP对照品紫外与示差叠加谱图(1-紫外谱图,2-示差谱图)Fig.1 The UV and RI chromatograms of heparin low-molecular-mass for calibration CRS
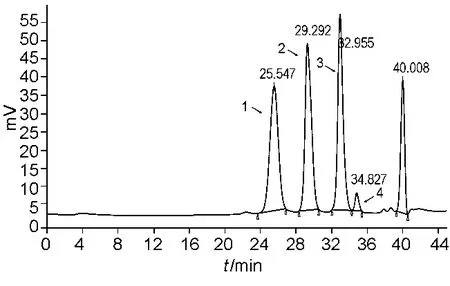
图2 依诺肝素钠Mr校正对照品A色谱图Fig.2 The chromatogram of Enoxaparin sodium Molecular Weight Calibrant A
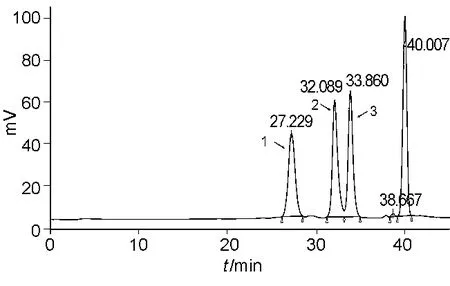
图3 依诺肝素钠Mr校正对照品B色谱图Fig.3 The chromatogram of Enoxaparin Sodium Molecular Weight Calibrant B
3.2 样品Mr测定结果
国产依诺肝素钠和Lovenox注射液色谱图见图4~5。EP和USP分析10批依诺肝素钠样品和2批Lovenox样品的结果见表1。从表1可看出,USP方法Mr均较EP方法结果偏高,最大差值约为200,最小仅为2;Mr<2 000的比例EP分析方法偏高,差值约为2% ~3%;Mr2 000~8 000的比例USP方法偏高,差值约为1% ~3.5%。USP方法的Mr结果更偏向范围的中心,EP方法的结果更偏向范围的边缘,尤以Mr分布比例明显。从上述数据亦可看出,10批国产依诺肝素钠样品与2批Lovenox依诺肝素钠注射液在Mr和Mr分布方面无显著差异。
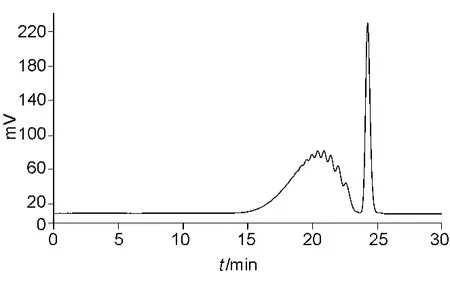
图4 国产依诺肝素钠样品EP方法示差谱图Fig.4 The RI chromatogram of the domestic samples in EP method
4 讨论
低分子肝素最初是在1994年被英国药典收载入其增补版中,收录了低分子肝素总则和5种低分子肝素产品,现在EP中收载的低分子肝素内容与英国药典相同[4],且自收录后该分析方法始终没有变更。USP自31版增补版二开始收录依诺肝素钠,2008年12月1日生效。
两个药典方法所采用的测定用对照品不同。USP配有自己的依诺肝素钠Mr测定用对照品,包括7个已知分子量的窄分布Mr校正对照品(图2~3),另有一个Mr标示为4 432的对照品,对检验过程和结果起到指导作用。EP则采用数均分子量为3 800的宽分布对照品,具有普适性,适用于所有低分子肝素Mr的测定,标准曲线范围较广。
图5 Lovenox注射液EP方法示差谱图Fig.5 The RI chromatogram of the branded in EP method
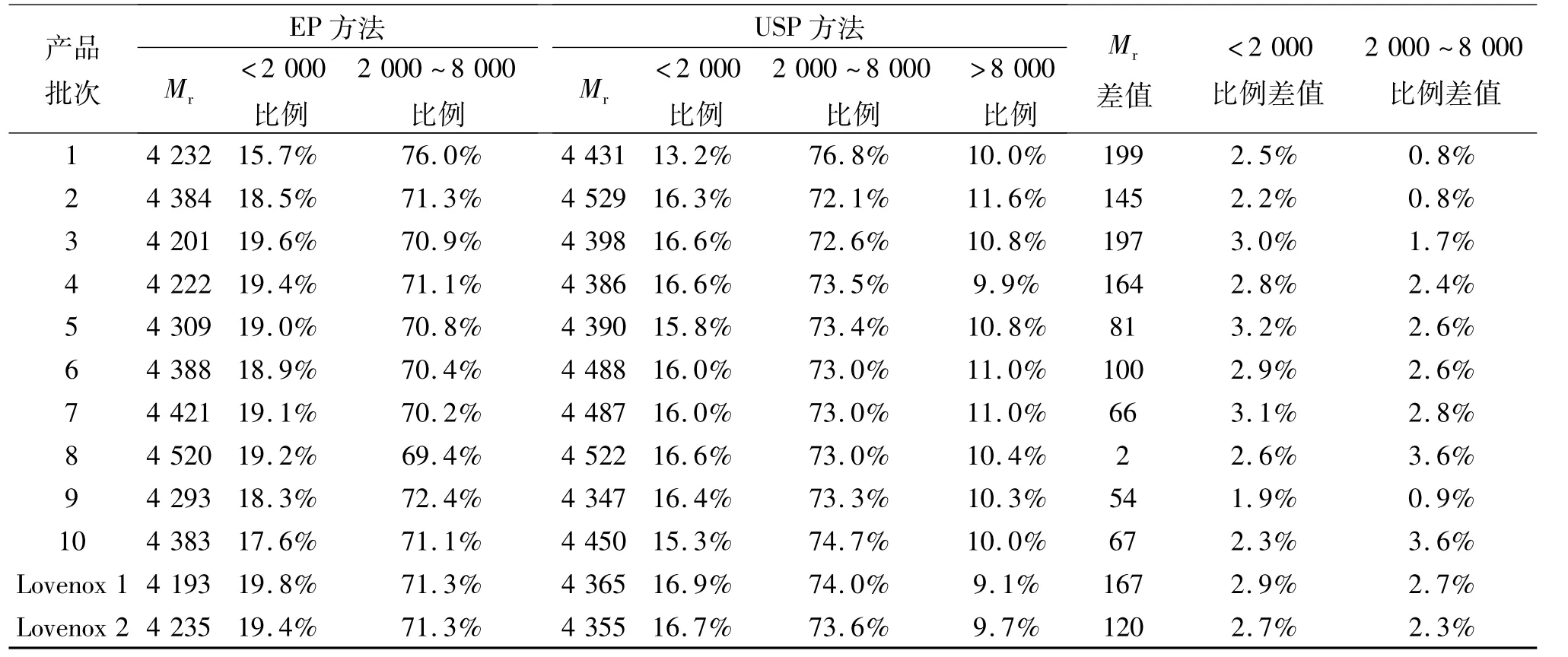
表1 EP和USP方法分析10批依诺肝素钠样品和2批Lovenox样品结果Tab.1 The results of 10 batches of Enoxaparin sodium samples and 2 batches brand Injection Lovenox Enoxaparin sodium in EP and USP method
虽然两个药典方法均采用三阶标准曲线计算,但三阶标准曲线的建立方法有所不同。EP方法是采用数均分子质量为3 800的宽分布对照品,利用紫外和示差双检测器,依据紫外与示差谱图的峰面积得出每个时间点的Mr,以对照品溶液示差色谱图的保留时间对示差色谱图中每个时间点的lgMr拟合得到三阶方程。USP方法则是以USP依诺肝素钠Mr校正对照品A和B谱图中7个峰的保留时间对各峰的Mr,用GPC软件得到三阶方程。以依诺肝素钠标准品为例,经计算发现,标准曲线中以lgMr还是直接以Mr来建立方程是EP和USP结果略有差异的主要原因。当EP方法标准曲线以对照品溶液示差色谱图的保留时间对示差色谱图中每个时间点的Mr来拟合,计算依诺肝素钠标准品结果,Mr较原结果略有升高,范围在100左右,而Mr分布变化非常大,分布集中在2 000~8 000之间,超出标准范围。
从本文对比研究来看,两种药典方法对依诺肝素钠Mr的测定结果较为接近,Mr差别在200以内,2 000以下组分和2 000~8 000组分的比例差距均在4%以内。EP方法与USP方法相比,方法复杂,分析过程繁琐,亦没有标示Mr的对照品作参考,分析过程易出现偏差,故笔者更倾向于USP方法。
中国药典尚未收录依诺肝素钠和低分子肝素,国家食品药品监督管理局于2005年颁布的国家药品标准WS1-(X-149)-2005Z低分子量肝素钠中规定了低分子肝素钠Mr检测,其对照品采用EDQM低分子肝素Mr测定用对照品,检测仪器要求、分析方法和计算均与EP一致[5]。Mr作为依诺肝素钠同时也是低分子肝素鉴别项目之一,是质量标准中不可缺少的一项。本文为该品种Mr国内标准的制定具有参考意义。
[1] 范慧红,刘金秀,徐康森.低分子肝素分子量及其分布的测定[J].中国药学杂志,1999,34(5):332-334.
[2] 欧洲药典[S].7.0 版.2011:2151-2153.
[3] 美国药典[S].33版.2010:2253-2256.
[4] 范慧红,李 京.低分子肝素质控研究状况介绍[C]//2007年全国生化与生物技术药物学术年会论文汇编,2007:530-532.
[5] WS1-(X-149)-2005Z,低分子量肝素钠[S].
Comparative study on relative molecular weight analysis of Enoxaparin Sodium by EP and USP methods
BO Xiao-xia1,3,CUI Hui-fei1,2
(1.School of Pharmaceutical Sciences,Shandong University,Jinan 250012,China;2.National Glycoengineering Research Center(Shandong University),Jinan 250012,China;3.Dongying Tiandong Biochemical Industry Co.,Ltd.,Dongying 257067,China)
Purpose To analyze the difference of the relative molecular weight(Mr)analysis method of Enoxaparin Sodium in european Pharmacopoeia(EP)and the United States Pharmacopoeia(USP)through the analysis of domestic samples and the branded,and to provide some opinions for Enoxaparin Sodium domestic standard.Methods Ten batches of Enoxaparin Sodium samples and 2batches brand In-jection Lovenox Enoxaparin Sodium were analyzed in EP and USP method.Results The average Mrby EP method was higher than that by USP method with difference of less than 200.The percentage of less than 2 000 by EP method was higher,and that of 2 000 ~8 000 by USP method was higher and both differences within 4%.The Mrof domestic samples was comparable to the branded.Conclusion The results of Mrof Enoxaparin Sodium by EP method were closed to those by USP method.
Enoxaparin Sodium;relative molecular weight;European Pharmacopoeia;United States Pharmacopoeia
R927.1
A
1005-1678(2012)06-0818-04
2012-05-05
十一五“重大新药创制”项目(2008ZX09504)
伯小霞,女,在职硕士研究生,主要从事生化药物研究与检测;崔慧斐,通讯作者,教授,硕士生导师,Tel:0531-88380288,E-mail:cuihuifei@sdu.edu.cn。

