喂食当归多糖对点带石斑鱼非特异性免疫力和抗病力的影响*
王庆奎,邢克智,赵海运,陈成勋,毋占勇,马 甡
(1.中国海洋大学海水养殖教育部重点实验室,山东青岛266003;2.天津农学院天津市水产生态及养殖重点实验室,天津300384)
喂食当归多糖对点带石斑鱼非特异性免疫力和抗病力的影响*
王庆奎1,2,邢克智2**,赵海运2,陈成勋2,毋占勇2,马 甡1
(1.中国海洋大学海水养殖教育部重点实验室,山东青岛266003;2.天津农学院天津市水产生态及养殖重点实验室,天津300384)
在饵料中添加0、500、3 000 mg/kg的当归多糖(ASP)喂食点带石斑鱼(Epinephelus malabaricus)(初始体重(158.64±2.14)g),分别在喂食4和8周后取样,研究ASP对点带石斑鱼非特异性免疫力和抗病力的影响。结果表明,ASP能显著提高血液白细胞吞噬率和血清LZM活力(P<0.05),对血清一氧化氮(NO)、体表黏液溶菌酶(LZM)活力和抗菌活力无显著影响。ASP能促进头肾白细胞增殖、呼吸爆发活力和吞噬活力,降低用迟缓爱德华菌(Edwardsiella tarda)攻毒后试验鱼的累积死亡率,3 000 mg/kg组累积死亡率低于500 mg/kg组,连续喂食ASP 8周的保护效果优于4周。研究表明,用含ASP 3 000 mg/kg的饵料连续喂食点带石斑鱼8周能有效提高其非特异性免疫力和抗病力。
当归多糖;点带石斑鱼;非特异性免疫力;抗病力
随着鱼类集约化养殖的发展,高密度养殖容易造成鱼类健康水平下降,使其易于被微生物感染。传统的预防和治疗药物如抗生素会导致病菌产生抗药性,化学消毒剂会杀死有益微生物,并会对环境造成污染,水产品中也会有药物残留[1]。研究表明免疫增强剂可能成为抗生素和化学消毒剂在水产养殖上的替代品[2]。在众多的免疫增强剂中,植物多糖由于具有生物相容性(Biocompatible)、生物可降解性(Biodegradable)、有效性和对环境的安全性等优势,以及对生物体具有综合调理、治标治本等功效,已经引起社会的广泛关注[3-7]。
当归多糖(Angelica sinensis polysaccharide,ASP)是中草药当归(Radix Angelica sinensis)中的主要活性成分之一,对动物具有广泛的生物学效应,如具有抗辐射[8-10]、保护胃肠道[11]、抗溃疡[12]、造血[13]、抗肿瘤[14-17]、抗氧化[18-20]、抗病毒[21-22]和免疫调节[23-24]活力。虽然ASP能调节畜禽类动物的免疫系统,但它对水产动物是否具有免疫调节作用尚未见报道。
点带石斑鱼(Epinephelus malabaricus)是东南亚沿海重要的高档海水养殖鱼类之一。近十年来,点带石斑鱼高密度养殖在我国福建、广东、广西和海南沿海蓬勃发展起来,在北方具有地热资源的沿海地区也有工厂化养殖。石斑鱼高密度养殖条件下易患寄生虫病、细菌病和病毒病[25]。寄生虫以盾纤毛虫和刺激隐核虫(Cryptocaryon irritans)危害最严重,细菌以弧菌[26]危害最严重,病毒以神经坏死病毒(Nervous necrosis virus)[27]危害最严重。这些疾病常导致石斑鱼大批死亡,是长期困扰石斑鱼养殖发展的主要问题。因此迫切需要寻找能够提高点带石斑鱼非特异性免疫力和抗病力的免疫增强剂。本试验研究喂食ASP对点带石斑鱼非特异性免疫力和抗病力的影响,为其在水产养殖中的应用提供参考。
1 材料和方法
1.1 试验鱼和ASP
试验鱼取自天津市海发珍品实业发展有限公司。ASP为本实验室提取纯化[28]。
1.2 试验设计
取健康、无畸形的点带石斑鱼(初始体重(158.64±2.14)g)随机分配到18个水族箱中,每箱25尾。参考前期的研究结果,ASP设低剂量组(500 mg/kg饵料)和高剂量组(3 000 mg/kg饵料),对照组喂食基础饵料,每组喂食6箱。连续喂食4周、8周后取样,每组每次取3箱,每箱随机取8尾鱼,测体表黏液溶菌酶(LZM)活力和抗菌活力,血液白细胞吞噬能力,血清LZM活力和一氧化氮(NO)含量。每箱另取9尾鱼用迟缓爱德华菌(Edwardsiella tarda)攻毒,连续观察7 d,计算累计死亡率。喂食8周后每箱另取8尾,解剖出头肾并分离头肾白细胞,检测头肾白细胞增殖、呼吸爆发和吞噬能力。取样箱剩余的鱼不再用于试验。
1.3 试验饵料
基础饵料配方见表1,各原料粉碎后过60目筛,复合维生素、复合矿物质和ASP采用逐级扩大法混合,与其它原料混匀后加油和水,充分混匀后用绞肉机挤成直径2 mm的面条状饵料,阴干、搓碎后密封,冷藏备用。
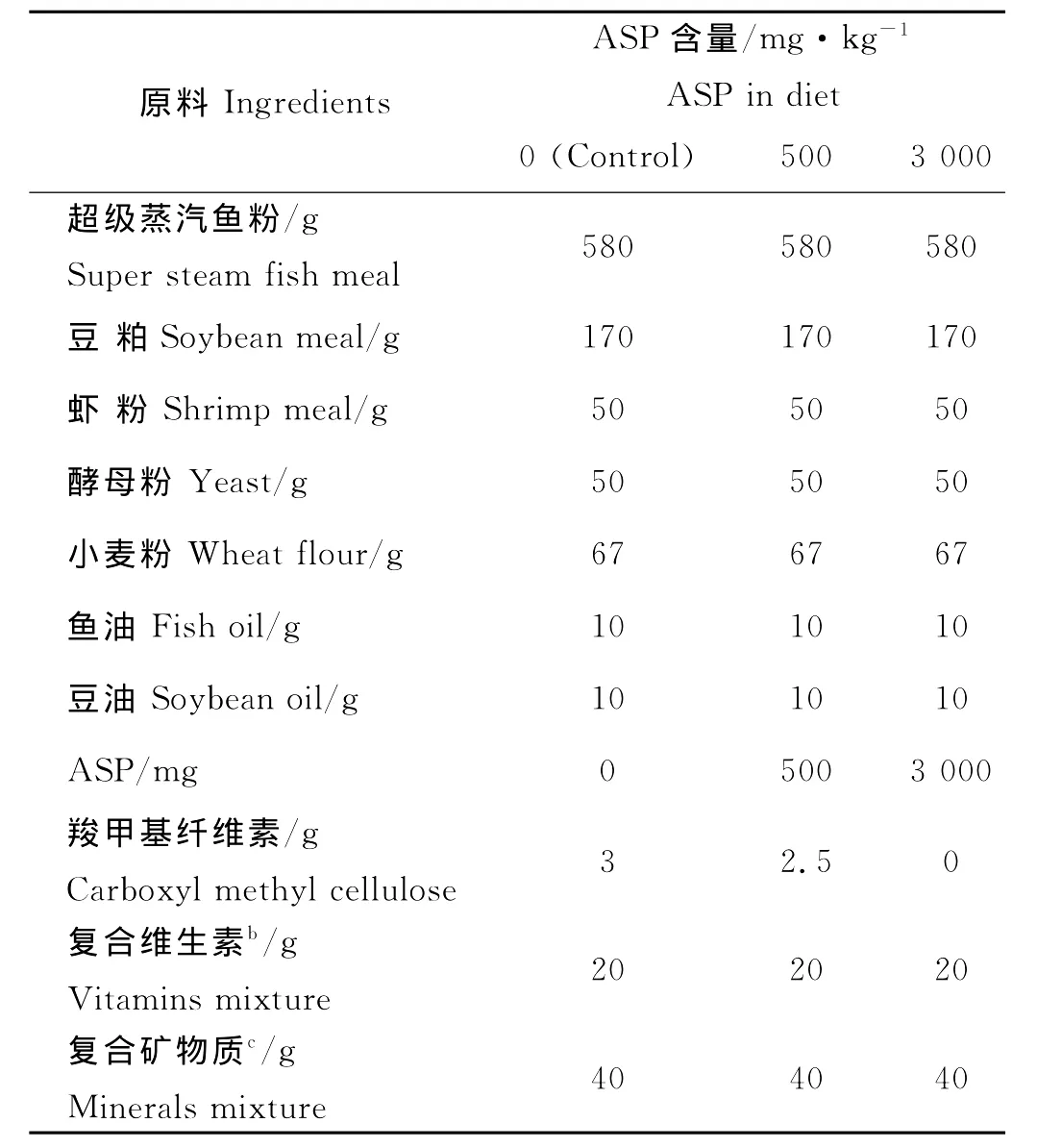
表1 基础饵料配方aTable 1 Composition of the basal diet a
1.4 试验条件和日常管理
试验鱼饲养在240 L(860×620×455 mm3)聚乙烯箱中,微流水养殖。试验前用基础饵料驯养3周。每天喂食2次(08:00,16:00),日投饵量约占鱼体重的1%,并随鱼的生长和摄食情况适当调节。保持箱内清洁。水质条件为:水温23~26℃,盐度28~32,溶解氧>6 mg/L,p H7.8~8.6,-N<0.20 mg/L,-N<0.07 mg/L。
1.5 迟缓爱德华菌(Ed wardsiella tarda)的培养
迟缓爱德华菌(E.tarda)分离自发病石斑鱼,由本实验室鉴定并保存。攻毒试验前1 d将E.tarda在营养琼脂培养基上28℃培养24 h,用灭菌PBS(0.15 mol/L,p H=7.2)洗涤数次,调浓度为9×108cfu/m L用于攻毒试验。
1.6 戊二醛固定的绵羊红细胞(Glutaraldehyde-fixed sheep red blood cells,GSRBCs)的制备
按吴叶等[29]的方法制备GSRBCs,4℃保存,使用前用无菌PBS洗涤5次以除去戊二醛,RPMI-1640培养液(RPMI-1640中加100 IU/mL氨苄青霉素和0.1 mg/mL硫酸链霉素)重悬,调浓度至1.8×107cells/mL。
1.7 头肾白细胞分离
参考Li等[30]的方法并稍作修改。试验鱼用MS-222麻醉致死,无菌取头肾,剪碎,置100目无菌不锈钢细胞筛中,用注射器芯轻轻挤压组织,使单细胞穿过筛网,并不时用含20 IU/m L肝素钠的RPMI-1640维持液(RPMI-1640中加5%胎牛血清、100 IU/m L氨苄青霉素和0.1 mg/m L硫酸链霉素)将筛网上单细胞洗下。单细胞悬液用Hank’s平衡盐溶液(HBSS)漂洗2次(4℃640×g离心5 min),RPMI-1640维持液重悬,4℃保存。
无菌离心管中依次加1.059、1.020 g/m L的Percoll应用液和单细胞悬液各1 m L,4℃840×g离心15 min,收集白细胞,洗涤2次(4℃640×g离心5 min),RPMI-1640维持液重悬。
取少许白细胞悬液,加一滴0.4%台盼蓝染色2 min,用血球计数板检查活细胞,要求活细胞数大于95%。
1.8 测定指标和测定方法
1.8.1 体表黏液LZM活力 用比浊法测定,参照Cheng等[31]的方法并稍作改动。以溶壁微球菌(Micrococcus lysodeikticus)为底物,用0.1 mol/L PBS(p H=6.4)调浓度至O.D.570≈0.3。体表黏液冰水浴中匀浆,2 000 r/min离心10 min,取10μL黏液上清加到250μL预冷的溶壁微球菌悬液中,混匀后立即在酶标仪上450 nm波长测O.D.值。将96孔板25℃孵育30 min后,测O.D.值。考马斯亮蓝G-250法[32]测黏液上清蛋白质含量。单位LZM活力定义为:每毫克蛋白质每分钟O.D.值减少0.1为1个活力单位。
1.8.2 体表黏液抗菌活力 按照王伟庆等[33]的方法并稍作改动。以溶藻弧菌(Vibrio alginolyticus)为底物,用0.1 mol/L PBS(p H=6.4)调浓度至O.D.570≈0.3。取50μL黏液上清加到200μL菌悬液中,混匀后立即在酶标仪上570 nm测O.D.值A0。25℃孵育30 min后置冰水浴中止反应,测O.D.值A。抗菌活力Uα=[(A0-A)/A]1/2。
1.8.3 血液白细胞吞噬能力 按郭小华等[34]的配方培养枯草芽孢杆菌(Bacillus subtilis),无菌PBS洗涤数次后4℃保存,用前将浓度调至4×107cfu/mL。200μL抗凝血中加50μL菌悬液,混匀,28℃孵育30 min,每10 min摇匀1次。孵育结束后涂血涂片,吉姆萨染色,油镜计数白细胞吞噬情况。按下列公式计算吞噬率(Phagocytic rate,PR)和吞噬指数(Phagocytic index,PI)。吞噬率(PR,%)=(100个白细胞中参与吞噬的细胞数/100)×100%;吞噬指数(PI)=被吞噬的枯草芽孢杆菌数/吞噬枯草芽孢杆菌的白细胞数。
1.8.4 血清LZM活力 150μL溶壁微球菌悬液均匀涂布在固体培养基上,等间距放置直径4.32 mm灭菌滤纸片,滤纸片上加浓度为375、750、1 125、1 500、1 875、2 250 U/m L的LZM标准品溶液10μL,28℃培养12 h测抑菌圈直径。以抑菌圈直径为X,溶菌酶标准品浓度的对数为Y,求回归方程。滤纸片上加10 μL血清,按上述方法孵育,测量抑菌圈直径,代入回归方程得血清LZM活力。
1.8.5 血清NO含量 血清NO(硝酸还原酶法)用南京建成生物工程研究所生产的试剂盒测定。
1.8.6 头肾白细胞呼吸爆发 用HBSS调白细胞浓度至5×106cells/m L,按Cheng等[31]的方法测定,用脂多糖(LPS)刺激细胞。呼吸爆发系数(Respiratory burst index,RBI)=用LPS刺激孔O.D.-未用LPS刺激孔O.D.。
1.8.7 头肾白细胞增殖 参照Wu等[35]的方法测定并稍作改动。头肾白细胞用RPMI-1640增殖液(含10%胎牛血清,2%热灭活石斑鱼血清(合并若干尾非试验用石斑鱼血清,45℃孵育30 min),100 IU/m L氨苄青霉素,0.1 mg/m L硫酸链霉素)重悬。向平底96孔板中加入90μL增殖液(含5×105个头肾白细胞),10μL 100μg/m L LPS或HBSS(每尾鱼加8个孔,LPS和HBSS各4个孔),5%CO2培养箱27℃孵育24和48 h。孵育结束后每孔加1 mg/mL的四甲基偶氮唑蓝(MTT)20μL,继续孵育4 h。离心(500×g,10 min),小心弃去上清液,每孔加200μL二甲基亚砜(DMSO),25μL甘氨酸缓冲液(0.1 mol/L甘氨酸,0.1 mol/L氯化钠,调p H至10.5),充分混匀,10 min后550 nm测O.D.值。刺激指数(Stmulation index,SI)=(加LPS刺激的平均O.D./未加LPS刺激的平均O.D.)-1。
1.8.8 头肾白细胞吞噬 白细胞浓度调整至5×107cells/m L,以GSRBCs为吞噬原,按Gebran等[36]和Wu等[35]的方法测定。吞噬活力=试验孔O.D.-对照孔O.D.。测完后离心96孔板,弃上清,每孔加100μL溶解缓冲液(0.1 mol/L柠檬酸,1%Tween 20,0.05%结晶紫),混匀,血球计数板计数细胞核数。每孔细胞数约为2×105个。
1.8.9 攻毒试验 喂食4周、8周后每组取3箱,每箱随机取9尾鱼,MS-222麻醉后腹腔注射E.tarda(4周50μL/尾,8周100μL/尾)。攻毒鱼单独饲养(9尾/箱,共9箱)。每天喂食2次,记录死亡数并捞出死鱼,连续观察7 d,计算累积死亡率。
1.9 数据处理
所得数据用SPSS 16.0统计软件做单因素方差分析(ANOVA),差异显著(P<0.05)的用Duncan’s法作多重比较。数据用平均值±标准误表示。
2 结果
2.1 ASP对点带石斑鱼体表黏液LZM活力和抗菌活力的影响
ASP对点带石斑鱼体表黏液LZM活力和抗菌活力无显著影响(见图1)。

图1 喂食ASP对点带石斑鱼体表黏液LZM活力和抗菌活力的影响(n=8)Fig.1 Dietary ASP on skin mucus lysozyme activity and antibacterial activity of E.malabaricus(n=8)
2.2 ASP对点带石斑鱼血液白细胞吞噬能力的影响
由图2可以看出,喂食ASP 4和8周均能显著提高点带石斑鱼血液白细胞吞噬率(PR),500 mg/kg组和3 000 mg/kg组差异不显著。吞噬指数(PI)随ASP添加量的增多呈升高趋势。


2.3 ASP对点带石斑鱼血清LZM活力和NO含量的影响
ASP对点带石斑鱼血清LZM、NO的影响见图3。喂食ASP 4周能显著提高点带石斑鱼血清LZM活力,8周后500 mg/kg组LZM活力与对照组持平,3 000 mg/kg组LZM活力显著高于对照组。ASP对血清NO含量影响不显著。
2.4 ASP对头肾白细胞增殖、呼吸爆发和吞噬能力的影响
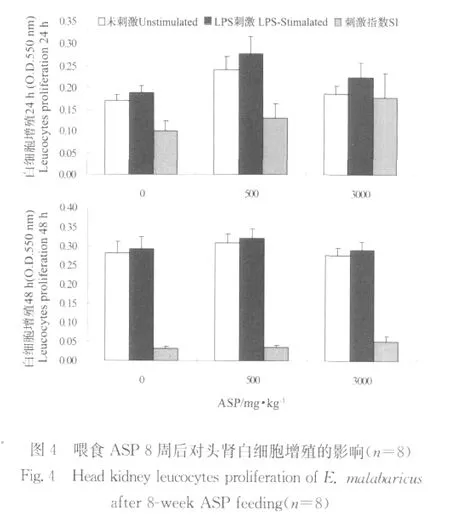
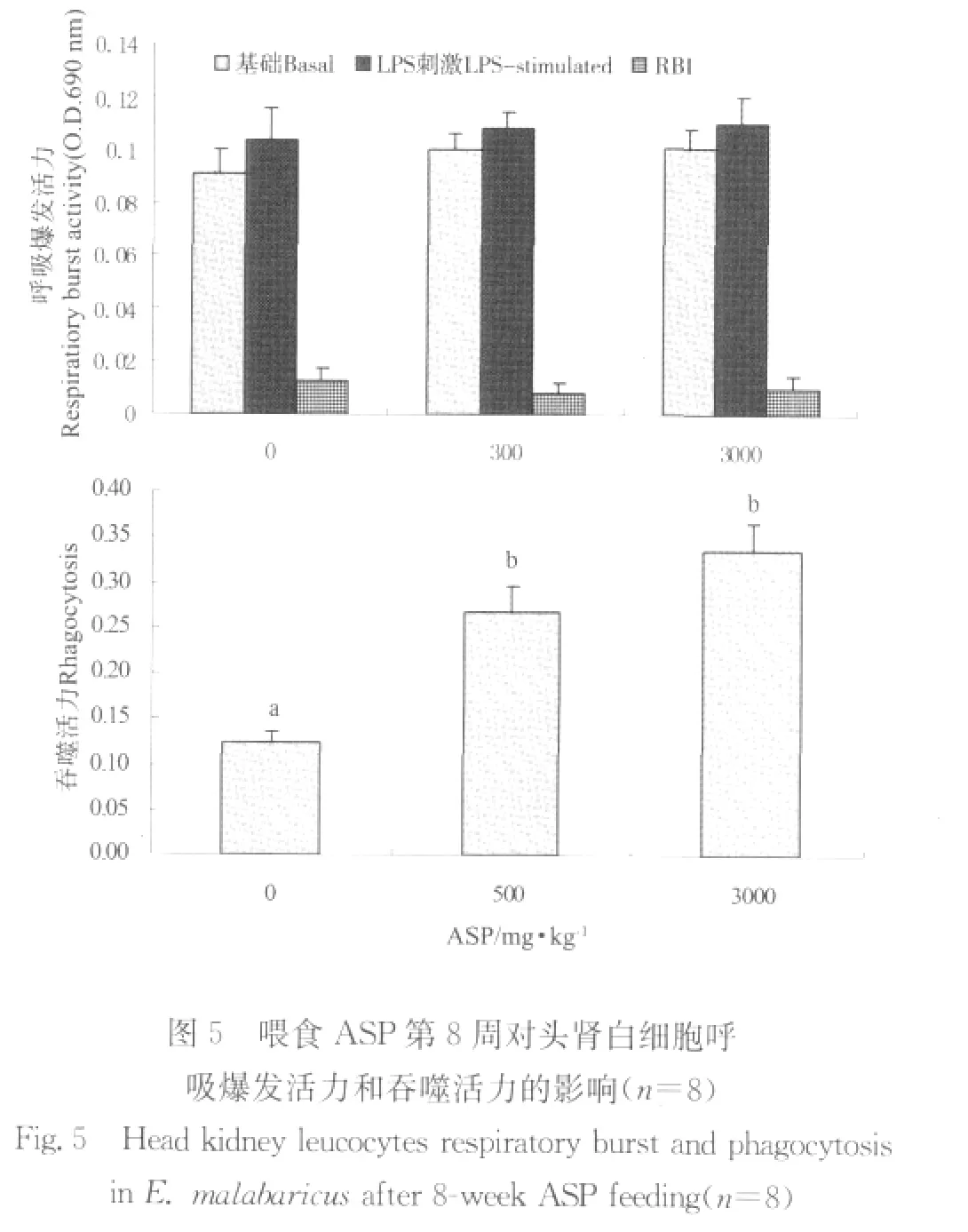
由图4可以看出,无论是否存在LPS,ASP均能促进头肾白细胞增殖,各组间增殖24 h的差异大于48 h,方差分析表明各组间增殖差异不显著。由图5可以看出,无论是否存在LPS,ASP均能促进头肾白细胞呼吸爆发活力,方差分析表明各组间差异不显著。ASP能显著提高头肾白细胞吞噬活力,3 000 mg/kg组吞噬活力高于500 mg/kg组。
2.5 攻毒结果
由图6可以看出,喂食ASP 4周后用E.tarda攻毒第3天的累积死亡率显著低于对照组,第4天3 000 mg/kg组累积死亡率仍显著低于对照组,第5天后各组累积死亡率稳定不变,500 mg/kg组和3 000 mg/kg组累积死亡率分别比对照组降低了9.3%和18.6%,各组间差异不显著。喂食ASP 8周后攻毒,在攻毒后第2天3000 mg/kg组累积死亡率显著低于对照组,第3天喂食ASP组累积死亡率显著低于对照组,第4天后各组累积死亡率保持不变,500 mg/kg组和3 000 mg/kg组累积死亡率分别比对照组降低了3.8%和26.9%,3 000 mg/kg组显著低于对照组。
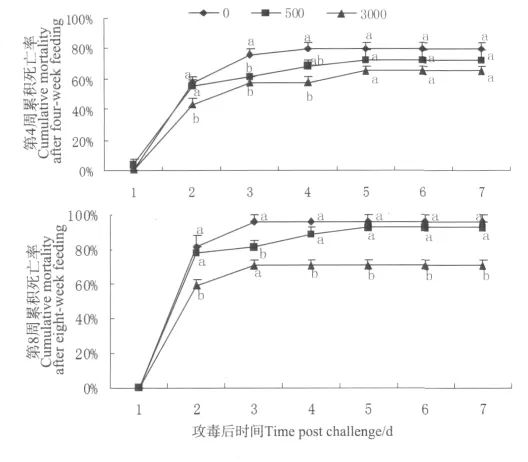
图6 喂食ASP 4周、8周后用E.tarda攻毒累积死亡率(n=9)Fig.6 Cumulative mortality of E.malabaricus challenged by E.tarda after 4 and 8-week ASP feeding(n=9)
3 讨论
鱼类免疫系统可分为非特异性免疫系统和特异性免疫系统两大类。作为低等脊椎动物,鱼类的特异性免疫系统比较原始,而非特异性免疫机制在防止感染中扮演更重要的角色。
鱼类体表黏液是鱼体与外界直接接触的第一道屏障,富含能形成凝胶的大分子(主要是黏蛋白)。这些大分子遇水膨胀并相互交织,在水中形成粘稠的三维结构,能对病原起到有效的俘获(Trapping)和陷入(Sloughing)作用。另外黏液所含的免疫成分也能有效杀死病原,这些成分包括LZM、几丁质酶、免疫球蛋白、补体、碳酸酐酶(Carbonic anhydrase)、白介素、凝集素、激泌毒素(Crinotoxin)、钙调蛋白、C-反应蛋白、转铁蛋白、蛋白酶及抗菌蛋白/肽等[37-40]。Palaksha等认为LZM可能是牙鲆抵御病原菌入侵的非常重要的粘液免疫因子[38]。Cha等将壳聚糖(Chitosan)包裹饵料喂食牙鲆(Paralichthys olivaceus)12周后,发现其体表黏液LZM活力显著升高[41]。本研究发现点带石斑鱼体表黏液具有一定的溶菌酶活力和抗菌活力,但ASP对其活力无显著影响。
吞噬作用在鱼类抵御外界病原入侵过程中起着非常重要的作用,主要通过在呼吸爆发过程中产生的大量氧自由基来杀死吞入胞内的病原[42]。研究发现,喂食壳聚糖[43]、海藻酸钠(Sodium alginate)[44]以及从杂色云芝菌(Coriolus versicolor)中分离出的一种蛋白质结合多糖PS-K[45]均能提高鱼类吞噬和呼吸爆发能力。本试验中喂食ASP后点带石斑鱼血液和头肾白细胞吞噬能力显著提高,头肾白细胞呼吸爆发活力增强,说明ASP能提高点带石斑鱼白细胞免疫能力。本试验检测头肾白细胞呼吸爆发和增殖时加入LPS,目的是为了检验LPS与ASP对点带石斑鱼头肾白细胞免疫是具有协同还是颉颃作用。从图4和5中可以看出,LPS与ASP对白细胞增殖和呼吸爆发具有协同作用的趋势。
通过口服途径给予动物的多糖会在消化道中被消化酶降解,为动物提供能量。López等[46]报道β-1,3-葡聚糖在凡纳滨对虾(Litopenaeus vannamei)消化腺中被β-葡聚糖酶(β-glucanases)降解,使饵料中更多的蛋白质用于生长。Zhao等[47]用β-1,3-葡聚糖喂食凡纳滨对虾84 d发现,喂食低剂量的β-1,3-葡聚糖(250 mg/kg饵料)能提高对虾的生长率,而高剂量的β-1,3-葡聚糖(500、1000 mg/kg饵料)能提高对虾的免疫力和抗亚硝酸盐能力,说明低剂量的β-1,3-葡聚糖(≤250 mg/kg饵料)可能大部分作为能量来源,只有高剂量的β-1,3-葡聚糖(≥500 mg/kg饵料)才能提供足够的β-1,3-葡聚糖来刺激对虾的免疫反应。本试验也发现了类似的现象,虽然2种剂量的ASP均能提高试验鱼血液白细胞吞噬能力、血清LZM活力以及头肾白细胞呼吸爆发活力、吞噬活力和增殖能力,但从攻毒试验可以看出,低剂量(500 mg/kg)组的累积死亡率高于高剂量(3000 mg/kg)组,尤其是喂食8周后。这说明ASP在点带石斑鱼消化道中可能被降解,需要在饵料中添加高剂量的ASP才能提高点带石斑鱼的抗病力。至于ASP在点带石斑鱼消化道中如何被降解,被以哪种形式(ASP原型、酶降解产物)吸收、转运并对其免疫力产生作用,尚需进一步研究。
从本试验结果可以看出,长期(8周)高剂量(3 000 mg/kg)喂食ASP比长期低剂量(500 mg/kg)和短期(4周)高/低剂量喂食更能提高点带石斑鱼((158.64±2.14)g)非特异性免疫力和抗病力。该规格点带石斑鱼饵料中ASP的最适添加量和最适喂食时间还需进一步研究。
致谢:天津海发珍品实业发展有限公司为本试验提供试验用鱼和养殖场地,在养殖过程中给予大力协助,在此表示衷心感谢。
[1] Reilly A,Kaferstein F.Food safety hazards and the application of the principles of the Hazard Analysis and Critical Control Point(HACCP)system for their control in aquaculture production[J].Aqucult Res,1997,28(10):735-752.
[2] Sakai M.Current research status of fish immunostimulants[J].Aquacult,1999,172:63-92.
[3] Tzianabos A O.Polysaccharide immunomodulators as therapeutic agents:structural aspects and biologic function[J].Clin Microbiol Rev,2000,13:523-533.
[4] Han S B,Park S K,Ahn H J,et al.Characteriaztion of B cell membrane receptors of polysaccharide isolated from the root of Acanthopanax koreanum[J].Int Immunopharmacol,2003,3:683-691.
[5] Lee K Y,Jeon Y J.Polysaccharide isolated from Poria cocos scerotium induces NF-κB/Rel activation and iNOS expression in murine macrophages[J].Int Immunopharmacol,2003,3:1353-1362.
[6] Schepetkin I A,Quinn M T.Botanical polysaccharides:Macrophage immunomodulation and therapeutic potential[J].Int Immunopharmacol,2006,6:317-333.
[7] Sun Y X,Xu Y P,Wang T T,et al.Effects of Astragalus polysaccharide on gene expression of lysozyme in coelmocytes of sea cucumber Apostichopus japonicus[J].Fish Sci,2009,28(10):572-574.
[8] Mei Q B,Tao J Y,Zhang H D,et al.Effects of Angelica sinensis polysaccharides on hemopoietic stem cells in irradiated mice[J].Zhongguo Yao Li Xue Bao,1988,9(3):279-282.
[9] Hong Y,Zhang Y H,Wang H L,et al.Effect of Angelica polysaccharide on the immune function in60Co radiated mice[J].Central China Medical Journal,2000,24(6):291-292.
[10] Hong Y,Liu Y M,Xiong X H,et al.Protective effect of Angelica polysaccharide on the function of erythrocyte immunity and hematopoiesis in mice damaged by radiation[J].J Clin Res,2002,19(1):31-32.
[11] Ye Y N,Koo M W L,Li Y,et al.Angelica sinensis modulates migration and proliferation of gastric epithelial cells[J].Life Sci,2001,68(8):961-968.
[12] Ye Y N,So H L,Liu E S L,et al.Effect of polysaccharides from Angelica sinensis on gastric ulcer healing[J].Life Sci,2003,72(8):925-932.
[13] Liu P J,Hsieh W T,Huang S H,et al.Hematopoietic effect of water-soluble polysaccharides from Angelica sinensis on mice with acute blood loss[J].Exp Hematol,2010,38(6):437-445.
[14] Zheng M,Wang Y P.Experimental study on effect of angelica polysaccharide in inhibitory proliferation and inducing differentiation of K562 cells[J].Chinese Journal of Integrated Traditional and Western Medicine,2002,22(1):54-57.
[15] Yang X B,Mei Q B,Zhou S Y,et al.The role of Angelica polysaccharides in inducing effector molecule release by peritoneal macrophages[J].Chin J Cell Mol Immunol,2004,20(6):747-749.
[16] Cao W,Li X Q,Liu L,et al.Structure of an anti-tumor polysaccharide from Angelica sinensis(Oliv.)Diels[J].Carbohydrate Polymers,2006,66(2):149-159.
[17] Song S D,Wang J W,Wang Y P,et al.Experimental study on the effect of Angelica polysaccharide on inhibition of proliferation and induced differentiation towards erythroid cell of human erythroleukemia cell line(K562)[J].Journal of Chongqing Medical University,2008,33(1):1-5.
[18] Ling X M,Ding H,Luo S D,et al.Study on the pharmacological mechanism of Angelilca polysaccharide on the immunocompetence and the effects of its anti-oxidation[J].Chin Hosp Pharm J,2002,22(10):584-586.
[19] Liu S P,Dong W G,Wu D F,et al.Study on the protective effects of Angelica sinensis polysaccharides on the colon injury in immunological colitis rats[J].Chin Pharmacol Bull,2003,19(6):693-696.
[20] Liu S P,Dong W G,Yu B P,et al.Protective effects of Angelica sinensis polysaccharides on acetic acid-induced rat colitis[J].World Chin J Digestol,2004,12(2):367-370.
[21] Hu Y L,Liu J G,Chen Y K,et al.Effect of Chinese herbal medicinal ingredients on IBDV infected cell[J].Animal Husbandry&Veterinary Medicine,2003,35(12):8-10.
[22] Jia M,Yao X J,Yang T H,et al.Antivirus effects of Angelica polysaccharides sulfate on L6565 murine leukemia virus[J].Chin J Pharmacol Toxicol,2005,19(2):93-97.
[23] Chen Y,Duan J A,Qian D W,et al.Assessment and comparison of immunoregulatory activity of four hydrosoluble fractions of Angelica sinensis in vitro on the peritoneal macroophages in ICR mice[J].Int Immunopharmacol,2010,10(4):422-430.
[24] Yang T H,Jia M,Meng J,et al.Immunomodulatory activity of polysaccharide isolated from Angelica sinensis[J].Int J Biol Macromol,2006,39(4-5):179-184.
[25] 林克冰,方琼珊.石斑鱼苗种期常见病害及其防治[J].福建水产,2006(4):52-54.
[26] 李宁求,白俊杰,吴淑琴,等.斜带石斑鱼3种致病性弧菌的分子生物学鉴定[J].水产学报,2005,29(3):356-361.
[27] Fukuda Y,Nguyen H D,Furuhashi M,et al.Mass mortality of cultured sevenband grouper,Epinephelus septemfasciatus,associated with viral nervous necrosis[J].Fish Path,1996,31:165-170.
[28] Wang Q K,Chen C X,Guo Y J,et al.Dietary polysaccharide from Angelica sinensis enhanced cellular defence responses and disease resistance of grouper Epinephelus malabaricus[J].Aquacult Int,2011,19:945-956.
[29] 吴叶,王昌梅,张丽芬,等.人及兔醛化红细胞的制备和应用[J].安徽农业科学,2008,36(21):8885-8886.
[30] Li Q,Zhan W B,Xing J,et al.Production,characterisation and applicability of monoclonal antibodies to immunoglobulin of Japanese?ounder(Paralichthys olivaceus)[J].Fish Shell?sh Immunol,2007,23:982-990.
[31] Cheng A C,Tu C W,Chen Y Y,et al.The immunostimulatory effects of sodium alginate and iota-carrageenan on orange-spotted grouper Epinephelus coicoides and its resistance against Vibrio algino-lyticus[J].Fish &Shellfish Immunology,2007,22:197-205.
[32] Bradford M M.A rapid and sensitive method for the quantitation of microgram quantifies of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,7(72):248-254.
[33] 王伟庆,李爱杰.维生素C对中国对虾(Penaeus chinensis)免疫功能的影响[C]∥动物营养研究论文集.北京:中国农业大学出版社,1996:53-58.
[34] 郭小华,陆文清,邓萍,等.益生枯草芽孢杆菌MA139增殖培养基的优化[J].中国农业大学学报,2006,11(3):41-46.
[35] Wu F C,Ting Y Y,Chen H Y.Dietary docosahexaenoic acid is more optimal than eicosapentaenoic acid affecting the level of cellular defence responses of the juvenile grouper Epinephelus malabaricus[J].Fish &Shellfish Immunology,2003,14:223-238.
[36] Gebran S J,Romano E L,Pons H A,et al.A modified colorimetric method for the measurement of phagocytosis and antibodydependent cell cytotoxicity using 2,7-diaminofluorene[J].Journal of Immunological Methods,1992,151:255-260.
[37] Shephard K L.Functions for fish mucus[J].Reviews in Fish Biology and Fisheries,1992,4:401-429.
[38] Palaksha K J,Shin G W,Kim Y R,et al.Evaluation of non-specific immune components from the skin mucus of olive flounder(Paralichthys olivaceus)[J].Fish &Shellfish Immunology,2008,24:479-488.
[39] 黄智慧,马爱军,王岷.鱼类体表黏液分泌功能与作用研究进展[J].海洋科学,2009,33(1):90-94.
[40] 梁英,黄文树,关瑞章,等.鱼类表皮黏液抗菌蛋白/肽研究进展[J].水生生物学报,2009,33(5):963-969.
[41] Cha S H,Lee J S,Song C B,et al.Effects of chitosan-coated diet on improving water quality and innate immunity in the olive flounder,Paralichthys olivaceus[J].Aquaculture,2008,278:110-118.
[42] 严仪昭.吞噬细胞产生氧自由基的机制及意义[J].生理科学,1989,9(4):10-13.
[43] Siwicki A K,Anderson D P,Rumsey G L.Dietary intake of immunostimulants by rainbow trout affects non-specific immunity and protection against furunculosis[J].Vet Immunol Immunopathol,1994,41:125-139.
[44] Yeh S P,Chang C A,Chang C Y,et al.Dietary sodium alginate administration affects fingerling growth and resistance to Streptococcus sp.and iridovirus,and juvenile non-specific immune responses of the orage-spotted grouper,Epinephelus coioides[J].Fish Shellfish Immunol,2008,25:19-27.
[45] Park K H,Jeong H D.Enhanced resistance against Edwardsiella tarda infection in tilapia(Oreochromis niloticus)by administration of protein-bound polysaccharide[J].Aquaculture,1996,143:135-143.
[46] L pez N,Cuzonb G,Gaxiolac G,et al.Physiological,nutritional,and immunological role of dietaryβ1-3 glucan and ascorbic acid 2-monophosphate in Litopenaeus vannamei juveniles[J].Aquaculture,2003,224:223-243.
[47] Zhao H X,Cao J M,Wang A L,et al.Effect of long-term administration of dietaryβ-1,3-glucan on growth,physiological,and immune responses in Litopenaeus vannamei(Boone,1931)[J].Aquaculture International,2012,20(1):145-158.
Dietary Angelica sinensis polysaccharide on Innate Immunity and Disease Resistance Against Edwardsiella tarda of Epinephelus malabaricus
WANG Qing-Kui1,2,XING Ke-Zhi2,ZHAO Hai-Yun2,CHEN Cheng-Xun2,WU Zhan-Yong2,MA Shen1
(1.The Key Laboratory of Mariculture,Ministry of Education,Ocean University of China,Qingdao 266003,China;2.Tianjin Key Laboratory of Aqua-Ecology and Aquaculture,Tianjin Agricultural University,Tianjin 300384,China)
In order to study the effects of Angelica sinensis polysaccharide(ASP)on innate immunity and disease resistance of Epinephelus malabaricus,fish(initial body weight(158.64±2.14)g)were fed diets containing different doses of ASP(0,500,3000 mg/kg)for four and eight weeks.Results showed that dietary ASP enhanced blood leucocytes phagocytic rate and serum lysozyme activity significantly(P<0.05),but exerted no influence on serum nitric oxide(NO),skin mucus lysozyme activity and antibacterial activity.Dietary ASP boosted head kidney leucocytes proliferation,respiratory burst activity and phagocytosis.The cumulative mortalities of fish challenged by Edwardsiella tarda were reduced in ASP-fed groups,compared to that in control groups.The cumulative mortality in fish fed with ASP at 3000 mg/kg for eight weeks was the lowest.The innate immunity and disease resistance against E.tarda in fish fed ASP at 3000 mg/kg for eight weeks were effectively enhanced.
Angelica sinensis polysaccharide;Epinephelus malabaricus;innate immunity;antibacterial activity
S963
A
1672-5174(2012)09-015-07
“十二五”国家科技支撑计划项目(2011BAD13B07)资助
2011-08-24;
2011-11-25
王庆奎(1978-),男,副教授。E-mail:wqkmail@yahoo.com.cn
**通讯作者:E-mail:kzxing@yahoo.com.cn
责任编辑 朱宝象

