肿瘤患者化疗前后外周血NK/T及Treg细胞比例分析
沈彦伟 高旭霞 李晶晶 谭纯文 袁瑛
肿瘤具有免疫逃逸功能是其典型生物学特性之一,其免疫逃逸的机制一直是肿瘤免疫领域的研究热点,目前主要归结于肿瘤弱抗原性和肿瘤的免疫抑制效应所致。机体无法激起正常的免疫应答来清除肿瘤细胞的原因,与肿瘤微环境中局部富集的免疫抑制性细胞(如Treg、MDSC、M2巨噬细胞等),降低了有效的抗肿瘤免疫反应有关。人体免疫系统的获得性免疫防御机制包括体液免疫和细胞免疫,在抗肿瘤免疫中起主导作用的是细胞免疫。T细胞是介导细胞免疫的中心环节,但1995年前后有学者研究发现,CD4阳性T淋巴细胞中有一群表面标志CD25阳性的细胞即CD4+CD25+T细胞,不仅不能“辅助”免疫反应,反而有显著抑制作用,将其命名为调节性T细胞(regulatory T cell,Treg)[1-3]。近年来,国内外都已有报道,肿瘤患者血液及瘤体组织中,Treg细胞的数量明显高于正常人,揭示了肿瘤免疫微环境的本质[1,4]。肿瘤患者外周血中增加的Treg细胞究竟来源何处?有文献表明,Treg细胞分为两类,其都表达CD4、CD25和FoxP3基因,一类是在胸腺T细胞成熟过程中自然发生的nTreg(natural Treg);另一类是在T细胞成熟过程中,幼稚型T细胞经细胞因子(TGF-β和retinoic acid)诱导分化而来的iTreg(induced Treg)[5]。结合肿瘤细胞高表达并分泌TGF-β这一现象,有学者认为,在肿瘤原位的浸润淋巴细胞中(tumor infiltrated lymphocyte,TIL)存在大量由肿瘤诱导产生的iTreg细胞,从而形成免疫抑制性微环境[6]。这一发现给肿瘤免疫逃逸学说提供了依据。而有关肿瘤微环境中其他免疫细胞(如巨噬细胞MΦ,树突状细胞DC等)调控肿瘤免疫逃逸的研究也已经大量报道[7-10]。
肿瘤的化疗具有一定免疫调节功能,已有多篇文献报道,化疗药物不仅可增强肿瘤细胞的免疫原性,而且还能通过影响免疫细胞的功能来提高机体的抗肿瘤免疫反应。但需特别注意的是,某些化疗药物也可能造成Treg增殖反弹。荷瘤小鼠使用大剂量伊立替康联合氟尿嘧啶、甲酰四氢叶酸时,Treg数目在淋巴细胞恢复期显著上升。那么,Treg细胞在化疗减轻瘤负荷及手术切除肿瘤的过程中,在肿瘤患者体内是否随着肿瘤的负荷而产生数目及功能的相应变化?手术或化疗之后,肿瘤微环境的改变,对机体整体的自然杀伤细胞(natural killer,NK)、CD4/CD8T细胞、Treg细胞是否产生了一系列的调节?本文旨在探讨肿瘤患者化疗前后,外周血免疫激活细胞及免疫抑制细胞比例变化。
材料与方法
一、材料
1.人源标本:病例选自2010年2月至2012年2月在本院肿瘤科住院的晚期恶性肿瘤患者(肺癌、肠癌、乳癌、食道癌、胃癌)共140例,其中包括结直肠癌31例、胃癌21例、肺癌61例、乳腺癌27例,肿瘤患者化疗前、化疗1次后、2次后、3次后、4次后、5次后外周静脉血。其中男性80例,女性50例;年龄28~81岁,中位年龄57岁。同时从门诊体检部门获得38例健康人的血样作为对照组的设立。年龄15~81岁,中位56岁,其中男23例,女15例,均排除糖尿病、甲亢、甲减、肿瘤等疾病。
2.流式细胞术用试剂:APC-anti-hCD4、FITC-anti-hCD8、PE-anti-hCD3、FITC-anti-hCD4、PECy5-anti-hCD127、FITC-anti-hCD3、PE-anti-hCD 56及PE-anti-hCD25(eBioscience);PBS(pH 7.4):NaCl 8.0 g,KCl 0.2 g,无水Na2HPO41.44 g,无水KH2PO40.24 g,双蒸水1 L溶解,调整pH值,高压灭菌。取BD肝素抗凝的外周血2 ml,室温下孵育15 min,PBS洗涤2次,用流式细胞仪(Becton Dickson FACSCalibur,USA)检测,Cellquest软件分析数据,记录阳性细胞百分率,减去非特异对照值。
二、方法
流式细胞术分析:所有健康人外周血、恶性肿瘤患者外周血样本均为EDTA抗凝血(BD),加红细胞裂解液,分离得到的PBMC悬液。首先使用预冷PBS洗涤2遍,再经4℃抗体孵育30 min染色后,离心PBS洗涤一次。使用200 μl PBS重悬细胞,FCM流式细胞术分析患者外周血中CD4+/CD8+T细胞比例及CD4+T细胞中Treg细胞的比例及NK细胞比例。使用的抗体列于下方:APC-anti-hCD4、FITC-anti-hCD8、PE-anti-hCD3、FITC-anti-hCD4、PECy5-anti-hCD127、FITC-anti-hCD3、PE-anti-hCD5及PE-anti-hCD25(eBioscience)流式分析所用仪器为FACSCalibur,软件使用Cell Quest。所有实验均重复三次以保证系统稳定性。
三、统计学分析
SPSS 18.0版软件进行统计分析,采用独立样本t检验,比较肿瘤患者与健康对照组的外周血中Treg及NK细胞量。用重复测量方差分析,比较肿瘤患者化疗前后外周血中Treg及NK细胞比例的变化。3次重复实验得到的比值平均数进行t检验。P<0.05为差异有统计学意义。
结果
1.肿瘤患者外周血中NK细胞及Treg比例均显著高于健康对照组统计结果显示(图1,表1),采集的69例初次确诊的恶性肿瘤患者外周血中NK细胞比例(18.56%±9.19%)要显著高于健康人(12.37%±6.24%),Treg细胞比例(6.95%±8.96%)也显著高于健康对照组(4.25%±2.59%)。
2.肿瘤患者化疗过程外周血中NK细胞及Treg比例的变化趋势:统计学分析显示(表2),对69例肿瘤患者化疗过程后续随访中发现,外周血中NK细胞比例以及Treg细胞比例虽然有些变化,而且一直高于化疗前水平,但随着化疗进程,NK细胞以及Treg的比例变化差异无统计学意义。CD4+T辅助细胞与CD8+T杀伤细胞的百分比和比例变化差异无统计学意义。
针对患者所患肿瘤不同进行分层分析,发现不同的恶性肿瘤,化疗期间CD4+辅助性T细胞、CD8+杀伤性T细胞、CD4+CD25highCD127-调节性T细胞及CD3-CD56+NK细胞百分比有不同的变化趋势:在结直肠癌、胃癌患者中发现,CD4+辅助性T细胞、CD4+CD25highCD127-调节性T细胞,在化疗前呈较高水平,随着化疗的进行,有着先降低后升高的趋势,而CD8+细胞毒性T细胞在化疗前呈低水平。随着化疗的进行,有着先升高后降低的趋势,同时天然免疫杀伤细胞NK在化疗过程中也出现了先升高后降低趋势。
而在肺癌及乳癌患者的化疗过程中,CD4+辅助性T细胞、CD4+CD25highCD127+调节性T细胞、CD8+细胞毒性T细胞、天然免疫杀伤细胞NK细胞,这四种CD分型的淋巴细胞的变化趋势恰好与胃癌、结直肠癌患者呈相反变化(图2~5)。
注:与对照组比较,aP<0.01,bP<0.05
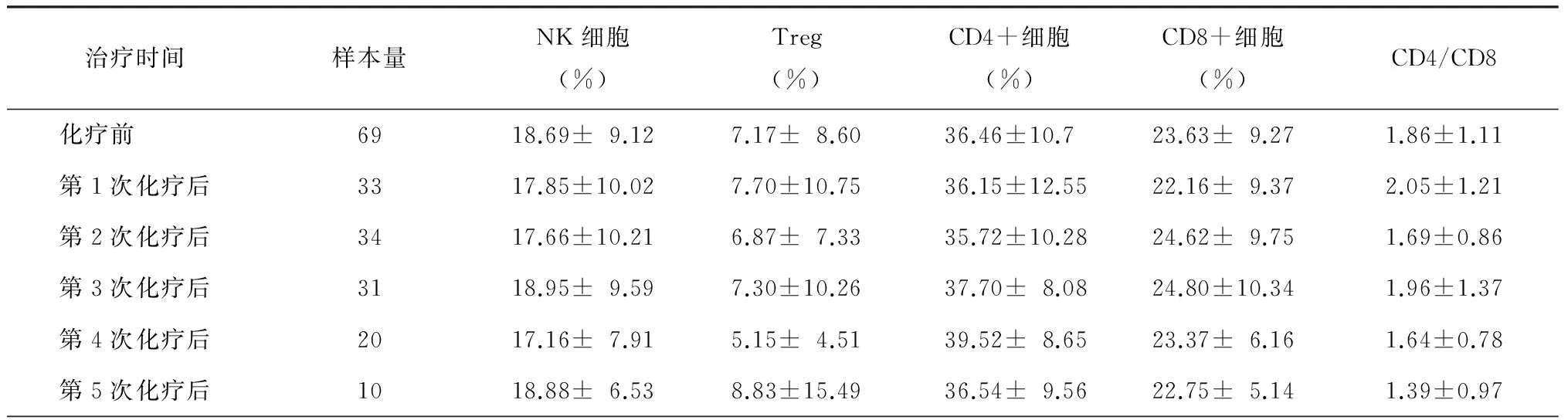
表2 肿瘤患者化疗前后外周血中NK细胞及Treg比例的变化
讨论
人体的免疫系统稳态主要取决于人体对外来抗原的免疫反应以及对自身抗原免疫耐受之间的平衡。而肿瘤细胞本身带有一些自身抗原,故许多研究者认为机体抗肿瘤反应与自身免疫反应有着共同的基础。Treg细胞作为肿瘤免疫逃避机制中的一种重要媒介正受到越来越多的关注。它在多种肿瘤患者的外周血和肿瘤组织呈现高表达,其可能通过抑制活化的T细胞发挥免疫抑制作用。
相关研究表明,随着年龄的增长,机体内的Treg细胞会不断增高[11],故老年人肿瘤发病率较青年人高,这可能与Treg细胞在肿瘤免疫逃避中发挥的作用相关。而本实验结果也证实,在恶性肿瘤患者中,CD4+CD25highCD127-Treg及NK细胞比例较正常人对照组明显增高。而人体固有免疫在抗肿瘤免疫反应中也起着重要作用,化疗前后NK细胞未见明显变化,说明化疗并未抑制机体的免疫反应。
本研究由于样本数量有限,没有统计得到化疗期间患者外周血中的各型淋巴细胞的显著差异,但是仍然发现到一些我们值得探讨的趋势。随着化疗的进行,Treg和NK细胞,CD8细胞毒性T淋巴细胞之间此消彼长的趋势,随着本研究的继续深入,可能进一步证实Treg细胞在肿瘤中富集,形成免疫抑制微环境,是通过抑制CD4+、CD8+T淋巴细胞及NK细胞的肿瘤杀伤效应,介导肿瘤免疫逃逸的可能。
根据实验结果,肿瘤患者Treg比例明显增高,如果能下调Treg细胞的比例将有助于提高机体抗肿瘤能力。目前已有多种免疫抑制信号相关的阻断抗体上市(如CTLA-4的抗体Ipilimumab等)故去除肿瘤患者的Treg细胞可能是治疗肿瘤的一种有效的新疗法。
(本文图1~5见光盘)
[1]EbertEC,Roberts AI,Devereux D,et al.Selective immunosuppressive action of a factor produced by colon cancer cells[J].Cancer Res,1990,50(16):6158-6161.
[2]Sakaguchi S,Toda M,Asano M,et al .T cell-mediated maintenance of natural self-tolerance:its breakdown as a possible cause of various autoimmune diseases[J].J Autoimmun,1996,9(2):211-220.
[3]Sakaguchi S,Sakaguchi N,Shimizu J,et al.Immunologic tolerance maintained by CD25+CD4+regulatory T cells:their common role in controlling autoimmunity,tumor immunity,and transplantation tolerance [J].Immunol Rev,2001 Aug,182:18-32.
[4]刘莉,丁乾,姚军霞,等.结直肠癌患者外周血CD4+CD25high调节性T细胞分析[J].中华肿瘤防治杂志,2007,14(2):110-113.
[5]Chen W,Jin W,Hardegen N,et al.Conversion of peripheral CD4+CD25-naive T cells to CD4+CD25+regulatory T cells by TGF-beta induction of transcription factor Foxp3[J].J Exp Med,2003,198(12):1875-1886.
[6]Strauss L,Bergmann C,Gooding W,et al.The frequency and suppressor function of CD4+CD25highFoxp3+T cells in the circulation of patients with squamous cell carcinoma of the head and neck[J].Clin Cancer Res,2007,13(21):6301-6311.
[7]Ding T,Xu J,Wang F,et al.High tumor-infiltrating macrophage density predicts poor prognosis in patients with primary hepatocellular carcinoma after resection[J].Hum Pathol,2009,40 (3):381-389.
[8]Haringer B,Lozza L,Steckel B,et al.Identification and characterization of IL-10/IFN-gamma-producing effector-like T cells with regulatory function in human blood[J].J Exp Med,2009,206(5):1009-1017.
[9]Dobrzanski MJ,Rewers-Felkins KA,Quinlin IS,et al.Autologous MUC1-specific Th1 effector cell immunotherapy induces differential levels of systemic TReg cell subpopulations that result in increased ovarian cancer patient survival[J].Clin Immunol 2009,133(3):333-352.
[10]Liu Q,Zhang C,Sun A,et al.Tumor-educated CD11bhighIalow regulatory dendritic cells suppress T cell response through arginase I[J].J Immunol 2009,182(10):6207-6216.
[11]De Ferranti S,Rifai N.C-reactive protein and cardiovascular disease:a review of risk prediction and interventions[J].Clin Chim Acta,2002,317(1-2):1-15.

