123I的制备及其标记新型小分子融合肽的初步研究
杨远友,刘 宁,范成中,廖家莉,许发伦,石福坤,兰 栋,唐 军
1.四川大学 原子核科学技术研究所 辐射物理及技术教育部重点实验室,四川 成都 610064;2.四川大学 华西医院 核医学科,四川 成都 610041;3.四川大学 物理学院,四川 成都 610064
123I是加速器生产核素,其半衰期为13.2 h,通过电子俘获发射159 keV的光子,比活度高(7.10×1016Bq/g),对病人的辐射剂量低,在同样活度下对甲状腺的剂量只有131I的1/100左右,可在短期内重复检测,探测效率高,成像清晰,被认为是最适合作体内诊断的放射性核素之一[1-2]。
单克隆抗体介导的靶向显像与靶向治疗是对肿瘤以及血栓栓塞性疾病等诊断与治疗的有效手段之一。由于完整单抗分子量大,穿透力差,在靶组织中浓集需较长时间且分布不均匀,清除慢;为得到穿透力强的小分子片段,采用DNA重组技术,将编码特异抗体轻链可变区基因序列和重链可变区基因序列,用特别设计的寡核苷酸连接,可得到2~35 kDa的肽段,重链可变区的羧基端通过一条12~20残基的肽与轻链氨基端相连接,其特异性和亲和力与亲本抗体相同。小分子融合肽拟似物VHCDR1-VHFR2-VLCDR3为经过DNA重组技术得到的分子量约为3 kDa的抗体片段[3]。近期进行了131I标记VHCDR1-VHFR2-VLCDR3的研究,其标记物对肿瘤组织已显示出良好的特异性和亲和力[4]。在此基础上,本实验拟用核性质优于131I的123I标记小分子融合肽拟似物VHCDR1-VHFR2-VLCDR3,以期得到具有良好靶向性的放射性显像药物123I-VHCDR1-VHFR2-VLCDR3。
基于上述设想,本实验首先进行了123I的生产,在此基础上进行小分子融合肽拟似物的123I标记,并对标记物在正常小鼠的体内分布进行初步研究。
1 实验材料和方法
1.1 实验材料和仪器
CS-30回旋加速器,美国TCC公司生产;溴代琥珀酰亚胺(NBS,纯度大于98%),美国Acros公司;硅胶(silica gel,0.125~0.178 mm)、TLC硅胶板(20 cm×20 cm),美国Aldrich公司;凝胶Sephadex G10,瑞典Pharmacia公司;BS210S电子天平,感量0.001 g,德国Sartorius公司;甘氨酸(glysine),美国Sigma公司;FH-603井型闪烁探头、FH463A自动定标器,北京核仪器厂;VHCDR1-VHFR2-VLCDR3,小分子融合肽,相对分子质量约为3 kDa,本课题组自制;石英蒸馏器,本实验室设计加工;Sb2O3,纯度99.99%,天津化学试剂一厂;KOH、柠檬酸,成都科龙化工试剂厂产品;其它试剂为市售分析纯;蒸馏水为三蒸水。
昆明系小鼠,(20±2)g,雌雄各半,购于四川大学华西医学动物实验中心。
1.2 实验方法
1.2.1123I的制备123I的制备方法主要有两大类:第一类是用带电粒子核反应先产生123Xe,然后由其衰变为123I[5-6];第二类是用带电粒子轰击碲靶或锑靶直接产生123I[7-11]。考虑本实验室条件(CS-30加速器)及研制成本,决定采用天然丰度的锑作为靶材料,利用121Sb(α,2n)123I核反应制备医用123I。根据Sb(α,xn)反应(表1)和激发曲线,122I半衰期较短,126I和125I的产额较低,主要副反应为124I,选择适当能区以及选择适当靶厚,可以控制124I的产额[12-13],得到核纯度比较好的医用123I。试验中采用靶厚度为61~67 mg/cm2的薄靶,如靶厚大于144 mg/cm2,则有可能发生大量的(α,n)反应,从而生产大量杂质124I和126I。虽然这种方法会损失一定产额,但是可以生产出纯度好的医用123I。本实验α粒子的能量控制在26.5 MeV左右。

表1 天然Sb靶制备123I的反应及其副反应[10]
1)Sb2O3电镀液的配制
将10 g Sb2O3、35 g KOH以及182.5 g柠檬酸溶入500 mL水中,在加热煮沸的条件下搅拌数分钟,得到Sb2O3电镀液。
2)Sb电镀条件
将电镀装置电压调至6 V、电流调至85 mA、阴极和阳极间距调至3 cm左右。在上述条件下电镀14~15 h便可得到61~67 mg/cm2的均匀薄靶,冲洗晾干备用。
3)Sb靶的辐照
将制备好的锑靶在四川大学CS-30回旋加速器上,通过121Sb(α,2n)123I核反应,照射2~3 h,入射的α粒子束流强度在15 μA左右,能量为26.5 MeV左右,将束流以小角度入射到靶上,即采用所谓“倾斜靶”(如束流对靶子的入射角度为6度,其照射面积就增加了10倍,受照热功率是垂直照射靶的1/10,而且散热面积也增加了10倍),并用水对靶进行冷却。辐照结束后将靶子放置冷却2 h左右,让短寿命杂质核素衰变。
4)辐照Sb靶的干蒸馏分离及Na123I的获取
“冷却”2 h后取出辐照靶片,小心放入石英蒸馏装置中的石英舟里将石英舟加热至600~750 ℃,用N2作为载气,以15~30 cm3/min的流速通过靶片,用硅胶吸附蒸出的123I(硅胶柱用自来水冷却),再用活性碳和0.1 mol/L NaOH溶液吸附残余的123I,尾气最后排空。硅胶吸附柱用100~300 μL的0.1 mol/L NaOH溶液淋洗,洗脱液即为Na123I溶液。将Na123I溶液进行放射化学纯度和γ能谱测定,以确定123I的放射化学纯度和核纯度。Na123I的放射化学纯度测定采用2010版《药典》方法[14],以75%甲醇为展开剂,参照放射化学纯度测定法(附录ⅩⅢ一法)进行[15]。用于动物实验时,用0.5 mol/L HCl调pH=7.0,并用0.1 mol/L磷酸盐缓冲溶液(PBS)(pH=7.0)稀释配成Na123I注射液。
1.2.2123I标记小分子融合肽及其分离 在微型反应管中加入100 μL(1.85×107Bq)Na123I、10 μL醋酸、10 μL 10.0 g/L溴代琥珀酰亚胺的生理盐水溶液和10 μL 1.0 g/L VHCDR1-VHFR2-VLCDR3的生理盐水溶液,室温下反应10~30 min。然后加入50 μL 0.5 mol/L glysine终止反应。用TLC测量标记率和放化纯度(TLC条件:流动相V(CHCl3)∶V(CH3OH)=4∶1)。另外,取部分标记混合物用Sephadex G10柱(20 cm×10 mm)进行标记物123I-VHCDR1-VHFR2-VLCDR3的分离,以0.1 mol/L pH=7.6的磷酸缓冲溶液作淋洗液,收集淋洗液,每管1 mL,测定每管的放射性,绘出淋洗曲线,用TLC测量标记率和放化纯度(TLC条件同前)。
1.2.3123I标记物在正常小鼠体内的分布 将40只小鼠(雌雄各半)随机分为10组,经腹腔注射0.1 mL(30 kBq)未分离标记物123I-VHCDR1-VHFR2-VLCDR3和分离后的123I-VHCDR1-VHFR2-VLCDR3,注射后分别于1、3、6、12、24 h处死小鼠。取血、心脏、肝、脾、肾、肺、胃、小肠、肌肉、甲状腺(含颈部)等组织器官,称重并测其放射性计数,计算各组织的放射性摄取率。放射性摄取率用0.1 mL相应标记物的放射性计数作为标准,以每克组织摄取放射性占总注射剂量的百分比%ID/g表示(甲状腺的摄取率以%ID表示)。
2 结果和讨论

表2 辐照锑靶参数及123I产额
2.1123I的制备
以天然锑作为辐照靶,利用121Sb(α,2n)123I核反应制备123I,只要根据Sb(α,xn)反应的激发曲线选择适当的能区以及适当的靶厚,就可以限制124I、126I等核素的生成,得到纯度较高的医用123I。实验中辐照靶参数及123I产额列于表2。靶的平均厚度为63.2 mg/cm2,最高64.3 mg/cm2,最低62.2 mg/cm2,控制α粒子能量为26.5 MeV、束流强度为15 μA的情况下,123I的平均产额为11.6 TBq/(A·h)。靶厚度对123I产额有一定影响,但在厚度为62.2~64.3 mg/cm2的情况下无显著性影响。
经测定,Na123I的Rf值在0.6~0.7左右,其放射化学纯度均高于99.3%。通过γ能谱测定,主要能区有:159 keV,123I,约98.6%;603 keV,124I,约1.0%;668 keV,126I,约0.4%。这说明得到了核纯度较高的123I。
2.2 小分子融合肽的123I标记、分离及其体外稳定性
由于识别EB病毒(Epstein-Barr virus,EBV)表面抗原gp350/220抗原决定簇的单克隆抗体拟似物:VHCDR1-VHFR2-VLCDR3及VHCDR1-VLCDR3-VHFR2(对照)两种化合物中均含有多个酪氨酸基团,可用放射性核素123I直接标记。标记过程简单易行,可在短时间完成(10 min左右)。123I直接标记后其放化纯度可达90%~95%(表3),可不分离直接进行动物实验。本实验对标记混合物还用Sephadex G10凝胶柱进行了分离,其淋洗曲线示于图1。淋洗得到的第1个放射性峰为标记物123I-VHCDR1-VHFR2-VLCDR3,经TLC分析鉴定,123I-VHCDR1-VHFR2-VLCDR3的Rf在原点处,与VHCDR1-VHFR2-VLCDR3的Rf=0一致,而游离123I的Rf=0.57。淋洗液的放化纯度达96.6%,可直接用于体内动物实验。将未分离标记物123I-VHCDR1-VHFR2-VLCDR3和分离后的标记物进行了放化纯度、体外稳定性的比较(表3)。从表3可以发现,通过Sephadex G10凝胶柱分离后的123I-VHCDR1-VHFR2-VLCDR3,其放化纯度高于未分离的123I-VHCDR1-VHFR2-VLCDR3。此外,标记物(包括分离和未分离的123I-VHCDR1-VHFR2-VLCDR3)在室温下放置48 h后,其放化纯度无明显变化,表明标记物在体外是稳定的。
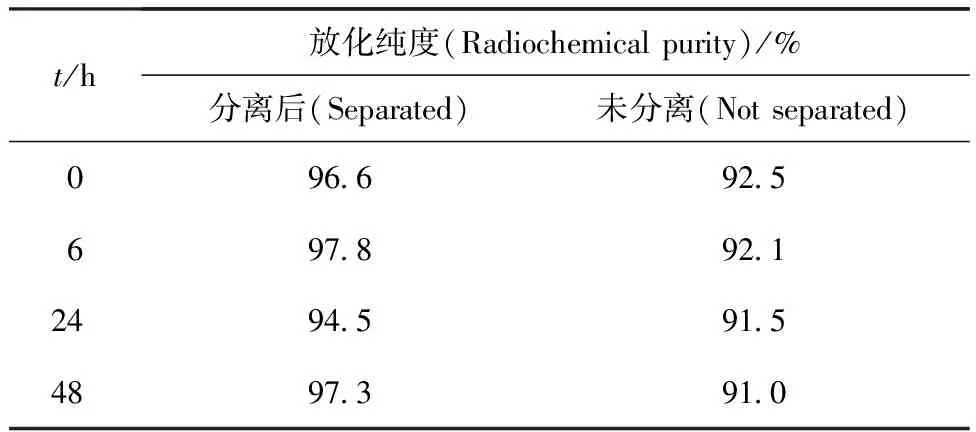
表3 123I标记VHCDR1-VHFR2-VLCDR3的放化纯度变化

图1 123I-VHCDR1-VHFR2-VLCDR3经Sephadex G10的淋洗曲线
2.3123I标记物在正常小鼠体内的分布
对分离后的123I标记物在正常小鼠体内的分布进行了初步探讨,并与未分离123I标记物进行了对比(表4)。表4结果表明:123I标记的小分子融合肽在正常小鼠体内代谢较快,6 h后在组织的放射性摄取已较低;从放射性在各组织的分布看,在胃中摄取较高,123I标记物的代谢有可能是通过胃肠道进行的;123I标记物在各个时间点在甲状腺的放射性摄取较低(接近于肌肉组织),说明标记物在体内不易发生脱碘反应;除在胃中的1 h和3 h外,标记物分离与未分离两者在正常小鼠体内的分布、代谢无明显差异。
通过上述实验表明,123I标记物在体内不易脱碘且具有较高的体外稳定性,有必要对其进行更深入的研究。下一步将进行123I标记的小分子融合肽对荷Raji细胞系裸鼠亲肿瘤靶向分子显像研究,探讨荷瘤靶向分子显像的可行性。
3 结 论
天然锑靶通过121Sb(α,2n)123I反应,控制锑靶厚度在62.2~64.3 mg/cm2和α粒子能量在26.5 MeV的情况下,可以得到核纯度高达98.6%的123I。在制备123I的基础上进行了小分子融合肽拟似物的123I标记,其标记率可达90%以上。标记物123I-VHCDR1-VHFR2-VLCDR3的体内外实验表明,123I标记物在体内不易脱碘且具有较高的体外稳定性,其研究结果为123I显像药物的研究奠定了基础。
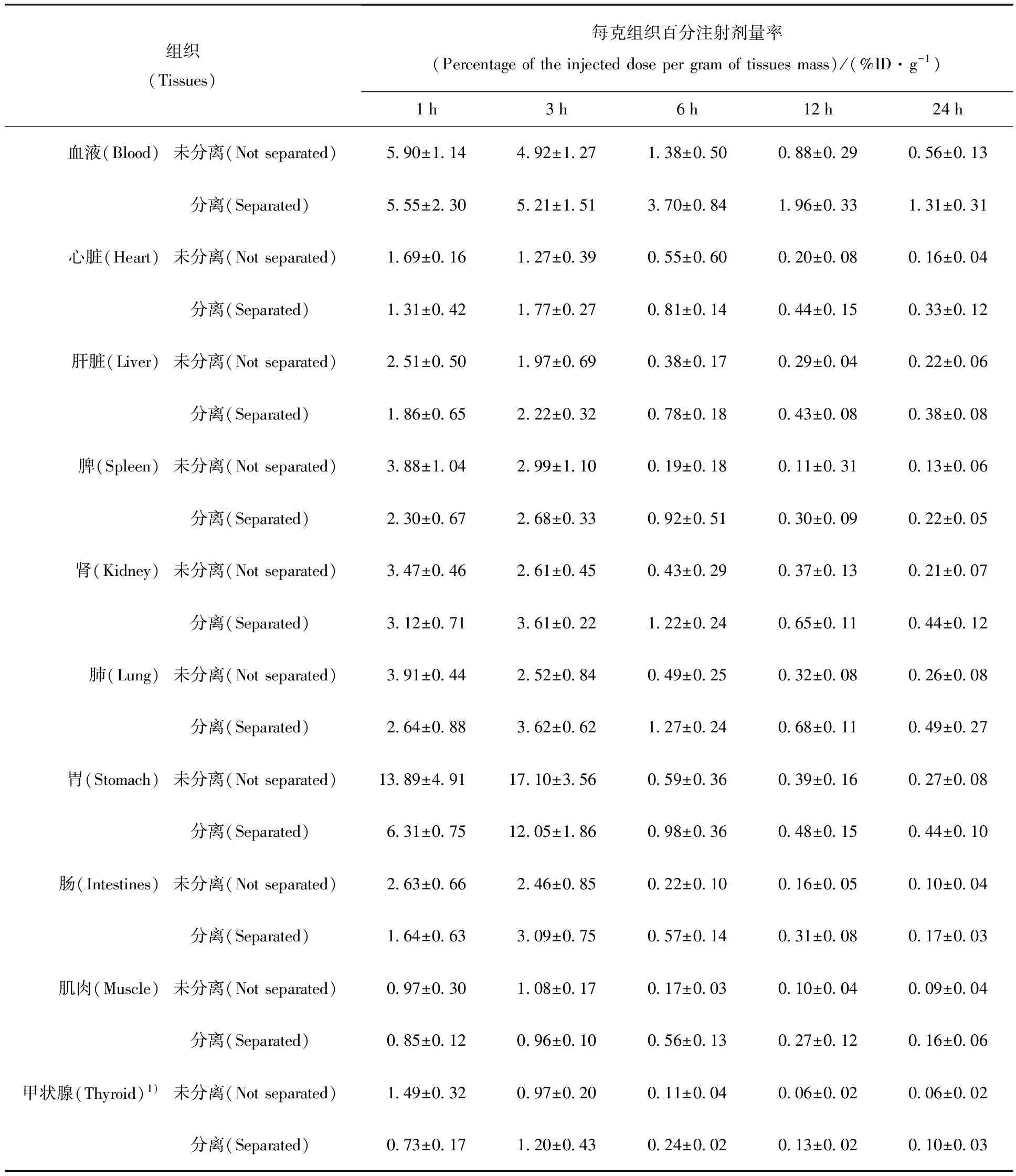
表4 分离与未分离的123I标记物在正常小鼠体内的分布实验
[1]邓新荣,刘飞,罗志福.123I放射性药物简介[J].中华核医学杂志,2007,27(3):189-190.
[2]邓新荣,罗志福.关于开展123I标记药物开发的调研[G]∥中国原子能科学研究院年报.北京:中国原子能科学研究院,2006:262-262.
[3]Qiu X Q,Wang H,Cai B,et al.Small Antibody Mimetics Comprising Two Complementaritydetermining Regions and a Framework Region for Tumor Targeting[J].Nature Biotech,2007,25: 921-929.
[4]Xie P,Fan C Z,Qiu X Q,et al.131I Labeled Small Antibody Mimetic VHCDR1-VHFR2-VLCDR3as a Novel Radiopharmaceutical for Targeting Burkitt’s Lymphoma in Nude Mice[J].Mol Imag Biol,in press.
[5]刘玉平,赵贵植,张宝琦,等.124Xe气体靶制备高纯度123I装置中气体处理系统的研制[G]∥中国原子能科学研究院年报.北京:中国原子能科学研究院,2007:299-300.
[6]罗志福,尹卫,张宝琦,等.用124Xe 气体靶制备高纯度123I装置的研制进展[G]∥中国原子能科学研究院年报.北京:中国原子能科学研究院,2007:300-301.
[7]Takacs S,Azzam A,Sonck M,et al.Excitation Function of122Te(d,n)123I Nuclear Reaction: Production of123I at a Low Energy Cyclotron[J].Appl Radiat Isot,1999,50(3): 535-540.
[8]郑建,汪勇先.加速器制备123I[J].核技术,1996,19(4):241-248.
[10]罗成,宋学光,毕素欣,等.123I的制备及其快速标记[J].核化学与放射化学,1983,5(3):224-232.
[11]Hassan K F,Qaim S M,Saleh Z A,et al.Alpha-Particle Induced Reactions onnatSb and121Sb With Particular Reference to the Production of the Medically Interesting Radionuclide124I[J].Appl Radiat Isot,2006,64(1): 101-109.
[14]碘[131I ]化钠口服溶液[M]∥中国药典二部.2010:1 072.
[15]附录ⅩⅢ,放射性药品检定法,一法[M]∥中国药典二部,2010:附录123-124.

