兔抗小鼠多发性骨髓瘤细胞多克隆抗体的制备及抗肿瘤研究
母波,梁素华,申跃武,章欢
(川北医学院基础医学院生物教研室,医学影像四川省重点实验室,四川 南充 637000)
兔抗小鼠多发性骨髓瘤细胞多克隆抗体的制备及抗肿瘤研究
母波,梁素华△,申跃武,章欢
(川北医学院基础医学院生物教研室,医学影像四川省重点实验室,四川 南充 637000)
目的:制备小鼠多发性骨髓瘤全细胞兔多克隆抗体,并初步研究其抗肿瘤活性。方法:用小鼠多发性骨髓瘤细胞MPC-11活细胞通过背部皮内多点注射多次免疫新西兰大白兔,收集血清。然后采用亲和层析系统纯化血清中的多克隆抗体。用ELISA检测纯化多克隆抗体的效价,MTT法分析多克隆抗体对MPC-11增殖的影响,通过皮下肿瘤模型研究多克隆抗体对荷瘤小鼠体内肿瘤生长的影响。结果:我们获得了高特异性的多克隆抗体,ELISA检测抗体滴度在1∶20 000以上,MTT研究发现200 μg/mL多克隆抗体处理骨髓瘤细胞MPC-11 48 h后,明显抑制骨髓瘤细胞生长;体内研究发现,多克隆抗体明显抑制小鼠皮下肿瘤的生长。结论:实验获得了高效价的特异性兔抗小鼠骨髓瘤细胞多克隆抗体,通过体内体外研究发现,多克隆抗体能够明显抑制肿瘤细胞的生长,为进一步研究多发性骨髓瘤的诊断和治疗提供了新的方法。
多发性骨髓瘤;多克隆抗体;免疫治疗
多发性骨髓瘤(multiple myeloma,MM)是骨髓内浆细胞异常增生的一种恶性肿瘤。虽然常规的放、化疗和干细胞移植等方案使患者的缓解率和无病生存期明显提高,但最终难免复发[1]。近年来,肿瘤分子免疫学的快速发展为其治疗开辟了新途径,尤其是以靶向肿瘤特异性抗原的单克隆抗体治疗已显示出重要作用[2],以Rituximab[3]、alemtuzumab[4]、atlizumab[5]和atlezumab[6]等单克隆抗体最具有希望。然而,因为多发性骨髓瘤表达多种细胞表面抗原[7],而呈现出高度异质性。另外,患者之间的差异性以及多发性骨髓瘤治疗中出现的药物耐受等原因,使得单克隆抗体治疗多发性骨髓瘤的效果有限。因此,利用靶向多个抗原的多克隆抗体用于治疗多发性骨髓瘤也许是值得尝试的方式。为此,本研究利用小鼠多发性骨髓瘤全细胞免疫新西兰大白兔制备多克隆抗体并初步研究其抗肿瘤活性,以期为多克隆抗体的研制和多发性骨髓瘤治疗作用的研究奠定基础。
1 材料和方法
1.1 实验材料
小鼠多发性骨髓瘤细胞MPC-11由四川大学生物治疗国家重点实验室杨金亮教授惠赠,福氏完全佐剂、福氏不完全佐剂和ELISA生色底物(购自Sigma公司),普通蛋白分子量标准和彩色预染蛋白分子量标准(购自BMA公司),十二烷基硫酸钠(SDS)(购自Sigma公司),二抗(FITC标记羊抗兔IgG)购于北京中山金桥生物技术公司,其他试剂均为国产分析纯。
1.2 抗体的制备和纯化
将2只雌性新西兰大白兔(购自四川大学华西实验动物中心)先适应性喂养1周。每只动物免疫前先于一侧耳缘抽取2 mL静脉血,4℃静置过夜,取血清作阴性对照。初次免疫用弗氏完全佐剂加MPC-11细胞(1×107~5×107)背部皮下注射免疫动物,每只新西兰大白兔注射2~3点,每点注射200 μL;第14天用弗氏不完全佐剂加MPC-11细胞,同样剂量免疫新西兰大白兔加强免疫;第28天和38天时再次加强免疫;第45天颈动脉采血80 mL,4℃静置过夜,取血清。
多克隆抗体的纯化用亲和层析系统纯化(AKTA explore,GE,USA),将含骨髓瘤细胞多克隆抗体的血清上样于用10倍柱体积的Buffer A(20 mM NaH2PO4,0.15 M NaCl,pH 7.2~9.0)平衡的XK16/40柱子,填料为Mabselect,再用5倍柱体积的Buffer A洗柱子;用Buffer B(0.1 M sodium citrate,pH 3.0)线性梯度洗柱,直至有洗脱峰的出现;收集洗脱峰液体,同时用中和Buffer(1M Tris-HCl,pH8.0)调节洗脱液pH7.2左右;将收集的洗脱液用透析袋置于PBS缓冲液(pH7.2)在4摄氏度下透析,将透析的收集液冻干即得骨髓瘤细胞多克隆抗体。对照多克隆抗体按照上述方法纯化未免疫新西兰大白兔血清中免疫球蛋白。
1.3 兔抗人多发性骨髓瘤全细胞多克隆抗体的ELISA检测
将MPC-11细胞5×103加到用多聚赖氨酸预先包被的96孔板,4℃孵育过夜;5%脱脂牛奶室温封闭1 h;将5 mg多克隆抗体倍比稀释(1∶2 000,1∶5 000,1∶10 000和1∶20 000)加入上述各孔,37℃孵育2 h;含体积分数为0.5%Tween20的PBS(PBST)缓冲液洗3次;加入1∶1 000稀释交联有辣根过氧化物酶(HRP)的抗兔二抗,37℃孵育2 h;PBST缓冲液洗3次;加入显色底物,室温避光放置15 min;加入1 mol/L HCl终止反应;用酶标仪490 nm测定光密度值(oplical density,OD)。
1.4 MTT实验分析
培养小鼠骨髓瘤细胞MPC-11接种到96孔板,每孔5×103,每组设三个复孔。培养24 h后,不同浓度的多克隆抗体(10 μg/mL、50 μg/mL、100 μg/mL、200 μg/mL)处理细胞,分别处理24 h、48 h和72 h,以完全培养基稀释MTT,终浓度为5 mg/mL,每孔加入20 μL,将细胞放回5%CO2培养箱中孵育4 h,再吸去含MTT的培养基,每孔加入150 μL二甲亚砜(DMSO),用酶标仪在490 nm波长处读取吸收值。计算抑制率=(1-实验组OD值/对照组OD值)×100%。
1.5 多克隆抗体抗肿瘤效应的体内观测
将MPC-11细胞在无菌条件下种植于30只6~8周龄BALB/c小鼠右侧背部皮下,接种剂量为100 mL/只,接种细胞数为5×105个/只,当能扪及肿瘤结节时随机将小鼠分为三个组,每组7只。然后分别尾静脉注射多克隆抗体(200 μg/dose),对照抗体(200 μg/dose)和生理盐水,每次注射体积为100 μL,一共注射7次。开始治疗后每三天观察一次并用游标卡尺测量肿瘤长、宽径,记录小鼠一般状况和死亡时间;实验过程中注意观察小鼠皮毛色泽,有无脱毛,食欲及活动变化以及生存情况。肿瘤体积按照Steel经验公式:肿瘤体积V(mm3)=宽度2×长度×0.5计算,当对照组小鼠肿瘤体积达4 000 mm3时,将各组小鼠全部处死。
2 结果
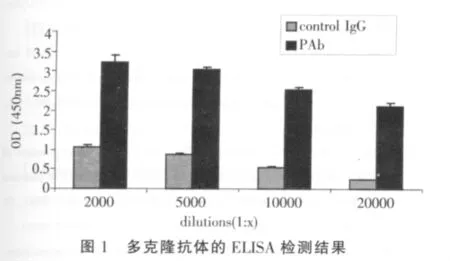
为了证明通过亲和层析纯化后所得抗体具有活性,我们通过用细胞ELISA测定抗体的效价。如图1所示,我们可以发现,1∶2 000或者1∶5 000稀释的多克隆抗体比1∶10 000或者1∶20 000稀释的呈现出更强的抗原结合特性。并且,与相同滴度对照IgG相比,上述四种滴度的多克隆抗体和抗原结合能力要高出3~10倍。
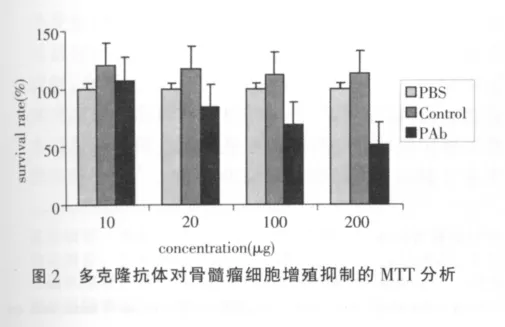
不同浓度的多克隆抗体处理骨髓瘤细胞48 h后,作MTT实验检测各组细胞增殖活性,计算各组细胞抑制率。以PBS处理为空白对照,对照抗体为阴性对照。如图2所示,我们发现多克隆抗体对骨髓瘤细胞的增殖抑制率有浓度剂量效应,随着处理浓度的增加对骨髓瘤细胞增殖的抑制率也有所增加,在200 μg/mL处理时,抑制率超过50%。
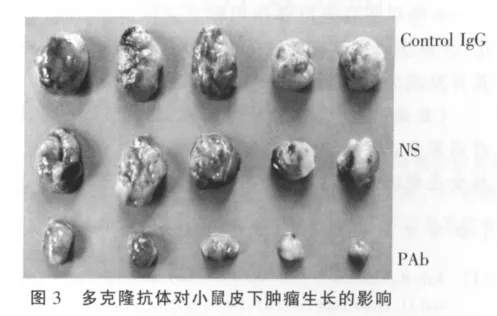
为了研究多克隆抗体体内抗肿瘤作用,通过运用多克隆抗体尾静脉注射治疗荷瘤小鼠,观察皮下肿瘤生长情况发现,如图3所示,与NS和对照抗体处理组小鼠相比,多克隆抗体明显抑制肿瘤生长。
3 讨论
在过去几十年来,由于MM异质性和MM细胞与微环境的复杂性,多发性骨髓瘤的常规化疗治疗,高剂量的放疗和/或异基因干细胞移植效果都不理想[8],基于抗体免疫治疗提供了潜在的治疗恶性肿瘤方法[9]。针对细胞表面抗原的单克隆抗体治疗是一种非常具有吸引力的手段[10]。Rituximab的临床效果令人印象深刻,因此成为第一个由FDA批准用于人类恶性肿瘤使用单克隆抗体[11]。目前其他一些有希望的单克隆抗体也被用于临床前和临床研究[12-14]。但是因为特定的MM相关抗原表达存在差异性[10]以及一些骨髓瘤细胞表达补体级联抑制蛋白从而逃避抗体介到的补体依赖细胞毒作用以及长期用药而产生的耐药性[15]等原因,致使单克隆抗体疗效有限,迫切需要寻求更为广泛表达的多发性骨髓瘤相关抗原和探索更有疗效的抗体。在本研究中,我们利用小鼠多发性骨髓瘤细胞系MPC-11活细胞免疫新西兰大白兔,纯化血清获得多克隆抗体。通过MTT法分析发现,200 μg/mL多克隆抗体在48 h抑制MPC-11细胞活性50%以上,皮下肿瘤模型研究显示多克隆抗体明显抑制小鼠皮下肿瘤的生长。综上实验结果,通过体内体外研究,多克隆抗体能够明显抑制肿瘤细胞的生长,为进一步研究多发性骨髓瘤的诊断和治疗提供了新的方法。以前的研究表明多克隆抗体rATG[16]和Thymoglobulina可以识别骨髓瘤细胞表面与凋亡途径或生长因子受体途径相关的蛋白,比如HLA-ABC、HLA-DR、CD32(FcRγ2)、CD19、CD20、CD30、CD38、CD95、CD126(IL-6R)和CD138。我们推测,抗骨髓瘤的多克隆抗体抗肿瘤活性可能也与细胞表面分子和其他目前未知分子相关,其机制需要进一步研究。因此,我们下一步将对多克隆抗体作用靶点进行追踪分离、鉴定,并系统研究其在动物体内的作用及其机制,为将其开发成为抗癌新药奠定基础。
(致谢:本论文实验研究均在四川大学生物治疗国家重点实验室完成,实验过程得到魏于全院士,杨金亮教授的悉心指导,在此表示衷心感谢。)
[1]Kyle R,Rajkumar S.ASH 50th anniversary review:multiple myeloma[J].Blood,2008,111(6):2962-2972
[2]Rescigno M,Avogadri F,Curigliano G.Challenges and prospects of immunotherapy as cancer treatment[J].BBA-Reviews on Cancer,2007,1776(1):108-123
[3]Treon S,Pilarski L,Belch A,et al.CD20-directed serotherapy in patients with multiple myeloma:biologic considerations and therapeutic applications[J].Journal of Immunotherapy,2002,25(1):72-81
[4]Kumar S,Kimlinger T,Lust J,et al.Expression of CD52 on plasma cells in plasma cell proliferative disorders[J].Blood,2003,102(3):1075-1077
[5]Chatterjee M,Chakraborty T,Tassone P.Multiple myeloma:monoclonal antibodies-based immunotherapeutic strategies and targeted radiotherapy[J].European Journal of Cancer,2006,42(11):1640-1652
[6]Mihara M,Shiina M,Nishimoto N,et al.Anti-interleukin 6 receptor antibody inhibits murine AA-amyloidosis[J].J Rheumatol,2004,31(6):1132-1138
[7]Timm M,Kimlinger T,Haug J,et al.Thymoglobulin targets multiple plasma cell antigens and has in vitro and in vivo activity in multiple myeloma[J].Leukemia,2006,20(10):1863-1869
[8]Barlogie B,Shaughnessy J,Tricot G,et al.Treatment of multiple myeloma[J].Blood,2004,103(1):20-32
[9]Newcombe C,Newcombe AR.Antibody production:Polyclonal-derived biotherapeutics[J].Journal of Chromatography B,2007,848(1):2-7
[10]Adams GP,Weiner LM.Monoclonal antibody therapy of cancer[J].Nature biotechnology,2005,23(9):1147-1157
[11]Kapoor P,Greipp PT,Morice WG,et al.Anti-CD20 monoclonal antibody therapy in multiple myeloma[J].British journal of haematology,2008,141(2):135-148
[12]Tai YT,Li X,Tong X,et al.Human anti-CD40 antagonist antibody triggers significant antitumor activity against human multiple myeloma[J].Cancer research,2005,65(13):5898-5908
[13]Lundin J,Kimby E,Bj rkholm M,et al.PhaseⅡtrial of subcutaneous anti-CD52 monoclonal antibody alemtuzumab(Campath-1H)as first-line treatment for patients with B-cell chronic lymphocytic leukemia(B-CLL)[J].Blood,2002,100(3):768-773
[14]Post J,Vooijs WC,Bast BJEG,et al.Efficacy of an anti-CD138 immunotoxin and doxorubicin on drug-resistant and drug-sensitive myeloma cells[J].International journal of cancer,1999,83(4):571-576
[15]Treon SP,Mitsiades C,Mitsiades N,et al.Tumor cell expression of CD59 is associated with resistance to CD20 serotherapy in patients with B-cell malignancies[J].Journal of Immunotherapy,2001,24(3):263-271
[16]Zand MS,Vo T,Pellegrin T,et al.Apoptosis and complement-mediated lysis of myeloma cells by polyclonal rabbit antithymocyte globulin[J].Blood,2006,107(7):2895-2903
Preparation and anti-tumor research of polyclonal antibodies of rabbit anti-mouse multiple myeloma cells
MU Bo,LIANG Su-hua△,SHEN Yue-wu,ZHANG Huan
(Department of Medical Biology,Key Laboratory of Medical Imaging of Sichuan Province,North Sichuan Medical college,Nanchong 637000,Sichuan,China)
Objective:To prepare rabbit polyclonal antibodies with mouse multiple myeloma cells and study its antitumor activity.Methods:The polyclonal antibody was generated by multi-point immunizing New Zealand white rabbits with live MPC-11 cells.The serum was pooled a week after the last injection.Immunoglobulin was isolated for using an affinity chromatography system and then freeze dried.Elisa was employed to detect and identify the specific binding of PAb and inhibited multiple myeloma cell proliferation as revealed by MTT assay.Serial intravenous injections of PAb inhibited tumor growth in mice bearing murine multiple myeloma cells.Results:Highly specific polyclonal antibodwere obtaines.ELISA detection found that antibody titers were more than 1∶20 000,The MTT study found that the cytotoxicity of PAb on MPC-11 cell lines was both dose-dependent and time-dependent.The PAb exerted a 50%inhibitory effect on MPC-11 cell viability at a concentration of 200.0 μg/mL in 48 h and the polyclonal antibody significantly inhibited the growth of subcutaneous tumors in mice by in vivo study.ConclusionHigh specific rabbit anti-mouse myeloma cell polyclonal antibody can be obtrained.The study results show that the polyclonal antibody can significantly inhibit tumor cell growth in vitro and in vivo,The data also suggests that PAb is an effective agent for multiple myeloma therapy and that exploratory clinical trials may be warranted.
Multiple myeloma;Polyclonal antibody;Immunotherapy
1005-3697(2012)04-0331-04
R-332
A
10.3969/j.issn.1005-3697.2012.04.007
国家自然科学基金项目(81101733);四川省教育厅重点项目(10ZA168)
2012-05-18
母波(1980-),男,博士,讲师,主要从事肿瘤生物治疗研究。
△通讯作者:梁素华,E-mail:liang830322@163.com网络出版时间:2012-7-80∶29
http://www.cnki.net/kcms/detail/51.1254.R.20120708.0029.201204.331_007.html
(学术编辑:胡为民)

