基于形态性状及Adh1基因序列的芒与五节芒自然杂交现象研究
朱明东,蒋建雄,肖亮,艾辛,覃静萍,陈智勇,易自力
(湖南农业大学生物科学技术学院 芒属植物研究所,湖南 长沙410128)
*芒(Miscanthussinensis)和五节芒(M.floridulus)系禾本科芒属(Miscanthus)的2个主要种[1],主要分布于东南亚地区。我国是芒和五节芒的主要分布中心,五节芒在长江中下游以南地区有着广泛分布,芒的分布范围更广,在黄河流域以南地区和东北地区都有分布。由于芒和五节芒均为多年生C4草本植物,具有生物质产量高、纤维素含量高、高热值、灰分含量低、适应性强、生长繁殖快等特点,近年来已被视为极具开发潜力的能源植物而受到高度关注。
作为新型的能源植物资源,芒和五节芒遗传背景与亲缘关系的探讨自然是重要的研究内容。笔者在进行我国芒属植物资源调查与遗传多样性分析中,按照经典的形态学分类依据[2],发现在芒和五节芒的部分重叠分布区有许多表型性状介于两者之间的中间类型存在,主要表现为其圆锥花序类似于芒,但小穗的形态则类似于五节芒,同时开花期介于2个种之间,疑似为芒与五节芒的自然杂交产物。研究自然杂交渗透主要有3个途径,表型分析[3-5],细胞生物学研究[6]和来自分子生物学[7-14]的证明。本研究即采用基于形态学标记和Adh1基因序列标记的系统发育分析来证实这种种间自然杂交现象的存在与否。如果芒和五节芒存在自然杂交这一现象得到证实,不仅可以填补这一研究领域的空白,为阐明芒属植物复杂的系统发育与进化关系提供理论基础,而且还能为芒与五节芒作为能源植物应用所需的遗传改良提供杂交育种的依据。为了阐明这一问题,笔者进行了2个方面的研究:一是建立保存活体材料的资源圃,将不同生态来源的样本种植在同样的生态环境下,进行多年份的形态学性状考察分析,以排除环境饰变的影响;二是通过Adh1(乙醇脱氢酶)基因的序列分析来鉴定是否有种间杂种的存在,因为Adh1基因具有丰富的多态性,已被广泛应用于研究植物的遗传进化和亲缘关系,是揭示近缘种群间遗传背景的有效方法。
1 材料与方法
1.1 材料与来源
本试验所用植物材料的分类名及其来源地见表1。具有中间性状的疑似杂交种采自福建南平市芒与五节芒混生的地区。在本研究中用作外参照的芒(AD512)和五节芒(AA335)来源于湖南浏阳地区2个独立的种群。取材料的根茎,种植于湖南农业大学芒属植物资源圃。该资源圃位于湖南省长沙市东郊,北纬28°11′,东经113°02′,海拨80m,土壤为红壤土,肥力中等,属亚热带季风湿润气候区。栽培方式为每4m3种植1株,按常规方法进行一致的栽培管理。

表1 供试材料Table 1 Plant materials for this study
1.2 表型性状分析
1.2.1 性状测定 连续3年(2008,2009,2010)对供试材料的以下17个性状进行了测定,17项性状包括旗叶长(flag leaf length,FLL)、旗叶宽(flag leaf width,FLW)、最大叶片长(largest leaf length,LLL)、最大叶片宽(largest leaf width,LLW)、每个分蘖叶片数(leaf number per tiller,LNT)、株高(plant height,PH)、茎长(stem height,SH)、每分蘖茎节数(internode number per tiller,INT)、花序长(panicle length,PL)、主轴长(panicle main axis length,PMAL)、主轴长/花序长(panicle main/panicle length,PMAL/PL)、芒长(awn length,AL)、基盘毛长(callus hair length,CHL)、小穗长柄长(long stalk length,LSL)、小穗短柄长(short stalk length,SSL)、种子长(grain length,GL)、种子宽(grain width,GW)。叶片、茎秆及花序性状考察时,取生长正常、无病变植株测量,取5次重复平均数;小花性状和种子性状考察时,分别取无病变小花20朵和种子20枚计平均数。
1.2.2 性状聚类 形态性状测定结果采用ZScores进行标准化转换,计算13个材料的欧氏距离,在MVSP 3.2软件上采用 Gower general similarity coefficient模型用 UPGMA 法聚类。
1.3 Adh1基因序列分析
1.3.1 DNA提取与扩增 基因组DNA采用改良的CTAB法进行提取。基因片段的扩增使用引物Adh1F-(5′-ATAGAGAGTGTTGGAGAGG-3′),Adh1R-(5′-GTTCTCCATGCGGATGATGC-3′)在 Biometro PCR仪器上进行。扩增用TaqDNA聚合酶来自东盛生物公司,扩增条件为:94℃预变性5min;94℃1min,56℃1 min,72℃1.5min,34次循环;72℃延伸7min。扩增体系为:Primer mix 4μL,DNA 2μL,Plus mix 25μL,ddH2O补齐至50μL。
1.3.2 回收体系 PCR产物用1.2%琼脂糖凝胶在TAE电泳检测并回收目标片段。产物回收使用OMEGA公司生产的PCR产物回收试剂盒(E.Z.N.A.TMGel Extraction Kit)。纯化后的产物用PGT57R/T质粒(Fer-mentas,InsTAcloneTM PCR Cloning Kit)链接,之后转化大肠杆菌Top10,在含氨苄青霉素和5-溴-4-氯-3-吲哚-β-D半乳糖苷(X-gal)的LB固体培养基上进行蓝白斑筛选阳性克隆。样品送上海生工测序,测序引物使用M13R/F通用引物。
1.3.3 序列分析 序列的对齐使用ClustalX1.81[15]程序,对齐后的序列加以人工检查。基因树的构建采用MEGA4.0[16]程序。最大简约树(maximum parsimony,MP)的构建采用启发式搜索,树2等份再连接分支交换(TBR),自展检测(bootstrap analysis)重复500次。邻接树(neighbor-joining,NJ)的构建使用 Kimura两参数模型(kimura 2-parameter),自展检验(bootstrap analysis)重复1 000次。本研究中构建分子进化树所用的Adh1基因序列,除了来源于表1中所列的芒与五节芒材料之外,还从GeneBank中选用了2个五节芒(AJ515961和AJ515962)和3个芒(AJ515964、AJ515985和AJ515973)的Adh1基因序列进行分析。同时选用了玉米(Zea mays)(ZL08591和 MX04049)、高粱(Sorghumamplum,Sorghumleiocladum)(DQ096179和DQ096187)、狼尾草(Pennisetumglaucum)(L20576和L20582)作为构建系统树的外类群。
2 结果与分析
2.1 形态学聚类分析
本研究对13份供试材料的17个表型性状进行连续3年测定,测量均值见表2。在形态性状聚类分析中,利用 MVSP 3.2软件采用Gower general similarity coefficient模型进行 UPGMA聚类分析,形态性状聚类结果见图1。形态学性状的聚类结果显示,芒和五节芒在聚类图中可以被完全区分开。而6份疑似杂交种则没有能够单独聚为一类,其中疑似杂交种AD431与五节芒类群(AA335和AD625)聚为一大类,而疑似杂交种AA343、AD628、AD607、AD633和AD606与芒类群(AD623、AD512、AD620、AD619和AD627)聚为另一大类(图1)。这表明形态性状聚类分析不能鉴定出杂交种的真实性。
2.2 Adh1基因序列特征及聚类分析
2.2.1 基因序列的特征 分别从13份供试材料扩增出的目的片段大小均为1 400bp左右,经测序后得到碱基序列,将所测序列在GeneBank中比对证实均为Adh1基因,经整理上传至GeneBank后获得序列号(表1)。

表2 17项表型性状统计结果Table 2 17morphological characters
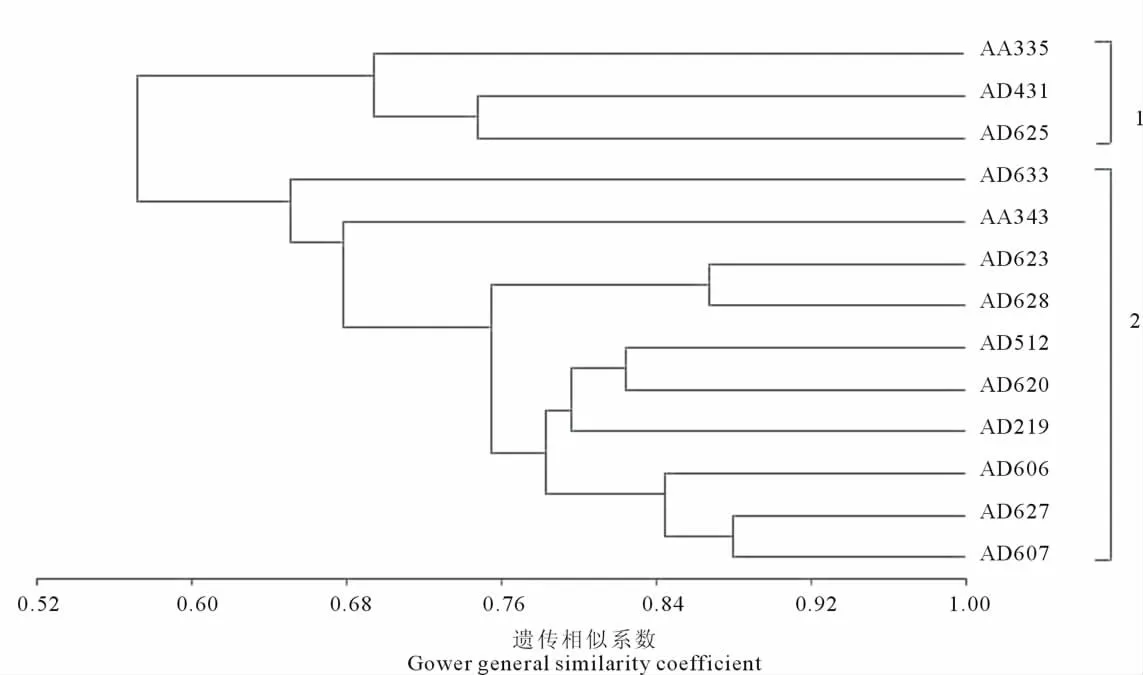
图1 基于17个表型性状标记的聚类图Fig.1 Cluster analysis based on 17morphological traits
在Softberry上运用FGENESH进行序列分析,结果表明芒属植物的Adh1基因包括6个外显子和5个内含子,外显子片段大小为60~210bp,平均大小为114bp;在13份材料用来构树的19个序列中,序列大小为1 413~1 444bp,平均大小为1 430bp,A,T,C,G碱基含量分别为24.7%,30.3%,20.5%,24.5%,序列有明显的T碱基偏好,AT碱基含量(55.0%)明显大于CG碱基含量(45%)。当用ClustalX对齐20个序列并排除空位和多重迭代后显示序列长度为1 473bp。颠换值为16,转换值为27,转换(SV)明显大于颠换(SI),转换与颠换的比为1.7。
2.2.2 聚类分析 序列采用ClustalX1.81程序排除空位并对齐,用MEGA4.0程序构建Adh1基因序列的最大简约树(MP)和邻接树(NJ),结果如图2和3所示,分支上的数值显示其自展支持率。
最大简约树和邻接树具有基本一致的拓扑结构,芒属作为单系类群能够很好地与狼尾草、玉米和高粱等外类群区分开。在芒属分支中,芒和五节芒的材料被分别聚成可明显区分的2类。而在每一个疑似杂交种中,均检测到有2种Adh1基因单倍型的存在,其中一个为芒的单倍型,在系统树中与其他芒的Adh1基因聚为一类;另一个为五节芒的单倍型,在系统树中则与其他五节芒的Adh1基因聚为一类。基于Adh1基因序列的系统发育分析表明,这些疑似杂交种确实为芒与五节芒自然杂交的产物。
3 讨论
本研究验证了疑似杂交种的真实性,证实了芒与五节芒的种间自然杂交现象的存在。这2个物种之所以能够产生自然杂交,可能的原因主要有如下几个方面:一是芒和五节芒亲缘关系很近,为近缘种,具有相近的遗传基础,二倍体的染色体数目均为2n=2x=38;二是两者的地理分布上有重叠,在野外种质资源调查中发现,在有五节芒分布的地区,几乎也都有芒的分布,在部分地区两者甚至混生在一起;三是芒和五节芒均为较严格的自交不亲和植物,有性生殖以异花授粉为主。据中国植物志记载,芒的开花期通常是8-10月,而五节芒的开花期为5-6月,两者开花期相差较大。但在研究中发现五节芒的生殖分蘖中下部的节位有时候会发生第2次抽穗开花的现象,花期刚好与芒的花期相重叠,为两者发生自然杂交提供了花期相遇的可能。为了进一步证实芒与五节芒的种间杂交现象,湖南农业大学芒属植物研究所开展了人工杂交试验,并成功获得了真实的杂交种,说明芒与五节芒之间确实具有发生种间杂交的遗传基础。芒属植物不同的种群间存在的这种自然杂交现象,会使得芒属植物种群内和种群间的遗传与进化关系变得更为复杂,这无疑给其经典分类学和系统学研究增加了难度。因此长期以来,基于形态学鉴定的有关芒属的分类及其亲缘关系研究一直都存在着争议,属下等级的划分也有不同的归并与拆分结果[1,2]。
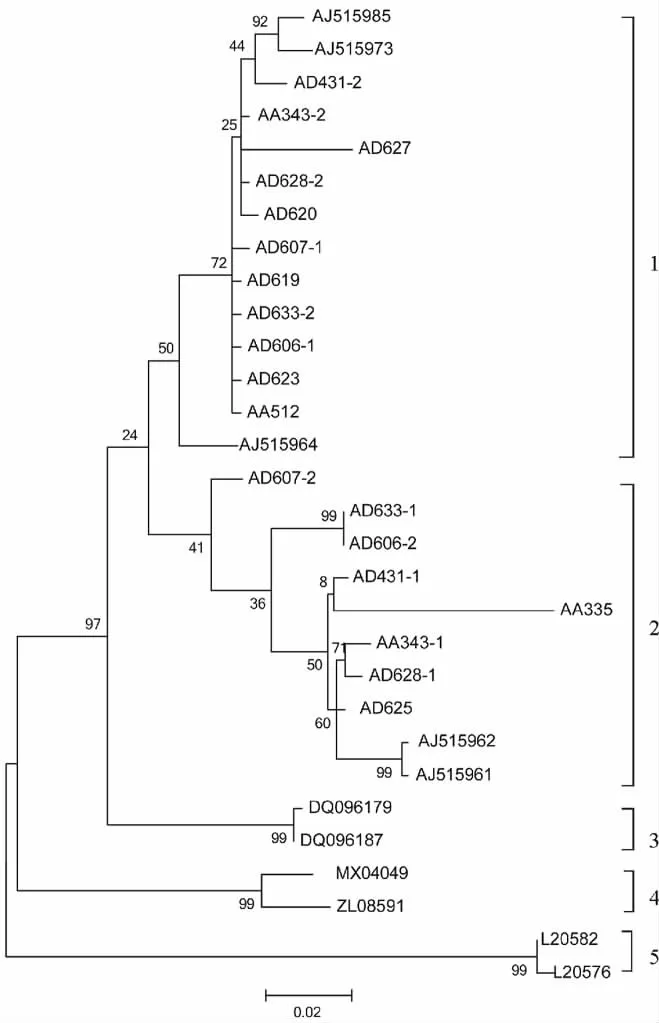
图2 基于Adh1基因序列的最大简约树Fig.2 Maximum parsimony(MP)of Adh1gene sequence

图3 基于Adh1基因序列的邻接树Fig.3 Neighbor-joining(NJ)of Adh1gene sequence
本研究发现,采用基于形态学性状的聚类分析并不能有效的将杂交种区分开来,而采用Adh1基因序列聚类分析则成功将杂交种鉴定出来。导致这2种聚类分析方法出现差异的本质原因在于:自然杂交所产生的杂交种,往往会与亲本再发生回交,出现所谓的渐渗杂交(introgressive hybridization)现象[17],从而导致1个种群的基因逐渐渗入到了另1个种群的基因库中。这种种群间的基因渗透,丰富了种群内的遗传背景,增大了种群内的遗传差异性和表型多样性,为自然选择提供了新的遗传资源,促进了物种的进化。但与此同时,种间的这种基因渗透,则降低了种群间的遗传差异性,使得种群间的遗传背景和表型性状趋于同化,从而导致这2个种群在进化上表现出趋近的亲缘关系。但渐渗杂交所带来的遗传物质的改变,在DNA分子水平上都能体现出来,通过基因序列的测定也都能够直接鉴定出来,包括内含子和外显子序列所发生的变化。从本研究的测序结果可以发现,杂交种Adh1基因的内含子和外显子碱基序列均发生了改变,外显子碱基序列的变异更为丰富;而能够反映到形态上出现差别性状,仅仅只是那些由外显子上的显性基因所控制的少数性状,大量的中性突变在形态学上是没有反映的。因此,基因序列聚类分析与形态性状聚类分析的结果出现差异是常见的,而基因序列聚类分析结果所反映出的物种变化更本质、更全面、更准确,用它所鉴定出的杂交种也更可靠。
[1]刘亮.中国植物志[M].北京:科学出版社,1997:4-55.
[2]Chen S L,Renvoize S A.Flora of China[M].Beijing:Science Press,2006:581-583.
[3]Zhang J L,Zhang C Q,Gao L M,etal.Natural hybridization origin ofRhododendronAgastum(Ericaceae)in Yunnan,China:infered from morphological and molecular evidence[J].Journal of Plant Research,2007,120:457-463.
[4]杜玉娟,王云瑾,杨洁,等.中国沙棘×肋果沙棘自然杂交带的形态学分析[J].西北师范大学学报,2008,44:73-77.
[5]钟声.野生鸭茅杂交后代农艺性状的初步研究[J].草业学报,2007,16(1):69-74.
[6]Lauren L.Cytogenetic analysis of Miscanthus‘Giganteus’,an interspecific hybrid[J].Hereditas,1993,119:297-300.
[7]郭海林,刘建秀,朱雪花,等.结缕草属植物杂交育种及其杂交种鉴定—同工酶的变异分析[J].草业学报,2006,15(6):101-108.
[8]薛丹丹,郭海林,郑轶琦,等.结缕草属植物杂交后代杂种真实性鉴定—SRAP分子标记[J].草业学报,2009,18(1):72-79.
[9]Brunner S.Evolution of DNA sequence nonhomologies among maize inbred[J].Plant Cell,2005,17(2):343-360.
[10]Hic K,San Miguel P J,Bennetzen J L.A complex history of rearrangement in an orthologous region of the maize,sorghum,and rice genomes[J].Proceedings of the National Academy of Sciences,2003,100(21):12265-12270.
[11]廖芳,刘勇,杨秀丽,等.基于Adh1基因分析高粱属的系统进化[J].遗传,2009,31(5):523-530.
[12]田欣,李德铢.DNA序列在植物系统学研究中的应用[J].云南植物研究,2002,24(2):170-184.
[13]Qiu S,Zhou R C,Li Y Q,etal.Molecular evidence for natural hybridization betweenSonneratiaalbaandS.griffithii[J].Journal of Systematics and Evolution,2008,46(3):391-395.
[14]Pan J.Molecular phylogenetic evidence for the origin of a diploid hybrid ofPaeonia[J].American Journal of Botany,2007,94(3):400-408.
[15]Thompson J D,Gibson T J,Plewnia F.The CluctalX windows interface:flexible strategies for multiple sequences alignment aidcd by quality analysis tools[J].Nucleic Acids Research,1997,25(24):4876-4882.
[16]Tamura K,Dudley J,Nei M,etal.MEGA4:Molecular evolutionary genetics analysis(MEGA)software version 4.0[J].Molecular Biology and Evolution,2007,24(8):1596-1599.
[17]Rieseberg L H,Wendel J.Introgression and is Consequences in Plants[M].New York:Oxford University Press,70-103.

