草坪禾草根腐病病原菌生物学特性研究
古丽君,徐秉良*,李彬,梁巧兰
(1.甘肃农业大学草业学院 草业生态系统教育部重点实验室 甘肃省草业工程实验室 中-美草地畜牧业可持续发展研究中心,甘肃 兰州730070;2.甘肃农业大学农学院,甘肃 兰州730070)
*随着我国草坪业的发展,绿地面积的扩大及草坪集约化管理程度的提高,病害逐渐成为影响草坪质量、降低草坪利用年限的主要限制因素之一,致使草坪提早衰败、难以利用,甚至废弃。草坪禾草根腐病(Pythiumdiseases)是一种破坏力极强的病害,草坪禾草根腐病引起根、茎和心叶腐烂,发病条件适宜时,能在一夜之间毁坏大面积草坪,对景观效果破坏极为严重。它既能在冷湿生境中侵染危害,也能在天气炎热时猖獗流行,从坪草中分离出多种腐霉菌[1],其中引起草坪禾草根腐病之一的瓜果腐霉(Pythiumaphanidermatum)具有很强的致病力和广泛的寄主范围。
国内外有关草坪禾草根腐病病原的鉴定以及病害药剂防治等方面已有报道。Abad等[2]报道大约有33种腐霉菌可以侵染多年生黑麦草(Loliumperenne)和匍匐剪股颖(Agrostisstolonifera),其中瓜果腐霉、终极腐霉(Pythiumultimum)在30~35℃时有很强的致病性。石洁等[3]对保定市冷季型草坪草根腐病发生情况进行调查,结果表明,保定市草坪根腐病的主要病原菌为镰刀菌(Fusarium)、腐霉菌(Fythium)及离孺孢菌(Bipolaris sorokiniana),其中腐霉菌的分离频率为19.2%;张玉琴等[1]认为腐霉菌的寄主范围非常广泛,所有的冷季型草坪草和暖季型草坪草狗牙根(Cynodondactylon)容易被瓜果腐霉侵染;穆合塔尔等[4]研究发现,草地早熟禾(Poa pretensis)、紫羊茅(Festucarubra)、高羊茅(Festucaarundinacea)和多年生黑麦草对腐霉枯萎病感性有差异,它们分别代表极感、高感、中感和低感类型,并根据试验结果模拟出在草坪上防治腐霉枯萎病的农药及适宜用药量。李崴等[5]研究认为,天津地区腐霉枯萎病的致病菌主要为瓜果腐霉菌。腐霉属种间的差异性导致草坪草不同器官受侵染的程度不同,所采取的防治措施也不尽相同。张金林等[6,7]从多年生黑麦草上分离得到的瓜果腐霉毒素对多年生黑麦草具有很强的破坏作用。杨亚君等[8]就瓜果腐霉毒素对多年生黑麦草的抗病性进行了研究,发现多年生黑麦草对毒素敏感。徐娇等[9]通过对光合系统Ⅱ、丙二醛、超氧自由基、希尔反应活力、根系活力以及叶片含水量等指标的测定,明确了瓜果腐霉毒素对多年生黑麦草的致病机理。古丽君等[10]研究发现,深绿木霉(Trichodermaaureoviride)对引起禾草腐霉病原菌瓜果腐霉有明显的抑制作用,主要作用机制为重寄生作用。
目前,有关草坪禾草根腐病病原生物学特性方面的系统资料相对较少[11]。余永年和马国忠[12]报道了温度对中国腐霉属菌丝生长的影响,并讨论它在分类学和亲缘关系上的意义。徐娇等[13]只研究了瓜果腐霉PA1菌株在不同温度下的生长速率。孙淑琴等[14]通过连续3年对天津地区草坪腐霉枯萎病病害发生调查,总结出病害发生规律:高温高湿的气候条件是腐霉枯萎病发生的主要因素,通过病原菌致病性测定,筛选强致病性菌株,鉴定其为瓜果腐霉,并进行了温度、pH值、碳氮源对菌落生长速率影响的研究。研究该病原菌的生物学特性对了解其所致病害的发生规律和制定有效的防治措施具有重要的意义。因此本试验对瓜果腐霉菌的生物学特性进行了深入详细的研究。
1 材料与方法
1.1 材料来源
从兰州市发病严重的混播草坪禾草中采集新鲜的草坪禾草根腐病病株,进行组织分离培养,经病原菌形态、培养性状和致病性等方面的研究,确定主要致病菌为腐霉属的瓜果腐霉[15]。2009年9月在甘肃农业大学草业学院植物病原学实验室对已鉴定的病原菌进行生物学特性试验。
1.2 生物学特性试验
1.2.1 温度对菌丝生长及孢子囊、卵孢子产量的影响 取培养4d的菌落,用无菌打孔器(d=0.5cm)沿菌落边缘打取菌块移入PDA平板中央,每皿1块,分别置于5,10,15,20,25,30,35,40,45℃条件下无光照保湿培养12 h,十字交叉法测量菌落直径,计算菌落平均生长速度[16]。每个处理5次重复。20d后挑取老熟菌丝涂片,并于10×镜下随机记数一个视野内的孢子囊、卵孢子产量,每个重复随机记数5个视野。
1.2.2 光照对菌丝生长及孢子囊、卵孢子产量的影响 将已接种的PDA培养皿分为5组,作如下处理:1)25℃持续光照培养24h(光照培养箱);2)25℃持续黑暗培养24h;3)25℃黑暗12h与光照12h交替培养24h;4)紫外线照射2h后于25℃连续黑暗培养24h;5)紫外线照射2h后于25℃持续光照培养24h,测量菌落直径,计算菌落平均生长速度。20d后测孢子囊、卵孢子产量。每处理重复5次。
1.2.3 pH值对菌丝生长及孢子囊、卵孢子产量的影响 用0.1mo1/L的NaOH或HCl将灭过菌的PDA培养基调节pH 为4.0,5.0,6.0,7.0,8.0,9.0,10.0七个梯度,将菌块接在不同pH 的PDA平板中央,25℃下培养24 h,测量菌落直径,计算菌落平均生长速度。20d后测孢子囊、卵孢子产量。每个处理5次重复。
1.2.4 碳源对菌丝生长及孢子囊、卵孢子产量的影响 试验所用的基本培养基每升蒸馏水中含1g KH2PO4、0.5g MgSO4·7H2O、0.01g FeSO4·7H2O、30g蔗糖、0.5g KCl、2g NaNO3,制平板时每升培养液中加入17 g琼脂。分别以相同质量的葡萄糖、麦芽糖、淀粉、D-木糖和山梨醇代替基本培养基中的蔗糖,配成不同碳源的培养基,并以不加碳素的培养基为对照。沿菌落边缘取直径为0.5cm菌块接入平板中央,25℃恒温培养箱中培养,12h后观察菌体形态情况,并测量菌落直径。20d后测孢子囊、卵孢子产量。每个处理重复5次。
1.2.5 氮源对菌丝生长及孢子囊、卵孢子产量的影响 分别以相同质量的硝酸钾、硝酸铵、氯化铵、脲替代上述基本培养基中的NaNO3,配成不同氮源的培养基,并以不加氮素、补加2g 0.1mol/L NaCl的培养基为对照。将菌块接在不同氮源的平板中央,25℃恒温培养箱中培养24h,测量菌落直径,计算菌落平均生长速度。20d后测孢子囊、卵孢子产量。每个处理5次重复。
1.2.6 不同的培养基对菌丝生长及孢子囊、卵孢子产量的影响 供试培养基为PDA(马铃薯葡萄糖琼胶培养基)、CMA(玉米粉琼胶培养基)、CAA(胡萝卜琼胶培养基)、OA(燕麦片琼胶培养基)、TCA(番茄琼胶培养基)。接菌后置于25℃培养箱培养,24h后测量菌落直径。20d后测孢子囊、卵孢子产量。每个处理重复5次。
PDA[17]:马铃薯200g,葡萄糖10~20g,琼胶17~20g,水1 000mL,将洗净后去皮的马铃薯切碎,加水1 000mL煮沸30min,用纱布滤去马铃薯,加水补足1 000mL。然后加糖和琼胶,加热使琼胶完全溶化后,分装灭菌(121℃,20min)。
CMA[18]:玉米粉300g,琼胶17g,水1 000mL,玉米粉加水1 000mL,在沸水浴上加热1h,纱布过滤后加水补足1 000mL,加琼胶溶化后分装灭菌(121℃,20min)。
CAA[19]:新鲜胡萝卜200g,琼胶20g,水1 000mL,将新鲜胡萝卜切成小片,加去离子水500mL,用组织捣碎机捣碎约40s,双层纱布过滤去渣,加水补足1 000mL,加入琼胶溶化后分装灭菌(121℃,20min)。
OA[19]:燕麦片30g,琼胶17~20g,水1 000mL,配制的方法与玉米粉琼胶培养基相同。
TCA[19]:番茄汁300g,琼胶20g,CaCO30.4g,水80mL,番茄果实用水洗净切片,榨汁2min,双层纱布过滤,滤液即为所制备的番茄汁,加入琼胶溶化后分装灭菌(121℃,20min)。20d后测产孢量。
2 结果与分析
2.1 温度对病原菌菌丝生长及孢子囊、卵孢子产量的影响
瓜果腐霉菌对温度的适应范围较宽,菌丝在15~40℃内均可生长,不同温度条件下,菌落扩展速度不同,最适宜温度为30~35℃,低于10℃或高于45℃时菌落停止生长(图1)。温度在15~40℃均可产生孢子囊,但是在30~35℃时孢子囊产量相对较低,即在菌落生长最适温度下孢子囊的产量最低,在菌落生长不利的温度下孢子囊的产量较高;卵孢子在20~25℃时的产量最大,低于10℃或高于30℃时不产生卵孢子,卵孢子的产生条件较为严格。
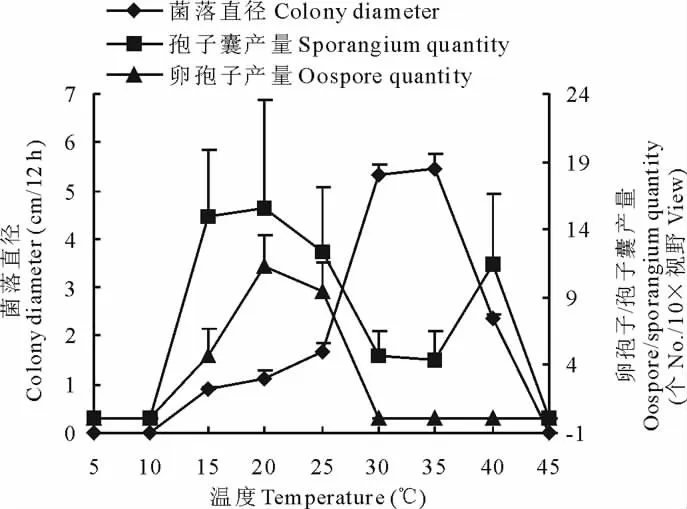
图1 温度对菌丝生长及孢子囊、卵孢子产量的影响Fig.1 Effect of temperature on the hyphae growth,sporangium and oospore quantity
2.2 光照对病原菌菌丝生长及孢子囊、卵孢子产量的影响
处理2、处理5为全黑暗条件培养,菌落生长速度分别为6.46和6.58cm/d(图2),黑暗条件有利于菌落的扩展,紫外光处理2h后的菌落生长速度最快,说明紫外光照射可以促进菌丝的生长,全光照条件下培养的菌落生长速度最慢;光照对孢子囊、卵孢子的产量影响很大,紫外灯处理2h后全光照条件培养的孢子囊产量远远大于其他培养条件,紫外光处理可以大大提高孢子囊的产量;黑暗条件有利于卵孢子的产生,全黑暗条件下卵孢子的产量达到12个/10倍视野,紫外光照射会抑制卵孢子的产生。
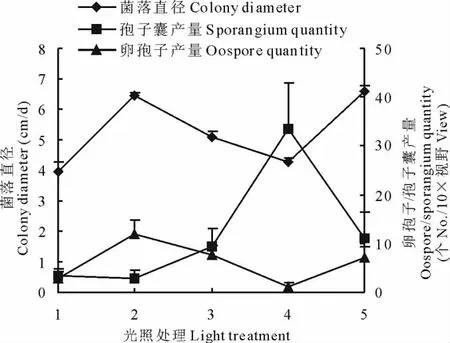
图2 光照对菌丝生长及孢子囊、卵孢子产量的影响Fig.2 Effect of light on the hyphae growth,sporangium and oospore quantity
2.3 pH值对病原菌菌丝生长及孢子囊、卵孢子产量的影响
瓜果腐霉菌对酸碱度适应范围很广,在pH值4~10内均可生长,最适于菌落扩展的pH值为7~8,其长势繁茂,日生长量可达到4.30~4.45cm。碱性条件有利于孢子囊的产生,pH为9时孢子囊产量达到峰值;酸性条件有利于卵孢子的产生,pH为6时卵孢子的产量显著高于其他pH值时,碱性条件卵孢子产量较低,当pH为10时,不产生卵孢子(图3)。
2.4 碳、氮源对病原菌菌丝生长及孢子囊、卵孢子产量的影响
瓜果腐霉能利用多种碳源和氮源,在多种碳源中以蔗糖生长速度最快,山梨醇次之,D-木糖生长最差。方差分析结果显示,瓜果腐霉菌在蔗糖培养基、山梨醇培养基上的生长速度均显著高于其他培养基,以蔗糖培养基为最好。以淀粉为碳源则菌丝厚度、孢子囊及卵孢子的产量都最大,试验结果经SSPS方差分析表明,以淀粉、蔗糖、葡萄糖为碳源时,瓜果腐霉菌孢子囊产量极显著高于其他培养基(P<0.01),以淀粉为碳源时,瓜果腐霉菌卵孢子产量极显著高于其他培养基(P<0.01)。
瓜果腐霉菌丝对供试的氮源均可利用,方差分析结果显示,供试菌株在以NH4NO3作为氮源的培养基上生长速度和孢子囊产量均显著高于其他培养基(P<0.05),同时菌落厚度也最大,无氮源情况下菌丝厚度很小。以脲为氮源则有利于促进卵孢子的产生(表1)。
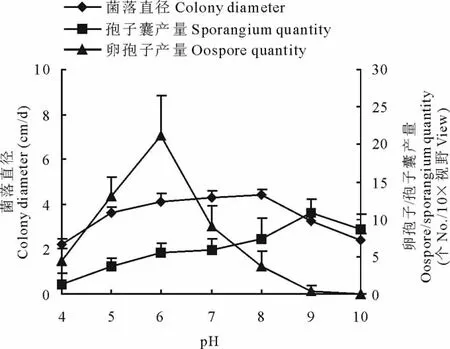
图3 pH对菌丝生长及孢子囊、卵孢子产量的影响Fig.3 Effect of pH on the hyphae growth,sporangium and oospore quantity
2.5 不同的培养基对病原菌菌丝生长及孢子囊、卵孢子产量的影响
瓜果腐霉在CAA培养基上生长速度最快,与其他培养基差异极显著(P<0.01);但是在PDA培养基和TCA培养基上菌落厚度最大;在CMA培养基上孢子囊产量最大,与其他培养基差异极显著(P<0.01);在OA培养基上卵孢子产量最大(表1)。
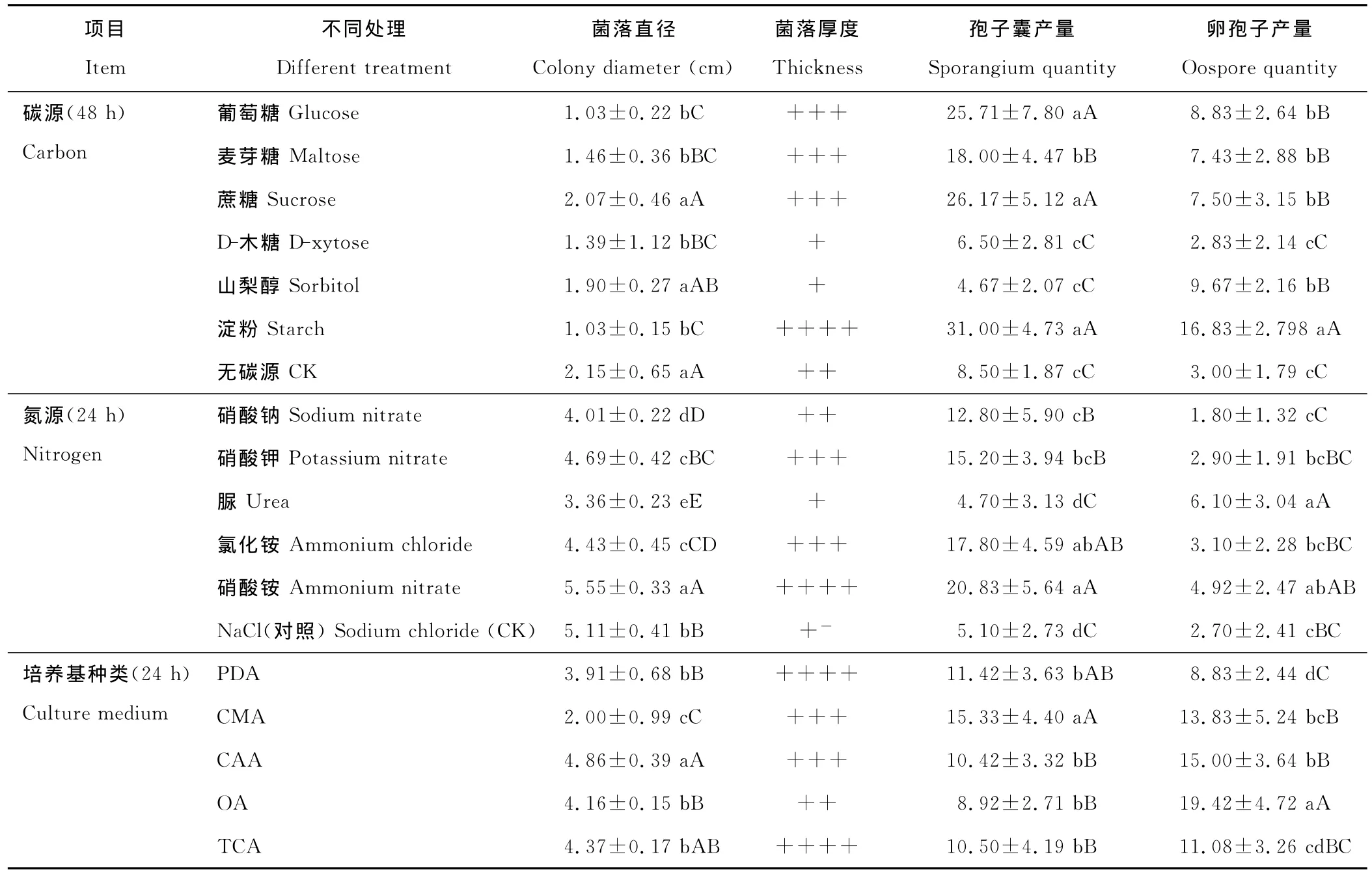
表1 不同碳、氮源及培养基种类对瓜果腐霉菌丝生长及孢子囊、卵孢子产量的影响(25℃)Table 1 Effect of different carbon,nitrogen and various medium on hyphae growth,sporangium and oospore quantity
3 结论与讨论
张金林等[20]报道我国坪草病害的种类约30多种,其中由瓜果腐霉菌引起的腐霉枯萎病在北方发生普遍,对多种草坪草造成严重的危害。草坪腐霉枯萎病是一种毁灭性病害,病害的发生与多种因素有关[21]。而目前有关瓜果腐霉菌生物学特性方面的系统资料相对较少,因此,进行病原菌的生物学特性试验有重要的意义。本试验对病原菌生物学特性的研究结果表明,瓜果腐霉菌在15~40℃均能生长,菌丝生长适宜温度为30~35℃,这与徐娇等[13]报道的瓜果腐霉PA1菌株生长的最适温度相似。这些都与该病在每年6-9月高温季节迅速发生流行[22]相一致。因此,在高温气候来临之前,一定要作好病害的预防工作。15~20℃时病原菌可以产生的孢子囊最多,同时在40℃时也可以产生较多的孢子囊;20~25℃卵孢子的产量最大。因此,瓜果腐霉通过孢子囊越夏、卵孢子越冬。
通过光照试验可以得出,黑暗条件有利于病害的蔓延,光照条件病害发生较慢,这也就印证了瓜果腐霉菌在适宜的温湿度条件下能够在一夜之间破坏大面积草坪的观点。卵孢子的产生会受到光照的抑制,但是光照可以大大提高孢子囊产量。瓜果腐霉菌菌丝生长适宜pH值为8,碱性条件(pH=9)有利于孢子囊的产生,酸性条件(pH=6)有利于卵孢子的产生,因此,偏碱性土壤上的草坪发病重于酸性土壤,改善土壤酸碱度可以有效预防病害的发生。许多种糖类均可成为该病菌利用的碳源,其中对病原菌菌丝生长有明显促进作用的碳源是蔗糖,对病原菌菌丝厚度、孢子囊及卵孢子产量有显著促进作用的碳源是淀粉;在氮源方面,NH4NO3对菌丝生长、孢子囊及卵孢子产量都有明显的促进作用,同时菌丝生长旺盛。这与真菌数量和氮素正相关[23]理论上相一致。施用过多氮肥既会造成草坪草徒长,又会加剧根腐病的发生,因此,少施氮肥对控制该病害的发生有显著作用。
草坪禾草根腐病病害的发生除了与温度、光照、pH等主要因素相关外,还与水肥管理、修剪、种植草坪品种等因素密切相关。在生产上应采取综合的管理和防治措施,病害发生前后,积极做好预防和防治工作等,将病害发生程度降低到最低水平。具体措施是:合理修剪,使草坪通风透光,搞好草地卫生以减少初侵染源。比较有效的草坪卫生措施是在秋末和冬季或初春对草坪进行焚烧,这样可以减少下一生长季节的初侵染源。此外,修剪时割下的草叶要及时清理出草坪,携带有病虫害的要及时焚烧或掩埋。培养健壮草坪,均衡适量的增施磷、钾肥可以提高抗病性。在草坪建植中应选用不同的抗病种或品种混播,以降低草坪病害的发生。根腐病危害严重的草坪,要及时进行化学防治。
[1]张玉琴,王代军,刘荣堂,等.草坪草腐霉枯萎病的研究现状及进展[J].草原与草坪,2002,(2):3-7.
[2]Abad Z G,Shew H D,Lucas L T.Characterization and pathogenicity ofPythiumspecies isolated from trufgrass with symptoms of root and crown rot in North Carolina[J].Phytopathology,1994,84:913-921.
[3]石洁,李建成,刘玉瑛.草坪草根腐病病原菌研究初报[J].华北农学报,2000,15(增刊):94-98.
[4]穆合塔尔,王瑞,刘荣堂.多菌灵防治草坪草腐霉枯萎病的研究[J].草原与草坪,2000,(2):22-25.
[5]李崴,李秀文,栗振华,等.天津草坪病害诊断技术研究初报[J].天津农林科技,2003,(4):12-14.
[6]张金林.坪草腐霉病菌除草活性毒素组分的分离鉴定与突变菌株的DDRT差异显示分析[D].保定:河北农业大学,2005.
[7]张金林,庞民好,刘颖超,等.坪草腐霉病菌毒素产生除草活性物质的条件优化[J].河北农业大学学报,2005,28(4):84-88.
[8]杨亚君,陶晡,李川,等.腐霉枯萎病菌毒素在坪草抗病性筛选中的应用研究[J].草业学报,2008,17(3):93-98.
[9]徐娇,许文超,康占海,等.瓜果腐霉毒素对多年生黑麦草的致病作用机理初步研究[J].草业学报,2009,18(4):181-186.
[10]古丽君,徐秉良,梁巧兰,等.生防木霉菌T2菌株对禾草腐霉病抑菌作用及机制研究[J].草业学报,2011,20(2):46-51.
[11]徐娇,陈红岩,石文伟,等.坪草腐霉枯萎病菌的生物学特性及诱变菌株毒素的除草活性研究[J].河北农业大学学报,2008,31(4):81-86.
[12]余永年,马国忠.腐霉的生长温度与分类[J].云南农业大学学报,1990,5(2):65-71.
[13]徐娇,陈红岩,石文伟,等.坪草腐霉枯萎病菌(Pythiumaphanidermatum)的生物学特性及诱变菌株毒素的除草活性研究[J].云南农业大学学报,2008,31(4):81-86.
[14]孙淑琴,刘水芳,杨秀荣.天津地区草坪腐霉枯萎病病原鉴定及生物学特性研究[J].草原与草坪,2009,(3):31-38.
[15]古丽君,徐秉良,梁巧兰,等.兰州市草坪禾草根腐病的发生及病原菌鉴定[J].草业学报,2009,18(4):175-180.
[16]徐秉良,郁继华.非洲菊枯萎病菌的生物学特性[J].甘肃农业大学学报,2002,37(1):35-39.
[17]方中达.植病研究方法[M].北京:中国农业出版社,1998.
[18]张俊忠,陈秀蓉,杨成德,等.东祁连山高寒草地土壤可培养真菌多样性分析[J].草业学报,2010,19(2):124-132.
[19]郑小波.疫霉菌及其研究技术[M].北京:中国农业出版社,1997.
[20]张金林,庞民好,刘颖超,等.不同杀菌剂对草坪草病原菌毒力的作用测定[J].草业学报,2006,15(1):58-61.
[21]王国良.影响冷季型草坪腐霉病发生因子的研究[J].浙江农业学报,2000,12(3):136-139.
[22]谭鹏,张学忠.草坪主要病害的发生与防治[J].陕西林业科技,2005,(2):41-44.
[23]顾爱星,范燕敏,武红旗,等.天山北坡退化草地土壤环境与微生物数量的关系[J].草业学报,2010,19(2):116-123.

