高强度运动对氧化-抗氧化内稳态的提升
刘刚,潘华山,彭贻海,冯毅翀,刘承宜37
(1.广州中医药大学 体育健康学院,广东 广州 510006;2.华南理工大学 体育学院,广东 广州 510641;3.华南师范大学 激光运动医学实验室,广东 广州 510006)
高强度运动对氧化-抗氧化内稳态的提升
刘刚1,潘华山1,彭贻海2,冯毅翀1,刘承宜327
(1.广州中医药大学 体育健康学院,广东 广州 510006;2.华南理工大学 体育学院,广东 广州 510641;3.华南师范大学 激光运动医学实验室,广东 广州 510006)
为了探讨高强度训练对SD大鼠OAH品质的提高,将30只SD大鼠随机分为训练干预组与安静对照组。训练干预组以坡度10%、28 m/min、每次60 min、每天1次、每周5 d条件下于跑台上运动8周;安静对照组不施加运动干预措施。在最后一次训练结束72 h即刻进行腓肠肌与血清的取材。检测指标为骨骼肌与血清的丙二醛(malondialdehyde,MDA)、总超氧化物歧化酶(total super oxide dismutase,TSOD)、过氧化氢酶(catalase,CAT)和还原型谷胱甘肽(reduced glutathione,RGSH)。结果发现:骨骼肌与血清中的RGSH含量和TSOD活性显著性增高;MDA在血清中显著性降低,但在骨骼肌中显著性升高;CAT活性在血清中显著性增高,但在骨骼肌中不变。实验表明:高强度训练能够实现SD大鼠OAH升级。
运动生物化学;氧化还原;内稳态;高强度运动;大鼠
内稳态是生理学[1]和功能医学[2]的经典概念之一,但表征方法的缺乏妨碍了广泛深入的应用。刘承宜等人[3-8]将稳定内环境的内稳态发展为稳定功能的功能内稳态(function-specific homeostasis,FSH)。FSH是维持功能充分稳定发挥的负反馈机制。FSH可以抵抗低于阈值的干扰,但超过阈值的应激(FSH-specific stress,FSS)则会打破 FSH[9]。氧化还原是生物系统的一种功能,其充分稳定的发挥由氧化-抗氧化内稳态(oxidant-antioxidant homeostasis,OAH)来维持[10]。运动会引起活性氧(reactive oxygen species,ROS)水平的增加[10],运动强度越大,所产生的ROS水平越高。运动强度可以根据Bedford[11]的最大摄氧量模型确定。运动强度超过 90%最大摄氧量为高强度运动,运动强度相当于60%~70%最大摄氧量为中等强度运动。中等强度运动引起的ROS水平增加低于OAH的干扰阈值,只能暂时干扰OAH,但随后会重新恢复。前文发现,中等强度运动后即刻 ROS水平和抗氧化酶活性都有显著提高,但72 h后就恢复到安静组的水平[12]。本工作研究高强度运动对OAH的影响。
1 研究对象与方法
1.1 研究对象与分组
5月龄无特定病原体(specific pathogen free,SPF)级雄性 Sprague-dawley(SD)大鼠 30 只(实验动物使用许可证号:SYXK(粤)2008-0085,广州中医药大学实验动物中心,体重180~220 g)。随机分为安静对照组与运动干预组,每组15只,常规分笼喂养,自由饮水进食,动物室内温度21~24 ℃,相对湿度40%~55%,室内空气流通,光照时间l2 h。所有动物实验前均未进行过跑台跑运动。动物的处置符合山内钟平[13]所著《实验动物的环境与管理》要求。广州中医药大学动物实验中心相关教师认为该实验方案符合动物伦理学[14]要求。
1.2 运动干预方式
安静对照组: 正常生活状态,不进行运动训练;运动干预组大鼠运动条件为坡度10%、速度28 m/min,每次60 min,每天1次,每周训练5 d,共进行8周训练。在运动干预的第1、2和9天对运动干预组3、7、11和12号大鼠使用过声音和毛刷刺激方法刺激大鼠跑动。造模运动过程中7和9号大鼠死亡。
1.3 动物取材和标本制备
实验动物8周训练结束后72 h安静状态下处死。于大鼠左后肢相同部位腓肠肌取2块骨骼肌,约6 g
实验数据均采用SPSS16.0 统计软件进行处理,所有数据均以均数±标准差(±s)表示,采用单因素方差分析进行各组间的差异显著性检验,显著性水平为P<0.05。左右,用4 ℃生理盐水清洗,滤纸吸干,立即放入清洁干燥密闭小瓶中,-20 ℃保存备用。
实验动物8周训练结束后,安静对照组、运动干预组在最后1次训练结束72 h后安静状态下处死摘眼球采血后于室温下凝固,凝固后用竹签沿试管四周壁轻轻剥离血块,使血清尽快析出,然后于低温冷冻离心机3 000 r/min离心15 min,倾出血清低温保存备用。
1.4 实验仪器与试剂
ZH-PT动物实验跑台(淮北正华生物仪器设备有限公司)、JJ-1型组织研磨机(深圳天南海北公司)、TDL-5-A 型低速离心机、722分光光度计(上海精密科学仪器公司);丙二醛(malondialdehyde,MDA)试剂盒、总超氧化物歧化酶(total superoxide dismutase,TSOD)试剂盒、还原型谷胱甘肽(reduced glutathione,RGSH)试剂盒和过氧化氢酶(catalase,CAT),试剂盒均为南京建成生物工程研究所提供。RGSH测定以二硫代二硝基苯甲酸与巯基化合物反应,能产生黄色化合物而比色定量。
1.5 活性氧和抗氧化酶活性测定
MDA、TSOD、RGSH和 CAT各项指标均严格按试剂盒使用说明书进行操作。
1.6 统计学分析
2 结果及分析
表1和表2总结了本研究的实验结果。由表1可知,与安静对照组比较,运动干预组骨骼肌TSOD活性、RGSH质量分数均有升高(均P<0.05),差异具有统计学意义;运动干预组较安静对照组CAT活性略有升高,但差异无显著性。MDA质量摩尔浓度运动干预组低于安静对照组,差异具有显著性 (P<0.05)。
表1 72 h后安静状态下各组大鼠骨骼肌氧化还原子系统变化(±s)
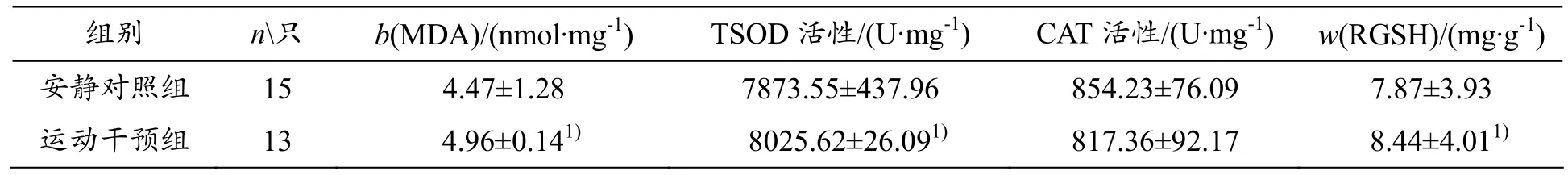
表1 72 h后安静状态下各组大鼠骨骼肌氧化还原子系统变化(±s)
1)与安静对照组比较,P<0.05
组别 n只 b(MDA)/(nmol·mg-1) TSOD 活性/(U·mg-1) CAT 活性/(U·mg-1) w(RGSH)/(mg·g-1)安静对照组 15 4.47±1.28 7873.55±437.96 854.23±76.09 7.87±3.93运动干预组 13 4.96±0.141) 8025.62±26.091) 817.36±92.17 8.44±4.011)
由表2可知,与安静对照组比较,运动干预组血清TSOD活性升高,差异具有显著性;RGSH质量分数显著性升高(P<0.05);运动干预组较安静对照组CAT活性升高,差异具有显著性。MDA质量摩尔浓度运动干预组低于安静对照组,差异具有显著性(P<0.05)。
表2 72 h后安静状态下各组大鼠血清氧化还原子系统变化(±s)

表2 72 h后安静状态下各组大鼠血清氧化还原子系统变化(±s)
1)与安静对照组比较,P<0.05
组别 n只 b(MDA)/(nmol·mg-1) TSOD 活性/(U·mg-1) CAT活性/(U·mg-1) w(RGSH)/(mg·g-1)安静对照组 15 6.58±0.32 5 548.75±884.69 1 079.11±32.24 23.66±1.78运动干预组 13 5.66±0.141) 5 725.62±726.091) 1 167.06±58.171) 31.58±0.181)
3 讨论
3.1 内稳态训练理论
运动员的主要 FSH为项目内稳态(sport-specific homeostasis,SpSH)。按照刘承宜等人[6-9,15-16]提出的内稳态训练理论,大鼠的训练分为3个阶段,第1个阶段是超常训练(extraordinary training,ET),打破 SpSH1,建立了SpSH2的必需子系统(SpSH2-essential subsystem,SES)的内稳态(SES-specific homeostasis,SESH);第2阶段是常规训练(ordinary training,OT)前期(OTA),维持 SESH,建立 SpSH2的非必需子系统(SpSH2-non-essential subsystem,SNS)的内稳态(SNS-specific homeostasis,SNSH)并进一步整合建立SpSH2;第3阶段是OT后期(OTB),维持SpSH2。SES包括项目必需的骨骼肌、神经元系统和氧化还原系统。SNS包括项目非必需的骨骼肌,神经元系统,氧化还原系统,植物神经,免疫、心理和精神系统等。本研究的腓肠肌OAH属于SESH,血清OAH属于SNSH。
血清氧化还原标志物的研究较多,骨骼肌氧化还原标志物研究较少,两者同时研究的就更少了。本工作同时研究了血清和骨骼肌的氧化还原标志物,结果发现,血清和骨骼肌大部分氧化还原标志物的变化一样,但MDA和CAT有区别。骨骼肌中CAT活性没有变化,血清CAT活性增加。骨骼肌中MDA上升,但血清MDA下降。前人也有运动不能引起骨骼肌CAT活性变化的报道。Higuchi等人[17]的人体实验研究了运动对骨骼肌的影响。他们发现,将线粒体酶活性增加2~3倍的运动可以增加线粒体超氧化物歧化酶(superoxide dismutase,SOD)活性,但不能改变CAT的活性。
3.2 内稳态品质
FSH的品质包括功能的复杂性和功能发挥的稳定性。负反馈机制所维持的稳定性越大,生物系统越复杂[18]。SpSH 可以用代谢组学[19]和功能核磁共振成像[20]来评价,OAH的品质由ROS的水平和抗氧化酶的活性来表征。本研究发现,8周高强度运动后72 h安静状态下,血清OAH高于对照组,MDA水平低于对照组,RGSH水平、CAT和TSOD活性则高于对照组;腓肠肌OAH基本上也高于对照组,虽然MDA水平高于对照组其CAT活性与对照组一样,但RGSH水平和TSOD活性高于对照组。
无论是运动员,还是动物实验,血液 OAH的研究较多。Dékány等人[21]将手球、水球和曲棍球的运动员分别与不运动的对照组进行了比较研究,发现运动员的血液 OAH的品质高于对照组,而且不同运动项目的运动员也各不相同。他们发现,运动员的SOD、谷胱甘肽过氧化酶(glutathione peroxidase,GPX)和CAT活性高于对照组,而且SOD活性与GPX活性呈正相关。Teixeira等人[22]对优秀运动员的研究发现,虽然SOD活性高于对照组,但总的抗氧化能力低于对照组。他们的进一步研究发现,血清的肌酸激酶高于对照组。
对骨骼肌OAH的研究较少。Higuchi等人[17]对人体运动适应的研究发现,可以将骨骼肌线粒体酶活性增加2~3倍的运动可以增加骨骼肌线粒体SOD活性,但不能改变CAT的活性。Sen等人[23]发现,猎兔犬55周和Wistar大鼠8周的耐力运动可以增加骨骼肌GPX活性。
本研究同时测定了血清和骨骼肌的MDA与RGSH水平和TSOD与CAT活性,发现高强度运动对这两种OAH的提升是有区别的。
3.3 运动应激
FSH可以抵抗低于阈值的干扰,但超过阈值的应激(FSH-specific stress,FSS)则会打破 FSH[9]。FSS 也是生物系统的一种功能,存在相应的内稳态(FSS-specific homeostasis,FSSH)。远离FSSH的FSS称为不成功应激,只能破坏FSH。处于FSSH的FSS称为成功应激,在打破FSH1之后能够建立FSH2。本研究发现,8周高强度运动将低品质的OAH1提升为高品质的OAH2。显然,8周高强度运动是一种成功的运动应激。
不成功应激会影响OAH。优秀运动员的血清SOD活性虽然高于对照组,但血清总的抗氧化能力低于对照组,其原因在于血清的肌酸激酶高于对照组[22]。这说明损伤会影响OAH。急性运动或递增负荷没有足够的时间产生运动适应,其运动损伤也会影响OAH。李晖等[24]发现,递增负荷运动只能干扰肾脏 OAH,SOD和MDA分别在运动后4和8 h就恢复到对照组的水平。Jimenez等人[25]研究了递增负荷对心脏移植患者(heart transplant recipient,HRT)和耐力训练健康对照组(endurance-trained healthy,age-matched control subject,HC)的影响。他们发现,HRT的红细胞GPX活性低于HC,但红细胞SOD高于HC。他们进一步发现递增负荷不影响血浆MDA和GPX。Elokda等人[26]发现递增负荷后60 min GSH就可以恢复。
此外,现有国内的一些递增负荷研究因为没有设计安静对照组无法得到比较肯定的结论。本研究的另一个实验特色是设计了安静对照组,首次发现 SD大鼠高强度运动可以提升OAH的品质。
[1] Cannon W B .The wisdom of the body[M]. New York:WW Norton & Company,1932.
[2] Jones D S. Textbook of functional medicine[M]. Gig Harbor,Wash:The Institute for Functional Medicine,2006.
[3] Liu T C Y,Yuan J Q,Wang Y F,et al. Cellular rehabilitation of photobiomodulation[J]. Progress in Biomedical Optics and Imaging,2007,8(36):1-6.
[4] Liu T C Y,Liu R,Zhu L,et al. Homeostatic photobiomodulation[J]. Front Optoelectron China,2009,2(1):1-8.
[5] Liu X G,Zhou Y J,Liu T C,et al. Effects of low-level laser irradiation on rat skeletal muscle injury after eccentric exercise[J]. Photomed Laser Surg,2009,27(6):863-869.
[6] 刘承宜,袁建琴,陈少华. 科学训练、健康传播与奥运的平民化战略[J]. 体育学刊,2007,14(3):33-36.
[7] 刘承宜,袁建琴,付德荣,等. 以赛带练的内稳态研究[J]. 体育学刊,2008,15(5):81-84.
[8] 刘承宜,朱平. 低强度激光鼻腔内照射疗法[M].北京:人民军医出版社,2009:50-413.
[9] 刘承宜,任占兵. 生理经济学[J]. 华南师范大学学报:自然科学版,2011(2):1-6.
[10] 张京红,卢健,陈彩珍,等. 运动中活性氧与抗氧化剂补充的内稳态研究述评[J]. 体育学刊,2009,16(11):100-104.
[11] Bedford T G,Tipton C M,Wilson N C,et al.Maximum oxygen consumption of rats and its changes with various experimental procedures[J]. J Appl Physiol,1979,47(6):1278-1283.
[12] 潘华山,谭婧,刘刚. 同一稳态下自由基平衡系统移动调节因子的推测及实验[J]. 体育学刊,2010,17(7):86-89.
[13] 山内钟平. 实验动物的环境与管理[M]. 上海:上海科学普及出版社,1989.
[14] 吴端生,张健. 现代实验动物学技术[M]. 北京:化学工业出版社,2007:422-434.
[15] Liu T C,Li F H. Photonic homeostatics[J]. Proc SPIE,2010,7845:1-9.
[16] 付德荣,刘承宜,孙小华. 运动性骨骼肌损伤的内稳态研究综述[J]. 体育学刊,2011,18(1):133-138.
[17] Higuchi M,Cartier L J,Chen M,et al. Superoxide dismutase and catalase in skeletal muscle: adaptive response to exercise[J]. J Gerontol,1985,40(3):281-286.
[18] Lestas I,Vinnicombe G,Paulsson J. Fundamental limits on the suppression of molecular fluctuations[J].Nature,2010,467:174-178.
[19] 李江华,刘承宜,徐晓阳,等. 2006多哈亚运会短距离游泳男运动员代谢组学研究[J]. 体育科学,2008,28(2):42-46.
[20] 梁东梅,刘承宜,邱丽华,等. 不同级别中国象棋运动员脑功能成像研究[J]. 体育科学,2010,30(8):69-72.
[21] Dékány M,Nemeskéri V,Györe I,et al. Antioxidant status of interval-trained athletes in various sports[J]. Int J Sports Med,2006,27(2):112-116.
[22] Teixeira V,Valente H,Casal S,et al. Antioxidant status,oxidative stress,and damage in elite trained kayakers and canoeists and sedentary controls[J]. Int J Sport Nutr Exerc Metab,2009,9(5):443-456.
[23] Sen C K,Marin E,Kretzschmar M,et al. Skeletal muscle and liver glutathione homeostasis in response to training,exercise,and immobilization[J]. J Appl Physiol,1992,73(4):1265-1272.
[24] 李晖,辛东,李静先,等. 递增负荷运动至力竭大鼠肾脏自由基产生及氧化抗氧化能力的研究[J]. 中国运动医学杂志,1999,18(1):31-33.
[25] Jimenez L,Lefevre G,Richard R,et al. Exercise does not induce oxidative stress in trained heart transplant recipients[J]. Med Sci Sports Exerc,2000,32(12):2018-2023.
[26] Elokda A S,Shields R K,Nielsen D H. Effects of a maximal graded exercise test on glutathione as a marker of acute oxidative stress[J]. J Cardiopulm Rehabil,2005,25(4):215-219.
Enhancement of oxidation–antioxidation homeostasis by high intensity exercising
LIU Gang1,PAN Hua-shan1,PENG Yi-hai2,FENG Yi-chong1,LIU Cheng-yi3
(1.School of Physical Education and Health,Guangzhou University of Chinese Medicine,Guangzhou 510006,China;
2.School of Physical Education,South China University of Technology,Guangzhou 510641,China;
3.Laboratory of Laser Sports Medicine,South China Normal University,Guangzhou 510006,China)
In order to probe into the enhancement of the quality of oxidant-antioxidant homeostasis (OAH) by high intensity exercising, the authors divided 30 SD rats randomly into a training intervention group and a calm control group. The rats in the training intervention group ran on a treadmill for 8 weeks under such conditions as 10% slope,28m/min, 60min/time, 1 time/day, 5 days/week, while no exercising intervention measure was taken for the rats in the calm control group. Gastrocnemius muscle and blood serum were sampled at 72h after the last round of training.The test indexes were malondialdehyde (MDA), total superoxide dismutase (TSOD), catalase (CAT) and reduced glutathione (RGSH) in skeletal muscle and blood serum. The authors revealed the following findings: the content of RGSH and the activity of TSOD in skeletal muscle and blood serum increased significantly; MDA decreased significantly in blood serum, but increased significantly in skeletal muscle; the activity of CAT increased significantly in blood serum, but remained unchanged in skeletal muscle. The experiment indicated that high intensity training can realize the enhancement of OAH of SD rats.
sports biochemistry;redox; homeostasis;high intensity exercising;rats
G804.7
A
1006-7116(2012)02-0138-04
2011-08-25
广东省科技厅科技计划项目(2006B35604006);国家自然科学基金(60878061)。
刘刚(1983-),男,助教,硕士,研究方向:运动疗法研究。

