2mM肌酸孵育对电刺激C2C12肌管细胞糖原合成通路的影响
赵 军,徐晓阳,林文弢,周 周
,
2mM肌酸孵育对电刺激C2C12肌管细胞糖原合成通路的影响
赵 军1,2,徐晓阳1,林文弢3,周 周1
,
目的:研究肌酸对骨骼肌糖原合成调节的影响及机制;方法:用培养的C2C12为细胞模型,用电刺激模拟神经冲动引起其收缩,测定肌酸孵育后电刺激下C2C12肌管细胞的糖原含量以及AMPKα1、HKII及GS-I等糖原合成通路中相关基因表达;结果:肌酸孵育能够有效促进电刺激下C2C12肌管糖原的合成,主要机制是糖原合成通路激活后,AMPKα1激活对糖原合成的正效应。但2mM肌酸孵育可能触发负反馈调节机制,抑制电刺激下C2C12肌管糖原合成相关酶基因的表达,维持细胞的内稳态;结论:细胞实验提示在体的肌酸补充能够促进骨骼肌糖原合成,增加肌糖原贮备,提高运动能力,为肌酸的合理补充提供参考依据。
C2C12肌管;肌酸;肌糖原;AMPKα1mRNA;HKII mRNA;GS-I mRNA
1992年,Harris[5]证明,口服肌酸能够增加骨骼肌纤维内肌酸含量以来,众多研究表明,补充肌酸具有促进骨骼肌收缩能力,提高短时间大强度运动能力。肌酸促进骨骼肌的糖原合成是其提高运动能力的重要因素之一[12],并引来众多学者的关注。目前,肌酸促进骨骼肌糖原合成的具体机制尚不清楚,现阶段认为,其可能的机制是:1)骨骼肌摄取肌酸后导致肌细胞体积涨大,激活糖原合成通路;2)肌酸促进胰岛素分泌增多,增加骨骼肌葡萄糖的吸收。对肌酸影响骨骼肌糖代谢进行深入研究,不仅有利于增进运动能力,而且肌酸促进骨骼肌葡萄糖的吸收,改善高血糖的作用[8],使其成为II型糖尿病治疗的潜在手段。
电刺激C2C12细胞收缩与在体骨骼肌收缩有许多相同点,因此,可以作为研究骨骼肌细胞信号转导机制的首选模型,通过肌酸孵育C2C12肌管细胞,避免了其他器官、组织和细胞对肌管细胞的影响,直接观察到其糖代谢相关酶基因表达的变化,为肌酸对糖代谢影响的机制研究提供了平台。所以,本研究以C2C12肌管为实验对象,以2mM肌酸孵育48h和随后一次性电刺激(15v,30ms,3Hz)60 min和120min对其进行干预,即刻收样,测定C2C12肌管糖原含量以及AMPKα1、HKII及GS-I mRNA的表达,对肌管细胞糖原合成通路进行研究。
1 研究方法
1.1 实验材料
C2C12细胞(小鼠骨骼肌成肌细胞系)购自南方医科大学;L-谷氨酰胺、二甲基亚砜(DMSO)、肌酸、DEPC购于美国sigma公司;4-羟乙基哌嗪乙磺酸(HEPES)购于MBCHEM公司;胎牛血清购于杭州四季青公司;DMEM高糖培养基、马血清购于美国GIBCO公司;肌糖原、LDH测定试剂盒购于南京建成生物工程研究所;引物合成购于广州杰特伟生物有限公司;First Strand cDNA Synthesis Kit购于美国GeneCopoeia公司;2×AllinOneTM Q-PCR Mix购于美国GeneCopoeia公司;Primer购于美国Invitrogen公司。
1.2 电刺激方式及分组
C2C12细胞在常规培养下,经过复苏、传代、增殖,获得增殖良好C2C12细胞。
取生长状态良好的细胞传代,以2×105接种于35mm小皿,待细胞铺满80%~90%皿底面积后,再加入分化培养基孵育5天,然后分组培养,按照电刺激不同,分为2个正常对照组(C组),电刺激组(60min E、120min E组),2个单纯肌酸组(Cr)和肌酸+电刺激组(60min Cr+E、120 min Cr+E),共8组。肌酸组加入2mM肌酸的DMEM培养基,孵育48h,其余组加入分化培养基正常培养。
采用GRASS S48Stimulator型电刺激器电刺激分化7天的E组和Cr+E组C2C12肌管,强度为15V、30ms、3Hz,其余各组不刺激,电刺激时间分别为60min、120 min。电刺激时,其余各组继续正常培养,电刺激结束后,即刻收样,严格按照实验步骤及要求,测定C2C12肌管糖原含量以及AMPKα1、HKII及GS-I mRNA的水平。
1.3 C2C12细胞增殖及分化过程中形态学观察
在倒置显微镜下观察并用数码相机拍照,对其形态学进行观察。
1.4 C2C12肌管上清液LDH活性的测定
采用南京建成生物工程研究所提供的乳酸脱氢酶(LDH)测定试剂盒,用细胞培养上清液作为样本。依照试剂盒说明书测定C2C12肌管上清培养液中的LDH活性。
1.5 C2C12肌管糖原含量的测定
采用南京建成生物工程研究所提供的肌糖原测定试剂盒,依照说明书测定肌糖原含量。
1.6 实时荧光定量PCR测定C2C12肌管AMPKα1、HKII及GS-I mRNA水平
1.总RNA的提取:实验处理完成后收集35mm细胞培养皿中的细胞样品,完全吸走细胞培养液,转移至含有1ml Trizol的离心管中,采用Trizol一步法提取总RNA,行琼脂凝电泳检测,通过紫外测定其浓度和纯度,以DEPC水做空白对照,记录RNA浓度和OD260/OD280。
2.mRNA反转录合成cDNA:根据不同样本RNA浓度和终浓度计算样本总RNA的体积,加入250μmolRD引物1μl,再加入焦磷酸二乙酯(DEPC)处理的无菌纯水至总体积13μl,65℃变性10min,立即置于冰上冷却;配制反转录反应液:在RNA-Primer Mix反应管内加入5х反应缓冲液5μl、25mmol dNDP 1μl、25U/μl RNase抑制剂1μl、200U/μl M-MLV RTase 1μl、加入DEPC处理的无菌纯水4μl至总体积的25μl。混匀,短暂离心后37℃孵育1h,85℃灭活处理5min,最后-20℃保存反转录产物备用。
3.PCR引物的合成(表1):以GAPDH为内参照。

表1 本研究各引物序列及大小一览表Table 1 The primer design of AMPKα1,HKII,GS-I,and GAPDH
4.实时荧光定量PCR法扩增:将2×AllinOneTM QPCR Mix在室温下融解,取10μl加入上下游引物(0.4 μmol)各2μl,cDNA(1:10稀释)5μl,无菌去离子水(ddH2O)1μl至PCR反应体系为20μl。混匀后加入96孔板中短暂离心,采用标准三步法程序进行PCR。扩增条件:93℃预变性10min,93℃变性30s,55℃退火45s,72℃延伸30s,共40个循环。反应在ABI PRISM 7000sequence detection system实时荧光定量PCR仪上进行,72℃~95℃缓慢升温,产生相应指标的融解曲线,重复检测2次。
5.实时荧光定量PCR产物:采用仪器自带的软件进行分析,观察扩增曲线和融解曲线,以GAPDH为内参基因,对cDNA的含量进行相对定量分析,计算样本的△△Ct值。
1.7 统计学方法
应用SPSS 17.0统计学软件进行统计学处理。各组的数据资料以均值±标准差()表示,并用单因素方差分析进行各组间的差异显著性检验,P<0.05为差异具有显著性,P<0.01为极显著性差异。
2 结果分析
2.1 C2C12细胞增殖、分化及肌酸孵育过程中形态的变化
C2C12细胞为梭形贴壁细胞,增殖期的第3至4天,细胞密度即可长至皿底面积的95%。分化第2天,肌管即清晰可见,第5天肌管遍布整个视野。肌酸孵育24h,可见肌管更为粗大,数目增多,排列整齐(图1~图4)。

图1 本研究C2C12细胞电镜图Figure 1 C2C12Cell

图2 本研究细胞分化2天电镜图Figure 2 Cell differentiation for 2days

图3 本研究细胞分化5天电镜图Figure 3 Cell differentiation for 5days

图4 本研究肌酸孵育24h电镜图Figure 4 Creatine incubation for 24h
2.2 电刺激C2C12肌管糖原含量、LDH活性的变化
在确定电刺激强度和时间的预实验中,15V、30ms、3Hz强度的电刺激60min后,分化7天的肌管糖原含量稍高于对照组;电刺激120min,糖原含量显著性降低;120min的电刺激对培养上清液中LDH水平没有显著性影响(表2)。
2.3 2mM肌酸孵育对不同电刺激下C2C12肌管糖原含量的影响
分化7天的肌管细胞电刺激120min后,E组较C组糖原含量显著性降低(P<0.05)。肌酸孵育对无电刺激的肌管糖原含量的影响甚微,Cr组分别与C组相比无显著性差异;肌酸孵育可以明显抑制电刺激120min后肌管糖原含量的下降趋势,由0.3795±0.0248升高至0.4575 ±0.0945(P<0.05);电刺激60min的Cr+E组也较E组略高(0.1711±0.0169和0.1597±0.0073),但无显著性差异(表3)。
2.4 2mM肌酸孵育对不同电刺激下C2C12肌管AMPKα1mRNA表达的影响
从图5、图6可以看出,AMPKα1的各个样本扩增效果良好。

表2 本研究不同电刺激时间对糖原含量、LDH活性的影响一览表Table 2 The effect of different electrical stimulation duration on glycogen and activity of LDH of C2C12cell
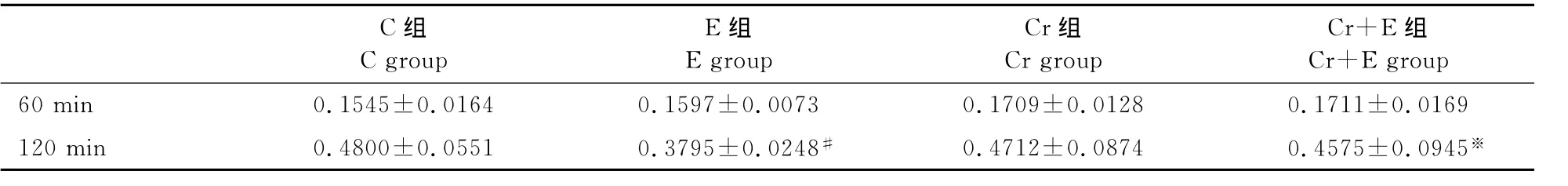
表3 本研究2M肌酸孵育对不同电刺激下C2C12肌管糖原含量的影响一览表Table 3. The effect of 2Mcreatine incubation and different electrical stimulation duration on the content of glycogen of C2C12cell (mg/g)

图5 本研究AMPKα1扩增曲线图Figure 5. Amplification curve of AMPKα1

图6 本研究AMPKα1溶解曲线图Figure 6. Solubility curve of AMPKα1
电刺激60min后,E组、Cr+E组AMPKα1mRNA表达均极显著高于C组(P<0.01),分别是对照组的5.03倍、5.26倍;Cr组AMPKα1mRNA表达显著高于C组(P<0.05);Cr+E组AMPKα1mRNA表达有极显著高于Cr组的趋势(P<0.01)。电刺激120min后,E组、Cr组、Cr+E组AMPKα1mRNA表达极显著高于C组(P<0.01),分别是对照组的4.68倍、4.96倍、5.69倍。结果表明,肌酸孵育和电刺激均能显著性促进肌管AMPKα1的基因表达,并且肌酸和电刺激的正效应可以累加(表4)。

表4 本研究2M肌酸孵育对不同电刺激下C2C12肌管AMPKα1mRNA相对表达率的影响一览表Table 4. The effect of 2Mcreatine incubation and different electrical stimulation duration on the relative expression of AMPKα1mRNA of C2C12cell
2.5 2mM肌酸孵育对不同电刺激下C2C12肌管HKIIm-RNA表达的影响
从图7和图8可以看出,HKII的各个样本扩增效果良好。
电刺激60min后,E组、Cr+E组HKIImRNA表达均极显著高于C组(P<0.01),分别是对照组的3.65倍、1.98倍;Cr+E组HKIImRNA表达与E组相比有显著下降(P<0.05)。电刺激120min后,各组HKIImRNA表达与C组相比均无显著性差异(P>0.05,表5)。

表5 本研究2M肌酸孵育对不同电刺激下C2C12肌管HKIImRNA相对表达率的影响一览表Table 5. The effect of 2Mcreatine incubation and different electrical stimulation duration on the relative expression of HKIImRNA of C2C12cell
2.6 2mM肌酸孵育对不同电刺激下C2C12肌管GS-ImRNA表达的影响
从图9和图10可以看出,GS-I的各个样本扩增效果良好。

图7 本研究HKII扩增曲线图Figure 7. Amplification curve of HKII

图8 本研究HKII溶解曲线图Figure 8. Solubility curve of HKII

图9 本研究GS-I扩增曲线图Figure 9. Amplification curve of GS-I

图10 本研究GS-I溶解曲线图Figure 10. Solubility curve of GS-I
电刺激60min后,E组、Cr+E组GS-ImRNA表达分别极显著性和显著性高于C组,分别是C组的2.36倍、1.84倍;Cr+E组与E组相比,GS-ImRNA表达极显著的下降(P<0.01)。电刺激120min后,E组GS-ImRNA表达极显著高于C组(P<0.01),约是C组的2倍;Cr组、Cr+E组与E组相比,GS-ImRNA表达有显著的下降(P<0.05,表6)。
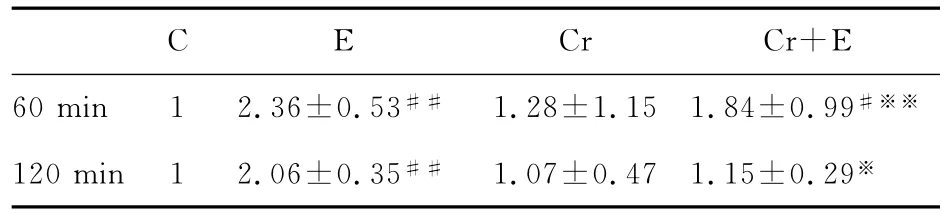
表6 本研究2M肌酸孵育对不同电刺激下C2C12肌管GS-ImRNA相对表达率的影响一览表Table 6. The effect of 2Mcreatine incubation and different electrical stimulation duration on the relative expression of GS-ImRNA of C2C12cell
3 讨论
肌酸作为一种天然的促力营养物,对骨骼肌的物质和能量代谢有重要的作用。本研究在电刺激模拟运动的前提下,通过离体的细胞实验,探讨在细胞水平下补充肌酸对肌管细胞糖代谢的影响。实验通过即刻测得指标,从而避免了其他因素的干扰。
实验之前,首先对肌酸的浓度和电刺激条件进行了摸索。目前运动员补充肌酸,常用的推荐方案是以冲击剂量(20g/人/天)服用5~7天,然后以维持量继续服用。根据Ceddia RB等[3]研究,0.5mM浓度的肌酸孵育L6细胞相当于人一次口服5g剂量,经过换算,2mM肌酸相当于人体服用肌酸的冲击剂量。
电刺激肌管能够产生与在体肌肉同样的收缩反应及代谢变化,而不同电刺激强度所引起的变化却并不相同。根据文献[4]和本实验组以前的实验经验[1],本实验采用强度为15V,30ms,3Hz的电刺激。因为在预实验过程中,发现135min和150min电刺激C2C12肌管后,均发现细胞大片脱落死亡,所以,选取电刺激的时间是60min和120 min,而且培养上清液的LDH浓度反映肌管细胞在该强度和时间的电刺激下,细胞损伤程度较小。
肌糖原的变化与运动时间有密切的关系。本实验中,电刺激组C2C12肌管糖原的含量与对照组相比,随着电刺激时间延长,糖原含量呈下降趋势,且电刺激120min糖原含量与对照组相比有显著降低(P<0.05);这与在体研究中随着时间的延长,糖原消耗明显增加的反应是相似的。60min电刺激E组糖原含量略高于对照组,可能是由于电刺激时间相对较短,肌管的糖原消耗不是很明显,适当的电刺激可能激活了糖原合成的一些调控分子或酶蛋白,并且在电刺激过程中不断有高糖培养基来补充,故糖原合成有所增加。
本实验中,2mM肌酸孵育能够明显改善120min电刺激导致的肌管细胞内糖原含量下降的趋势,说明2mM肌酸孵育48h能够促进电刺激下肌管细胞的糖原合成通路;但肌酸孵育48h对无电刺激的肌管糖原含量无显著性影响,这与Ceddia RB[3]的结果是相一致的。以前研究[9,10]发现,肌酸补充能够明显增加骨骼肌糖原含量,但都是建立在骨骼肌收缩的基础之上;对于没有运动刺激的情况下,单纯补充肌酸并不能明显增加骨骼肌糖原含量:如Young C等[14]给安静大鼠补充肌酸并不能增加骨骼肌糖原;Rooney K等[13]也发现,补充肌酸对骨骼肌糖原合成酶活性也没有影响。究其原因,可能是只有当骨骼肌内糖原含量明显下降,其糖原合成通路被充分激活后,肌酸促进糖原合成的效应才会显现,促进骨骼肌的糖原合成;但如果肌细胞糖原含量变化不大时,糖原合成通路的各个调控因子及酶蛋白活性没有被充分激活,肌酸就不可能促进肌细胞的糖原合成。
肌酸是如何促进骨骼肌收缩后糖原合成的呢?首先,骨骼肌糖原合成通路中,AMPK、HKII、GS-I均起着关键的调节作用。AMPK是一种多功能的丝氨酸/苏氨酸蛋白激酶,它是细胞内的能量感受器,当细胞内的AMP/ATP升高时,会使AMPK发生磷酸化而激活。肌肉收缩会导致肌细胞的AMPK磷酸化、AMPKmRNA表达增加。AMPK活性也可能受到细胞内PCr/TCr比率的影响[11],补充肌酸会增加肌细胞内TCr,降低PCr/TCr比率,从而激活AMPK。α亚单位是AMPK主要的催化亚基,AMPK的上游激酶LKBI可以通过磷酸化AMPKα亚基的172苏氨酸残基特异性激活AMPK。AMPK激活的主要作用是促进能量物质的分解,以生成更多的ATP;pAMPK可以激活骨骼肌HKII[2],抑制GS-I[7]。HKII主要表达于骨骼肌和脂肪组织,主要作用是催化葡萄糖磷酸化,生成6-磷酸葡萄糖(G6P)。G6P既可进入糖酵解途径,也可转化成1-磷酸葡萄糖,经尿苷二磷酸葡萄糖(UDPG)途径进入糖原合成通路。GS是肝和肌肉糖原的限速酶,胰岛素可以使糖原合成酶去磷酸化而被激活,促进糖原的合成。骨骼肌中主要表达GS-I。GS-I是催化葡萄糖经UDPG转变成糖原的关键酶,在糖原合成的一系列步骤中,GS-I的活力调节很复杂,既包括变构调节,也包括共价调节。
其次,Hunter RW[6]通过转基因小鼠实验提出以下假设:长时间AMPK激活可以导致骨骼肌糖原合成增加,其机制主要是,AMPK活性持续性升高,导致葡萄糖摄取增加;而当肌细胞利用葡萄糖释能通路没有同比例增加时,会引起肌细胞内G6P积累。G6P对GS有持续性变构作用,增加GS活性,超过AMPK对GS的抑制性作用,GS活性反而升高,从而使肌细胞内糖原合成增加。

图11 AMPK介导骨骼肌糖原合成的可能机制示意图(引自Hunter RW[6])Figure 11. The possible mechanism of muscle glycogen synthesis mediated by AMPK
最后,本实验表明,电刺激引起的肌管收缩后,其AMPKα1mRNA表达显著性升高,同时,HKIImRNA、GSImRNA也升高,说明随着肌管糖原减少,糖原合成通路代偿性激活,促进了相关酶基因表达;2mM肌酸孵育48h后,由于细胞内PCr/TCr比率增加,电刺激下AMPK活性更显著性升高,促进HKII酶蛋白活性,生成更多的G6P,而G6P积累会抵消AMPK对GS-I的抑制作用,从而促进更多的糖原合成,导致肌酸促进糖原合成的正协同效应。所以,笔者认为,肌酸促进骨骼肌糖原合成包含2个必要条件:1)肌酸促进AMPK活性增加;2)糖原合成通路已经激活。
2mM肌酸孵育48h后,60min、120min电刺激组尽管肌管糖原含量、AMPKα1mRNA与无肌酸孵育的电刺激组相比升高,但是,肌管细胞内HKIImRNA和GS-1mRNA并没有同步性升高,反而出现下降趋势,与糖原含量、AMPKα1mRNA增加出现相左的情况。考虑到2mM肌酸浓度相当于人体口服时的冲击剂量,肌酸孵育48h后肌管细胞内肌酸浓度较高,在电刺激和PCr/TCr比率急剧降低情况下,肌酸促进肌糖原合成的正效应可能接近峰值,肌管内糖原合成的速率达到比较高的水平,此时很有可能激活了糖原合成通路的负反馈调节,从而降低HKII、GS-ImRNA表达,使糖原合成不致过度旺盛,影响细胞的内稳态;此外,也不能排除肌管内高浓度肌酸会直接抑制HKII、GS-ImRNA表达,和/或是由于长时间电刺激导致细胞内高浓度肌酸分解产物对HKII、GS-I基因表达的抑制作用。
4 小结
1.以电刺激方式来模拟神经冲动,随着刺激时间的延长,C2C12肌管糖原消耗增大。电刺激120min时,肌管可能与在体非力竭性运动能量代谢变化情况相似。电刺激前肌酸孵育48h,能够有效促进C2C12肌管糖原的合成,并保持电刺激期间糖原维持在较高水平。
2.肌酸能促进骨骼肌糖原合成,其主要机制是在糖原合成通路激活的条件下,AMPKα1激活对糖原合成的正效应。
3.2mM肌酸孵育可能会使电刺激下C2C12肌管的糖原合成达到较高程度,反而会产生负反馈调节,抑制相关酶蛋白基因的表达,不利于后期肌糖原的合成。
5 结论
本实验提示,肌酸的补充能够促进长时间运动时骨骼肌糖原合成的速率,增进补糖的效果,延缓骨骼肌糖原的减少,为长时间运动提供能源物质,延长运动时间;补充肌酸,促进运动后肌糖原的超量恢复。
[1]潘红英,徐晓阳,刘承宜,等.电刺激C2C12细胞时活性氧生成的变化[J].中国运动医学杂志,2006,25(1):46-49.
[2]ABNOUS K,STOREY K B.Skeletal muscle hexokinase:regulation in mammalian hibernation[J].Mol Cell Biochem,2008,319(1-2):41-50.
[3]CEDDIA RB,SWEENEY G.Creatine supplementation increases glucose oxidation and AMPK phosphorylation and reduces lactate production in L6rat skeletal muscle cells[J].J Physiol,2004,555(Pt 2):409-421.
[4]FROST R A,NYSTROM G J,LANG C H.Tumor necrosis factor-alpha decreases insulin-like growth factor-I messenger ribonucleic acid expression in C2C12myoblasts via a Jun N-terminal kinase pathway[J].Endocrinol,2003,144(5):1770-1779.
[5]HARRIS R C,SODERLUND K,HULTMAN E.Elevation of creatine in resting and exercised muscle of normal subjects by creatine supplementation[J].Clin Sci(Lond),1992,83(3):367-374.
[6]HUNTER R W,TREEBAK J T,WOJTASZEWSKI J F,et al.Molecular mechanism by which AMP-activated protein kinase activation promotes glycogen accumulation in muscle[J].Diabetes,2011,60(3):766-774.
[7]JORGENSEN S B,NIELSEN J N,BIRK J B,et al.The alpha2-5'AMP-activated protein kinase is a site 2glycogen synthase kinase in skeletal muscle and is responsive to glucose loading[J].Diabetes,2004,53(12):3074-3081.
[8]MATTHEWS R T,YANG L,JENKINS B G,et al.Neuroprotective effects of creatine and cyclocreatine in animal models of Huntington's disease[J].J Neurosci,1998,18(1):156-163.
[9]OP'EB,RICHTER E A,HENQUIN J C,et al.Effect of creatine supplementation on creatine and glycogen content in rat skeletal muscle[J].Acta Physiol Scand,2001,171(2):169-176.
[10]OP'EB,URSO B,RICHTER EA,et al.Effect of oral creatine supplementation on human muscle GLUT4protein content after immobilization[J].Diabetes,2001,50(1):18-23.
[11]PONTICOS M,LU Q L,MORGAN J E,et al.Dual regulation of the AMP-activated protein kinase provides a novel mechanism for the control of creatine kinase in skeletal muscle[J].EMBO J,1998,17(6):1688-1699.
[12]ROBINSON T M,SEWELL D A,HULTMAN E,et al.Role of submaximal exercise in promoting creatine and glycogen accumulation in human skeletal muscle[J].J Appl Physiol,1999,87(2):598-604.
[13]ROONEY K,BRYSON J,PHUYAL J,et al.Creatine supplementation alters insulin secretion and glucose homeostasis in vivo[J].Metabolism,2002,51(4):518-522.
[14]YOUNG J C,YOUNG R E.The effect of creatine supplementation on glucose uptake in rat skeletal muscle[J].Life Sci,2002,71(15):1731-1737.
The Effect of 2mM Creatine Incubation and Electrical Stimulation on the Path of Glycogen Synthesis of C2C12Myotube
ZHAO Jun12,XU Xiao-yang1,LIN Wen-tao3,ZHOU Zhou1
Objective:To investigate the possible mechanism of increment of skeletal muscle glycogen by creatine.Method:Through the cell model of cultivated C2C12and electrical-stimulated C2C12,this paper investigated the effect of creatine and electricity on the glycogen synthesis of C2C12and the expression of the related genes such as AMPKα1,HKII and GS-I.Result:The supplementation of creatine could increase the glycogen synthesis of electrical-stimulated C2C12,and the main mechanism is positive effect of stimulated of AMPKα1,after the path of glycogen synthesis is stimulated.However,2mM creatine restrains the gene expression of HKII and GS-I of electrical-stimulated C2C12to maintain the cell homeostasis.Conclusion:The cell experiment suggests that creatine supplementation can increase the synthesis and content of muscle glycogen,so enhance the ability of exercise.
C2C12myotube;creatine;muscleglycogen;AMPKα1mRNA;HKIImRNA;GS-I mRNA
G804.7
A
1000-677X(2011)09-0063-06
2011-07-11;
2011-08-28
赵军(1971-),男,湖北宜昌人,副教授,在读博士研究生,主要研究方向为营养与运动生物化学,Tel:(020)85220282,E-mail:tzhaojun@jnu.edu.cn。
1.华南师范大学体育科学学院,广东广州510006;2.暨南大学体育部,广东广州510632;3.广州体育学院运动生化省重点实验室,广东广州510500
1.South China Normal University,Guangzhou 510006,China;2.Jinan University,Guangzhou 510632,China;3.Guangzhou Sport College,Guangzhou 510500,China.

