基于核酸适配体-荧光染料EvaGreenTM快速检测ATP的研究
陈伶利 ,李 杰 ,贺气志 ,陈 辉 ,毛平道 ,邓 乐 *
(1.湖南师范大学生命科学学院,湖南 长沙 410081;2.湖南中医药大学基础医学院,湖南 长沙 410208)
基于核酸适配体-荧光染料EvaGreenTM快速检测ATP的研究
陈伶利1,2,李 杰2,贺气志1,陈 辉1,毛平道1,邓 乐1*
(1.湖南师范大学生命科学学院,湖南 长沙 410081;2.湖南中医药大学基础医学院,湖南 长沙 410208)
目的 利用荧光嵌入染料EvaGreenTM在单双链DNA溶液中不同的荧光性质构建基于核酸适配体的ATP检测体系,建立一种简单、高效的检测ATP的新方法。方法 利用ATP核酸适配体双链DNA(dsDNA)和核酸绿色荧光染料Eva GreenTM嵌合作用,实现了对ATP的检测。考察了ATP的孵育温度、pH、浓度等因素对荧光强度的影响,并对该方法的特异性进行了验证。结果 反应体系在12℃,pH 7.5条件下具有最佳实验效果,在最优条件下,最低能检测10-6mol/L的ATP,并具有较高的特异性。结论 本研究为ATP的快速检测提供了一种易于操作、低成本的新方法。
核酸适配体;EvaGreenTM;ATP;检测
腺嘌呤核苷三磷酸 (adenosine-triphosphate,ATP)在生物体与外界进行物质和能量交换的过程中,起着重要的桥梁、纽带作用,它是生物体各种生命活动能量的直接来源,因此在很多的生物反应检测中ATP是一项重要的检测内容[1-2]。目前,检测ATP的方法主要有电泳法、光学分析法、层析法、生物发光法(荧光素酶法)等,但是以上方法操作复杂、费时,且灵敏度不高;2009年 Li W等人提出用金纳米粒子来检测ATP,可以检测到1~10mmol/L的ATP,大大提高了检测灵敏度,但此方法需要制备特异的核酸修饰的金纳米探针,检测成本较高[3]。Huizenga和 Szostak于1995年通过SELEX技术筛选出ATP/Adenosine适配体[4],基于适配体技术的检测研究受到了极大的关注[5-7]。2008年Zhang Chen等将量子点标记的适配体生物传感器用于ATP检测[8],2009年孙波等用高灵敏适配体电化学发光生物传感器来检测血样中的ATP[9],但是这些方法需要使用特殊试剂,分析成本较高。染料Eva GreenTM是一种绿色荧光核酸染料,它有良好的热稳定性和水解稳定性,为常规操作提供了便利,而Eva GreenTM本身没有荧光,与dsDNA嵌合后能发出高亮度的荧光,但当dsDNA转化为ssDNA后荧光强度将大大减弱。与荧光核酸染料SYBRTM GreenⅠ相比,E-va GreenTM可以在更高浓度下使用,从而产生更强的扩增信号[10-12]。
本研究以ATP为目标分析物,以核酸适配体-ATP的特异性识别与dsDNA与荧光染料Eva GreenTM的嵌合作用为基础,发展了一种简单、灵敏的荧光检测新技术。由于Eva GreenTM与dsDNA嵌合后能发出高亮度的荧光,但与ssDNA结合后荧光强度大大减弱。利用核酸适配体-ATP复合物的形成所引起的荧光值变化来检测ATP。实验结果表明,本方法操作简单,不需要对样品进行处理,检测所需时间短,整个检测过程可以在40min内完成。同时具有较高的灵敏性、较强的特异性,最低检测下限为10~6 M;该方法的建立为ATP的分析检测提供了新的技术支持。现将方法与结果报道如下。
1 材料与方法
1.1 材料
1.1.1 仪器 LS50B型荧光分光光度计(PerkinElmer,美国)。
1.1.2 试剂 染料Eva GreenTM购自北京美莱博医学有限公司 (Biotium,美国,20×),使用时稀释20倍;ATP、GTP、CTP、UTP购自上海生物工程技术服务公司(BBI公司);实验用水均为超纯水;缓冲液为0.01moL/L 磷酸缓冲液 (PBS,pH 6.0~8.0), 均为115℃灭菌20min,冷却后备用;所有序列(表1)均由上海生工生物工程技术服务公司合成,PAGE纯化。

表1 ATP核酸适配体序列表
1.2 实验原理
本实验的分子识别与检测原理如图1所示:利用荧光嵌入染料EvaGreenTM在单双链DNA溶液中不同的荧光性质构建了基于核酸适配体的ATP检测体系。由于绿色荧光染料Eva GreenTM与dsDNA的嵌合作用,系统产生较强的荧光信号。当dsDNA与ATP孵育后,ATP能识别其特异适配体,并形成适配体-ATP复合物,使DNA双链解链,嵌合的荧光染料Eva GreenTM得以释放,从而导致系统荧光信号骤然减弱,通过检测系统荧光信号变化强度可定量测定ATP的浓度。

图1 核酸适配体-ATP复合物荧光信号传感技术原理示意图
1.3 方法
1.3.1 dsDNA制备 取10μmol的ATP核酸适配体溶液与10μmol/L的互补序列等量混和,4℃过夜,即得10μmol/L的含ATP适配体的dsDNA。
1.3.2 适配体与ATP相互作用 取10μmol的dsDNA 5 μL于1.5 mL EP管中,再分别加入0.01moL/L PBS(pH 7.5)589 μL,不同浓度 ATP 6 μL,对照管以等体积PBS代替ATP。于12℃孵育1 h。
1.3.3 荧光值的检测 分别取与ATP孵育后的溶液及对照管溶液各197.5 μL,并加入 2.5 μL Eva GreenTM,振荡10min后在荧光分光光度计上分别测其荧光值,调激发波长为490 nm,发射波长为525 nm。实验重复3次,取平均值。
2 结果
2.1 孵育温度对于荧光强度的影响
反应温度对适配体与ATP的结合能产生一定的影响。将dsDNA与ATP反应体系置于不同温度下反应,检测荧光信号变化值,确定该反应的最佳孵育温度。室温(约12℃)为最佳的孵育温度。温度较低或较高时,dsDNA的解链不完全,与其嵌合的荧光染料Eva GreenTM释放量少,从而检测到的荧光信号变化不显著,见图2。
2.2 不同pH值对于荧光强度的影响

图2 孵育温度对荧光影响强度的柱形分析图
在反应体系中,不同的pH值的PBS缓冲液对荧光强度的检测也具有显著的影响。在空白荧光为489.38 的条件下,pH 6.0、 6.5、 6.8、 7.0、 7.3、7.5、8.0所测得的荧光值分别为 358.02、288.04、276.34、266.83、236.64、183.26、226.04 au,实验重复 3 次,取平均值。该结果表明:pH值为7.5时,反应检测所得的荧光强度最低,即荧光变化值最大,说明在pH 7.5时,缓冲液对反应体系的影响最小。这是因为荧光强度的变化决定于Eva GreenTM的释放量,而Eva GreenTM的释放量又受适配体-ATP结合程度的影响,而pH值能够影响适配体-ATP复合物的解离,在pH 7.5时,适配体-ATP复合物的解离程度最小,因此该pH是本反应体系的最适值,见图3。
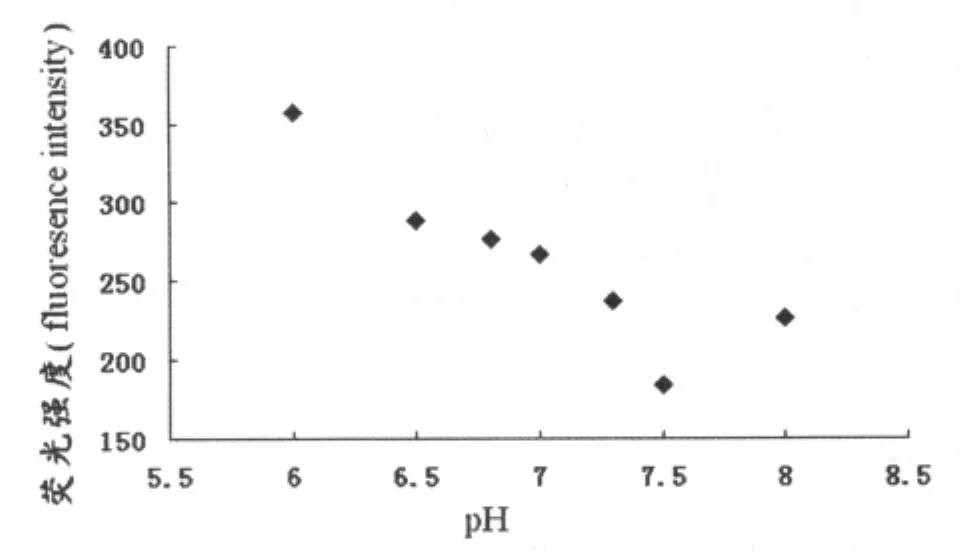
图3 pH值对荧光强度检测影响的散点分析图
2.3 线性范围及检出下限
考察了ATP的浓度对于反应体系荧光信号检测的影响。在空白荧光为489.38,背景信号为13.57的条件下,随着ATP浓度的减小,所测得的荧光信号与空白对照的变化值越来越小,当ATP浓度为10-7mol/L时,所测结果与10-6mol/L变化很小,趋近为零,说明对10-7mol/L的检测无意义,见图4。
2.4 ATP特异性检测

图4 ATP浓度对于荧光强度影响的散点分析图
为了检验本体系对ATP检测的特异性,实验还考察了不同浓度的其他同类型NTP分子,即CTP、GTP、UTP分子。将NTP分子与实验所用的核酸适配体在相同条件下反应,并检测它们的荧光信号变化值。实验测得dsDNA的起始荧光强度为481。通过4组不同浓度NTP分子检测结果的对比,随着浓度的变化,对照组CTP、GTP、UTP的荧光信号有缓慢上升的趋势,但变化不明显。这是因为CTP、GTP、UTP在结构上与ATP存在一定的相似性,能与ATP适配体存在一定程度的结合,因而释放出少量的染料,使荧光信号出现少量变化。而在实验组随着ATP浓度的减小,荧光强度有明显增大,也就是说随着ATP浓度的减小,荧光信号变化值也变小。以上结果说明本实验建立的荧光传感技术对于ATP分子检测具有较高的特异性,见图5。

图5 ATP特异性检测折线图
3 讨论
本研究基于核酸适配体-ATP复合物与绿色荧光染料Eva GreenTM作用,建立了荧光信号检测技术的新方法。
本研究优化了核酸适配体与ATP结合反应的实验条件。实验结果可知,核酸适配体与ATP反应的最适温度为12℃;pH值为7.5时,荧光检测结果最灵敏;在最优化的实验条件下,随着ATP浓度的减小,所测得的荧光信号与空白对照的变化值变小,当 ATP 浓度从 10-6mol/L 到 10-2mol/L 变化,对应的荧光强度随着浓度的减小而增大,呈现一定的线性关系。因此可作为该范围浓度的ATP检测新方法。体系还对该方法的特异性作出了探讨,采用与ATP同类型分子CTP、GTP、UTP作为对照,根据检测出的结果证实该核酸适配体对与ATP分子的检测具有较强的特异性。
本研究所建立的基于核基于核酸适配体-ATP特异识别的荧光传感技术,对于ATP分子的检测相较于其他的检测方法,不仅反应体系特异性高,并且实验操作简单,耗时少,成本低。可见,本研究为之后的分子识别检测提供了更为坚实的基础。
[1] Bell PD,Komlosi P,Zhang ZR. ATP as a mediator of macula densa cell signalling[J].Purinergic Signal,2009,5(4):461-471.
[2]Minikh O,Tolba M,Brovko LY,Griffiths MW.Bacteriophagebased biosorbents coupled with bioluminescent ATP assay for rapid concentration and detection of Escherichia coli[J].J Microbiol Methods,2010,82(2):177-183.
[3]Li W,Nie Z,Xu X,Shen Q,Deng C,Chen J,Yao S.A sensitive,label free electrochemical aptasensor for ATP detection[J].Talanta,2009,78(3):954-958.
[4]Huizenga D E and Szostak J W.A DNA aptamer that binds adenosine and ATP[J].Biochemistry,1995,(34):656-665.
[5]Huang H,Tan Y,Shi J,Liang G,Zhu JJ.DNA aptasensor for the detection of ATP based on quantum dots electrochemiluminescence[J].Nanoscale,2010,2(4):606-612.
[6]Liu G,Mao X,Phillips JA,Xu H,Tan W,Zeng L.,Aptamernanoparticle strip biosensor for sensitive detection of cancer cells[J].Anal Chem,2009,81(24):10013-10018.
[7] Xie S, Walton SP.Development of a dual-aptamerbased multiplex protein biosensor[J].Biosens Bioelectron,2010,25(12):2663-2668.
[8]Zhang Chen, Guang L,Le Deng.new method for the detection of ATP using quantum-dot-tagged aptamer[J].Analytical and Bioanalytical Chemistry,2008,392(6):1185-1188.
[9]孙 波,杨 娜,杨玉华.高灵敏适配体电化学发光生物传感器检测血样中的 ATP[J].分析化学,2009,(37),256.
[10]Chen Y,Wu Y,Wang J,Xu B,Zhong Z,Xia J.Identification ofcervidae DNA in feedstuff using a real-time polymerase chain reaction method with the new fluorescence intercalating dye EvaGreen[J].J AOAC Int.,2009,92(1):175-180.
[11]Qian Z,Lin J,Qian J,Yao D,Wang Y,Han L,Zhu Z,Xiao G.Quantification of GRAF gene expression in patients with acute myeloid leukemia using EvaGreen real time quantitative PCR[J].zhonghua Yi Xue Yi Chuan Xue Za Zhi,2010,27(3):290-293.
[12]Ihrig J,Lill R,Mühlenhoff U.Application of the DNA-specific dye EvaGreen for the routine quantification of DNA in microplates[J].Anal Biochem,2006,359(2):265-267.
Study of rapid detecting ATP based on aptamer and DNA-specific dye EvaGreenTM
CHEN Ling-li,LI Jie,HE Qi-zhi,CHEN Hui,MAO Ping-dao1,DENG Le
(College of Life Science,Hunan Normal University,Changsha,Hunan 410081,China)
Aptamer;Eva GreenTM;ATP;detection
Q-331
B
10.3969/j.issn.1674-070X.2011.05.002.006.04
〔Absrract〕Objective To develop a simple,efficient fluorescence detection technology for ATP.Methods The DNA-intercalating dye Eva GreenTMaptamer-ATP complex was used to detect quickly ATP.The effects of temperature,concentration,pH and reaction time were studied.Results The reacting system was that the best temperature and pH were 12℃and pH7.5,The ATP at limitation 10~6moL/L was detected with optimized conditions.Conclusion This research provides a kind of easy operation and low cost method for ATP rapid detection.
2011-01-06
国家科技部863计划资助项目(2007AA062Z403)。
陈伶利(1979-),女,湖南株洲人,博士,主要从事病原微生物检测技术研究。
*邓 乐,男,教授,博士研究生导师,E-mail:dengle@hunnu.edu.cn。
(本文编辑 彭芝配)

