嗜热四膜虫腺苷三磷酸结合盒转运蛋白ABCC10基因的可变剪切分析
陆星亦, 熊 杰, 袁冬霞, 缪 炜,*
(1. 中国科学院水生生物研究所 水生生物多样性与保护重点实验室, 湖北 武汉 430072; 2. 中国科学院研究生院, 北京 100049)
嗜热四膜虫腺苷三磷酸结合盒转运蛋白ABCC10基因的可变剪切分析
陆星亦1,2, 熊 杰1,2, 袁冬霞1, 缪 炜1,*
(1.中国科学院水生生物研究所 水生生物多样性与保护重点实验室,湖北 武汉430072; 2.中国科学院研究生院,北京100049)
哺乳动物中腺苷三磷酸结合盒转运蛋白(ATP-binding cassette transporter, ABCT)可通过可变剪切产生多种转录本, 其中含有提前终止密码子(premature terminal codon, PTC)的转录本还可与无义介导的mRNA降解通路(nonsense-mediated mRNA decay, NMD)作用来调节蛋白的相关功能, 但这些现象尚未在低等生物的ABCT研究中发现。该文以单细胞原生动物——嗜热四膜虫为对象, 利用转录组数据发现ABCC10基因存在可变剪切, 并产生两条转录本(SV1和SV2), 其中SV2在第五个内含子处发生内含子保留事件, 这段长49 bp的序列使SV2发生移码并产生PTC。在构建NMD通路中关键因子UPF1基因的嗜热四膜虫敲降株的基础上, 利用实时荧光定量PCR方法检测SV2的转录情况。结果显示:含有PTC的转录本SV2在UPF1敲降株中的转录水平相对于野生型显著增加, 说明SV2可被NMD通路降解。这与高等动物中某些ABCC蛋白通过可变剪切引入含PTC转录本, 并能被NMD降解的方式一致, 推测该方式在真核生物中十分保守, 并在真核生物的共同祖先(the last eukaryotic common ancestor)中就已形成。
嗜热四膜虫; ABC转运蛋白; 可变剪切; 实时荧光定量PCR; NMD
腺苷三磷酸结合盒转运蛋白(ATP-binding cassette transporter, ABCT) 家族是一类跨膜转运蛋白,以主动转运方式完成多种分子的跨膜转运(Higgins, 1992),其核心结构通常包括两个高度疏水的跨膜结构域(transmembrane domain, TMD)和两个核苷结合结构域(nucleotide binding domain, NBD)。在行使功能的时候, TMD一般形成跨膜通道供底物分子运输, 有时也参与底物识别过程; 而NBD则负责结合并水解ATP来提供能量(Hollenstein et al, 2007)。这类蛋白广泛存在于真核和原核生物中, 参与生物体的各种生理功能, 如养分摄取、蛋白质外排以及细胞内的跨膜转运(Higgins, 1992)。关于人类ABCT蛋白的研究发现, 其主要功能集中在对多肽、胆固醇、甾醇、胆汁酸等物质的跨膜转运, 也有部分ABCT蛋白作为调控元件参与功能调控, 甚至与一些遗传性疾病有关, 如囊肿性纤维化、抗原呈递以及癌症的多药耐药性(Dean & Allikmets, 2001)。
基于结构域排列以及序列同源性, 真核生物中ABCT蛋白超家族分为7个家族, 从ABCA到ABCG(Dean et al, 2001)。其中, ABCC家族蛋白是一类与离子转运、毒素分泌以及信号转导相关的蛋白, 在细胞对有毒药物的防卫过程中起重要作用。以往的研究发现, 一些ABCC家族蛋白会发生可变剪切, 产生两种以上的转录本(Aherrahrou et al, 2008; Bera et al, 2002; Grant et al, 1997; Lamba et al, 2003; Stojic et al, 2007; Yabuuchi et al, 2001)。其中,人、猴子和小鼠等哺乳动物的ABCC4蛋白都具有可变剪切, 产生的转录本由于含有提前终止密码子(premature terminal codon, PTC)而被无义介导的mRNA降解机制(nonsense-mediated mRNA decay, NMD)降解, 并证明含有PTC的转录本与翻译有密切联系。尤其人和小鼠中发生可变剪切的序列高度相似, 提示这种可变剪切引入含PTC的转录本,并能被NMD降解的方式可能在哺乳动物发生分化前就已产生了(Lamba et al, 2003)。那么在低等生物中ABCC蛋白是否也存在这种机制,虽然已有大量有关ABCT蛋白的研究在细菌、单细胞真核生物和后生动物中展开, 然而在这些研究中均未见有关ABCT可变剪切的报道。
原生动物嗜热四膜虫(Tetrahymena thermophila)是一种单细胞真核模式生物, 之前的研究基于同源比对、系统发育分析以及内含子位置保守性分析,在嗜热四膜虫中鉴定出165个ABCT家族基因, 其中, 60个属于ABCC家族, 约占总数的36% (Xiong et al, 2010)。最近, 我们利用第二代高通量转录组测序技术完成了嗜热四膜虫多个生理/发育时期的转录组分析, 发现了超过1 200个基因存在可变剪切事件(Xiong et al, 2011), 其中有两个ABCC家族基因, 分别是ABCC10(基因ID:TTHERM_ 00320020)和ABCC49(基因ID:TTHERM_ 00630560)。本研究确认了ABCC10基因可由可变剪切产生两条不同的转录本,其中一条含有PTC。在此基础上, 通过考察含有PTC的转录本在野生型与UPF1基因敲降株中的转录情况, 证明了含PTC的转录本可被NMD通路降解, 进而推测这种通过可变剪切引入含PTC转录本,并能被NMD降解的方式在真核生物中十分保守, 在真核生物的共同祖先(the last eukaryotic common ancestor)中就已形成。
1 材料与方法
1.1 四膜虫的培养
嗜热四膜虫(Tetrahmena thermophila) CU428株系由美国罗切斯特大学Martin A. Gorovsky教授惠赠。四膜虫培养基组分:2% Proteose Peptone (Difco)、0.1% yeast extract (Oxide)、0.2%葡萄糖(国药集团)、0.003% Ferric citrate (Sigma), 溶于双蒸水,经103 kPa、120 ℃灭菌15 min后冷却至室温。取长势良好的对数生长期四膜虫,按最终密度3 125 cells/mL接种于100 mL培养基中, 置于30 ℃培养箱135 r/min培养。
1.2 总RNA提取与cDNA合成
取1.1中培养至对数生长期(3×105cells/mL)的嗜热四膜虫 3 mL至RNA酶灭活处理的EP管中,于4 500 r/min离心5 min, 富集细胞后尽快吸去上清; 马上加1 mL Trizol (Invitrogen, USA)裂解细胞,并混匀; 振荡30 s后静置10 min; 加200 μL氯仿,振荡40 s后静置15 min; 12 000 g, 4 ℃离心20 min;吸取上清至另一EP管中, 加入相同体积异丙醇;充分混匀后于−20 ℃冰箱过夜; 过夜后,于12 000 g,4 ℃离心15 min后去上清, 用 75%乙醇(用DEPC水配置)清洗RNA沉淀两次, 干燥后, 加50 μL DEPC水溶解总RNA; 总RNA浓度用微量分光光度计(Malcom,Japan)检测。
将总RNA用Dnase (Promega)消化处理, 随后用M-MLV reverse transcriptase RNase H+(TOYOBO)逆转录合成cDNA, 50 μL 反应体系中包括100 U酶, 5 pmol/L Random Primers (Promega), 反应步骤依照试剂说明书。
1.3 ABCC10可变剪切产生的不同转录本的鉴定
四膜虫转录组测序所得到的reads使用Tophat和Mummer 3.0软件比对至嗜热四膜虫大核基因组序列(从四膜虫基因组数据库下载, http://www. ciliate.org)。由于转录组测序使用mRNA所逆转录的cDNA进行测序, 因此, 如果一条read比对至基因组后中间具有gap, 并且其gap两端分别为GT和AG(经典的内含子剪接位), 那gap区域则为内含子。根据比对的结果, 鉴定得到嗜热四膜虫基因的转录区域及所有发生内含子剪切的位点。之后利用自制的脚本程序, 比较剪切位点以及转录区域,鉴定包括外显子跳跃、内含子保留、5'剪接位点选和3'剪接位点选择在内的四种选择性剪切类型(Xiong et al, 2011)。
根据ABCC10基因的转录区域, 利用脚本程序对ABCC10基因选择性剪接产生的两条转录本序列进行拼接。对拼接好的转录本序列, 首先使用MAFFT在线比对软件对进行比对, 确定发生选择性剪切的位点, 然后分别使用ORF finder工具进行翻译, 确定PTC位置。选择性剪切产生的转录本示意图采用Fancy Gene 1.4(http://host13.bioinfo3. ifom-ieo-campus. it/fancygene/)绘制。
1.4 UPF1基因敲降细胞株的构建(NMD通路的抑制)
本研究中, ABCC10通过可变剪切产生的转录本中有一条包含PTC, 这样的mRNA可能被NMD通路快速降解。结合Bruns等人建立的四膜虫大核染色体基因敲除方法(Bruns & Cassidy-Hanley, 2000)与GJ-1000高压气体基因枪(新芝科技有限公司)使用说明书, 针对NMD通路关键因子UPF1蛋白构建敲降株载体。首先, 分别将UPF1基因(基因ID:TTHERM_00726300)5'和3'端旁侧区片段(约800 bp)通过双酶切连接插入pNeo4载体(奥地利科学院分子技术研究所Mochizuki教授馈赠)(Mochizuki, 2008)中Neo4基因的两端(UPF1C和UPF1N方向保持一致), 构成新的载体pNeo4-UPF1N-UPF1C。然后,用双酶切的方法回收载体上连有旁侧区片段的Neo4, 以1 μg/μL 的浓度做成基因打靶子弹对四膜虫CU428株野生型进行基因枪转染。通过旁侧区同源重组, 在巴龙霉素浓度逐渐增加条件下,Neo4基因逐渐替换基因组上的UPF1基因座, 最终筛选得到四膜虫UPF1基因敲降细胞株。分别利用全细胞PCR以及实时荧光定量PCR证实片段已被插入以及UPF1基因表达水平下降(图1)。
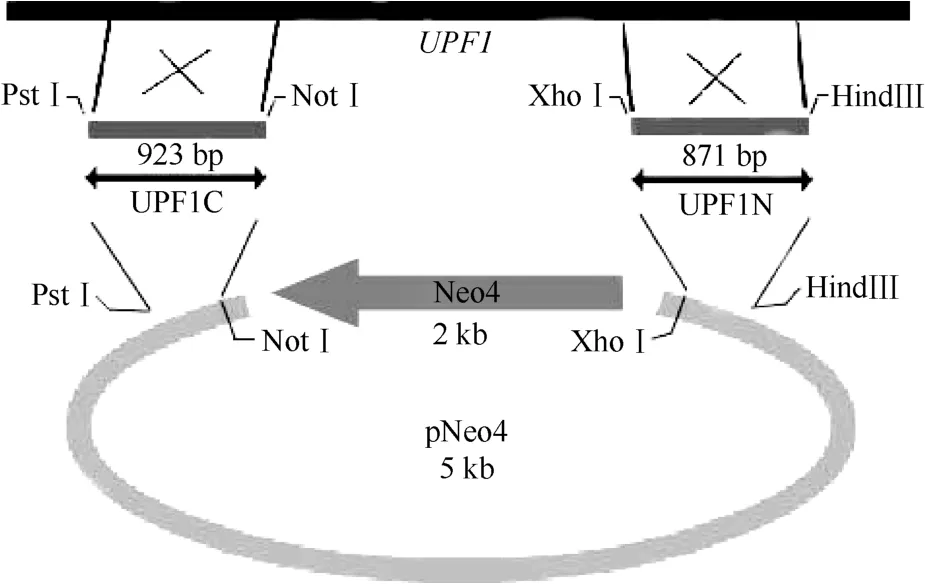
图1 嗜热四膜虫UPF1基因敲降株构建示意图Fig.1 Schematic drawing of knock-down cell line of UPF1 gene in Tetrahymena thermophila
1.5 实时荧光定量PCR检测UPF1以及ABCC10转录本的表达水平
PCR反应在BIORAD Opticon 2 型实时荧光定量PCR仪上进行。转录本的相对表达水平由分析工具Relative Expression Software Tool (REST) 软件经18S校正后进行分析。软件采用的数学模型是以样品与对照组间PCR扩增阈值循环数threshold cycle (Ct) 的差异关系为基础计算目的基因相对表达变化倍数, 再采用ANOVA检测结果的显著性,P<0.05有统计学意义(Pfaffl et al, 2002)。
为了证明ABCC10含有PTC的转录本SV2是否受NMD通路的降解, 分别以步骤1.2中合成的野生型和敲降株嗜热四膜虫的cDNA作为模板, 利用实时荧光定量PCR的方法检测SV2的转录水平。我们选择嗜热四膜虫18S核糖体RNA基因作为内参基因, 其正向引物序列为:5'-CCTGGGAAGG TACGGGTAAT-3', 反向引物序列为:5'-AAGGTT CACCAGACCATTCG-3'。在两条转录本共有的外显子区域设计正向引物F, 序列为:5'-TTCTGG TTTCATTATTAAGTTGCT-3', 在ABCC10_SV2第五个外显子发生内含子保留的位点设计反向引物SV2_R, 为了减少PCR时错配的发生和确保正确的延伸, 剪切接头位点左边占据13个碱基,右边占据12个碱基, 序列为:5'-AAAATAAGCATACCC TATAGCATAA-3'。另外, 为了校正因敲降基因产生的误差, 我们在未剪切的外显子上设计一条反向引物Total-R, 序列为:5'-AAAGGAAGATCATCATC AATAGAAT-3', 从而检测ABCC10基因所有mRNA的表达量(图2A,B)(所有引物序列使用Primer5软件设计)。Q-PCR反应体系:10 μL FastStart Universal SYBR Green Master mix (Roche), 0.4 μmol/L引物,加双蒸水配成20 μL。反应条件:94 ℃预变性5 min,中间40个循环94 ℃ 20 s, 55 ℃ 30 s, 72 ℃ 20 s, 75 ℃读板1 s, 接着72 ℃延伸10 min, 最后制作溶解曲线70~90℃, 以0.5 ℃/s速率读取数据。每个cDNA样品重复三个平行样。
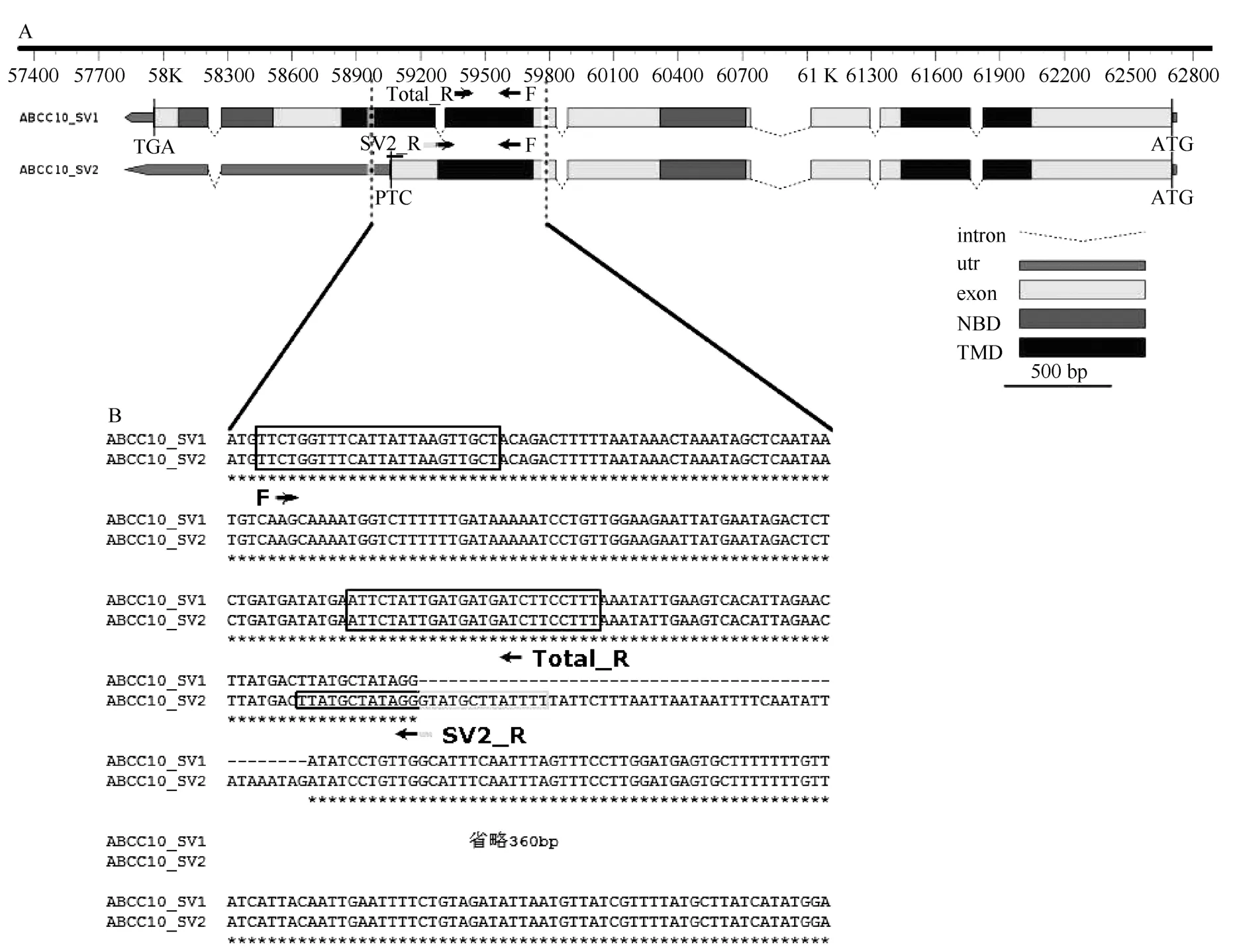
图2 ABCC10可变剪切产生的不同转录本的鉴定Fig.2 Identification of ABCC10 splice variants
2 结 果
2.1 ABCC10基因可变剪切产生的不同转录本的鉴定
根据嗜热四膜虫转录组数据, 鉴定得到ABCC10基因发生可变剪切事件, 并拼接出两条完整的转录本序列, 分别是ABCC10_SV1和ABCC10_SV2。使用MAFFT在线比对软件比对这两条转录本序列, 发现转录本SV2保留一段长49 bp的内含子序列。(图2B)
我们利用ORF Finder工具在线翻译这两条转录本序列, 发现转录本SV2由于选择性剪切保留一段内含子而产生PTC, 位于最后一个外显子联结点复合体(exon-junction complex, EJC)上游786 bp。通过NCBI BLASTP软件, 查看两条翻译出的蛋白序列产生的保守结构域。转录本SV2翻译产生的蛋白由于可变剪切, 比SV1的缺少C端的一个NBD, 而且破坏了第二个TMD的完整性。最后, 采用Fancy Gene 1.4 (http://host13.bioinfo3.ifom-ieo-campus.it/ fancygene/) 绘制选择性剪切产生的转录本示意图,发现在第五个内含子处发生内含子保留(图2A)。
2.2 转录本ABCC10_SV2被NMD通路降解
未成熟mRNA如果在其最后一个外显子联结点上游 50~55 bp前存在终止密码子则该RNA被认为存在PTC, 可能会被NMD通路的关键因子UPF1蛋白形成的复合体识别, 然后发生快速降解(Hentze & Kulozik, 1999)。根据2.1的ORF结果, 转录本SV2产生的PTC距离最后一个外显子-外显子联接点(exon-exon junction)有786碱基。因此,我们推测该转录本会被NMD通路降解。为了考察是否ABCC10的转录本SV2受NMD降解, 我们检测其转录水平在NMD被抑制后是否发生显著变化。
UPF1蛋白是NMD通路的关键因子, 通过敲降其表达水平可以抑制NMD通路的作用, 从而影响被其靶标的转录本(Mendell et al, 2002)。按照步骤1.4的方法筛选得到UPF1基因的敲降株四膜虫。按照步骤1.2的方法提取野生型和敲降株的cDNA。按照步骤1.5检测基因UPF1相对表达水平, 相对于野生型, 敲降株cDNA中的UPF1表达水平降低到20.7%, 说明得到了UPF1的敲降株(图3)。
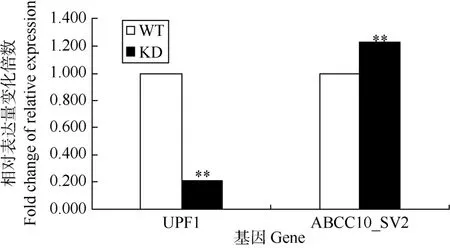
图3 UPF1和转录本SV2在四膜虫野生型和敲降细胞株中的表达变化Fig.3 Gene expression levels of UPF1 and transcript SV2 in wild-type and knock-down cell lines of Tetrahymena thermophila
由于UPF1基因表达水平发生下调, NMD机制产生的功能也随之减弱, 我们继续按照步骤1.5中检测转录本ABCC10_SV2的相对表达水平, 相对于野生型四膜虫CU428株,UPF1敲降株的cDNA中, 转录本SV2的表达水平升高了22.7%,说明该含有PTC的转录本SV2是NMD通路的靶标(图3)。
3 讨 论
可变剪切一直被认为是产生多样化蛋白的重要机制, 但近年来越来越多的研究发现, 它和功能调控有着密不可分的关系, 有的蛋白可以通过可变剪切移去与其他蛋白相互作用的保守域来改变自身的功能, 也有的蛋白通过可变剪切导致阅读框发生移码, 产生PTC后被NMD通路降解, 从而实现对表达的调节(Lareau et al, 2004)。在高等动物ABCC蛋白家族的研究中, 最早发现具有可变剪切事件的是人类的ABCC1蛋白, 其产生的三种转录本都保留原有的ORF(Grant et al, 1997)。之后, 在人体肝脏的cDNA克隆得到的ABCC11和ABCC12也存在可变剪切, 前者产生的转录本不包含PTC,后者产生的转录本拓扑结构相差很大且都包含PTC, 推测有不同的生物学功能(Bera et al, 2002; Yabuuchi et al, 2001)。在人类视网膜中作用的ABCC5蛋白也有三种由可变剪切产生的转录本,其中两种含有PTC (Stojic et al, 2007)。这些ABCC蛋白发生可变剪切后, 有的产生含有PTC的转录本,并被证实与NMD通路相关。尤其值得注意的是, 人体中的ABCC4具有泵出抗HIV药物的功能,如三氮基-胸苷-单磷酸盐、抗病毒核苷酸, 以及抗癌药物如硫代嘌呤, 其可变剪切产生多种含PTC的转录本,第一次证实ABCC蛋白具有调节自身功能的机制,并认为该机制从小鼠到人都十分保守, 提示该机制可能在哺乳动物分化前就已形成(Lamba et al, 2003)。
多细胞生物中, 很多研究已经发现可变剪切与NMD通路之间密切的联系(Lareau et al, 2007; Lewis et al, 2003)。但单细胞生物中的相关研究却很少, 尤其从未见有关ABCT可变剪切的研究报道。单细胞真核模式生物嗜热四膜虫具有清晰的遗传背景、完备的基因组及转录组数据库, 并可应用一系列成熟的遗传操作方法与技术, 为开展相关研究提供了机会。
在本研究中, 我们利用嗜热四膜虫转录组的数据发现了一个ABCT基因(ABCC10)通过可变剪切可产生两种转录本, 其中, 转录本ABCC10_SV2保留了第五个内含子, 并引入了PTC。由于PTC的引入, 该转录本产生的蛋白的保守域发生了改变:ABCC10的跨膜通道(TMD区域)发生了改变, 并且损失了一部分结合ATP的结构(NBD区域)。为了进一步了解ABCC10基因可变剪切是否与NMD通路有联系, 我们利用实时荧光定量PCR检测的方法,发现转录本ABCC10_SV2在NMD通路的功能被抑制的情况下, 转录水平升高了22.7%, 这说明NMD受到抑制后含PTC的SV2转录本降解程度显著降低, 证实了因内含子保留而引入PTC的SV2确实可被NMD通路降解, 这与之前高等动物中ABCC家族的某些蛋白的报道结果一致, 由此推测通过可变剪切引入含PTC的转录本,并被NMD降解的方式在真核生物中十分保守, 其在真核生物的共同祖先(the last eukaryotic common ancestor)中就已形成。这为利用模式生物嗜热四膜虫来进一步探寻可变剪切与NMD通路间偶联的作用机制及相关生物学意义提供了基础。
致谢:本实验所用嗜热四膜虫CU428株系由美国罗切斯特大学Martin A. Gorovsky教授惠赠, pNeo4载体由奥地利科学院分子技术研究所Mochizuki教授馈赠, 在此表示衷心感谢。
Aherrahrou Z, Doehring LC, Ehlers EM, Liptau H, Depping R, Linsel-Nitschke P, Kaczmarek PM, Erdmann J, Schunkert H. 2008. An alternative splice variant in Abcc6, the gene causing dystrophic calcification, leads to protein deficiency in C3H/He mice [J]. J Biol Chem,283(12): 7608-7615.
Bera TK, Iavarone C, Kumar V, Lee S, Lee B, Pastan I. 2002. MRP9, an unusual truncated member of the ABC transporter superfamily, is highly expressed in breast cancer [J]. Proc Natl Acad Sci USA,99(10): 6997-7002.
Bruns PJ, Cassidy-Hanley D. 2000. Biolistic transformation of macro- and micronuclei [J]. Methods Cell Biol,62: 501-512.
Dean M, Allikmets R. 2001. Complete characterization of the human ABC gene family [J]. J Bioenerg Biomembr,33(6): 475-479.
Dean M, Rzhetsky A, Allikmets R. 2001. The human ATP-binding cassette (ABC) transporter superfamily [J]. Genome Res,11(7): 1156-1166.
Grant CE, Kurz EU, Cole SPC, Deeley RG. 1997. Analysis of the intron-exon organization of the human multidrug-resistance protein gene (MRP) and alternative splicing of its mRNA [J]. Genomics,45(2): 368-378.
Hentze MW, Kulozik AE. 1999. A perfect message: RNA surveillance and nonsense-mediated decay [J]. Cell,96(3): 307-310.
Higgins CF. 1992. Abc Transporters - from Microorganisms to Man [J]. Annu Rev Cell Biol,8: 67-113.
Hollenstein K, Dawson RJP, Locher KP. 2007. Structure and mechanism of ABC transporter proteins [J]. Curr Opin Struct Biol,17(4): 412-418.
Lamba JK, Adachi M, Sun DX, Tammur J, Schuetz EG, Allikmets R, Schuetz JD. 2003. Nonsense mediated decay downregulates conserved alternatively spliced ABCC4 transcripts bearing nonsense codons [J]. Human Mol Genet,12(2): 99-109.
Lareau LF, Green RE, Bhatnagar RS, Brenner SE. 2004. The evolving rolesof alternative splicing [J]. Curr Opin Struct Biol,14(3): 273-282.
Lareau LF, Inada M, Green RE, Wengrod JC, Brenner SE. 2007. Unproductive splicing of SR genes associated with highly conserved and ultraconserved DNA elements [J]. Nature,446(7138): 926-929.
Lewis BP, Green RE, Brenner SE. 2003. Evidence for the widespread coupling of alternative splicing and nonsense-mediated mRNA decay in humans [J]. Proc Natl Acad Sci USA,100(1): 189-192.
Mendell JT, ap Rhys CMJ, Dietz HC. 2002. Separable roles for rent1/hUpf1 in altered splicing and decay of nonsense transcripts [J]. Science,298(5592): 419-422.
Mochizuki K. 2008. High efficiency transformation of Tetrahymena using a codon-optimized neomycin resistance gene [J]. Gene,425(1-2): 79-83. Pfaffl MW, Horgan GW, Dempfle L. 2002. Relative expression software tool (REST©) for group-wise comparison and statistical analysis of relative expression results in real-time PCR [J]. Nucleic Acids Res,30(9): e36
Stojic J, Stohr H, Weber BHF. 2007. Three novel ABCC5 splice variants in human retina and their role as regulators of ABCC5 gene expression [J]. BMC Mol Biol,8: 42.
Xiong J, Feng LF, Yuan DX, Fu CJ, Miao W. 2010. Genome-wide identification and evolution of ATP-binding cassette transporters in the ciliate Tetrahymena thermophila: A case of functional divergence in a multigene family [J]. BMC Evol Biol,10: 330.
Xiong J, Lu XY, Zhou ZM, Chang Y, Yuan DX, Tian M, Zhou ZG, Wang L, Fu CJ, Orias E, Miao W. 2011. Transcriptome analysis of the model protozoan, Tetrahymena thermophila, using deep RNA sequencing [J]. PloS One (in press).
Yabuuchi H, Shimizu H, Takayanagi S, Ishikawa T. 2001. Multiple splicing variants of two new human ATP-binding cassette transporters, ABCC11 and ABCC12 [J]. Biochem Biophys Res Commun,288(4): 933-939.
Alternative splicing of an ATP-binding cassette transporterABCC10inTetrahymena thermophila
LU Xing-Yi1,2, XIONG Jie1,2, YUAN Dong-Xia1, MIAO Wei1,*
(1. State Key Laboratory of Freshwater Ecology and Biotechnology, Institute of Hydrobiology, the Chinese Academy of Science, Wuhan 430072, China;
2. Graduate School of the Chinese Academy of Sciences, Beijing 430072, China)
ATP-binding cassette transporters (ABCT) could generate multiple transcripts through alternative splicing (AS) in mammalian. Some AS introduced PTC (premature terminal codon)-containing isoforms of ABCT couple with NMD (nonsense-mediated mRNA decay) to regulate relevant functions. However, there are no similar reports in lower organisms. This paper focuses on the unicellular protozoaTetrahymena thermophila, based on the RNA-seq data ofTetrahymena thermophila, identified two alternative splicing variants of geneABCC10(SV1 and SV2).The SV2 contained an intron retention event at the fifth intron, and this 49 bp intron resulted in shift-frame and introduced PTC. Then, a knock-downTetrahymenastrain of geneUPF1which is a key factor of NMD was constructed, and the expression levels of SV2 were performed using a real-time quantitative PCR. The results showed the expression levels of SV2 were up-regulated significantly in knock-down strain, indicating that SV2 was targeted by NMD, which is consistent to the mechanism which the AS introduced PTC-containing isoforms of ABCC proteins can be targeted by NMD in mammalian. Thus, we infer that this mechanism is highly evolutionary conserved in eukaryotes and was already functional in the last eukaryotic common ancestor.
Tetrahymena thermophila; ABC transporter; Alternative splicing; Real-time quantitative PCR; NMD
Q959.117; Q513
A
0254-5853-(2011)06-0605-06
10.3724/SP.J.1141.2011.06605
2011-10-24;接受日期:2011-11-14
武汉市学科带头人项目(201051730561)
∗通讯作者(Corresponding author),E-mail: miaowei@ihb.ac.cn; miaowei530@yeah.net
- Zoological Research的其它文章
- A phylogeny of the Tylototriton asperrimus group (Caudata: Salamandridae) based on a mitochondrial study: suggestions for a taxonomic revision
- 体细胞核移植生产绵羊转hALR基因囊胚
- 上海市南汇东滩围垦后海岸带湿地冬春季水鸟生境选择
- 杭州湾及钱塘江河口水鸟群落组成、季节动态及种间相关性分析
- 云南新平哀牢山西黑冠长臂猿分布与群体数量
- Histological and immunocytochemical study of deferens ducts in the Chinese rat snake (Zaocys dhumnades)

