SO2胁迫对大叶黄杨和贴梗海棠膜脂过氧化及保护酶的影响
何 瑞,徐玉梅
(山西农业大学信息学院,山西太谷030801)
SO2是我国当前主要的大气污染物,其主要来源于煤、石油等天然气的燃烧及含硫矿物的冶炼等。随世界对能源及自然资源需求的不断增加,SO2对生物和环境造成的危害日趋严重。近年来,SO2对植物的危害逐年增加,主要对植物细胞产生氧化伤害,而膜脂过氧化(lipid peroxidation,LP)被认为是测定氧化伤害程度的可靠指标[1]。
植物体内的抗氧化系统是决定植物细胞对SO2胁迫抗性的关键因素,超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)是抗氧化系统中重要的保护酶,这些抗氧化酶能清除机体内的活性氧,有利于植物维持体内活性氧产生与猝灭的动态平衡,从而阻止膜脂过氧化的进程,减轻其对细胞的伤害[2]。
近年来,国内外关于SO2对植物生理生化影响的报道很多[3],但对园林绿化树种的研究相对较少。在研究SO2对园林植物敏感性研究的基础上,确定了大叶黄杨为抗性树种,贴梗海棠为敏感树种[4]。本试验主要对在不同的SO2胁迫浓度和持续时间条件下,大叶黄杨和贴梗海棠的SOD,POD,CAT 等保护酶活性以及膜质过氧化产物MDA 含量、质膜透性的变化进行了测定[5-6],研究这些指标的动态变化及其对SO2抗性的相互联系,旨在为探讨这些指标作为评价树种对SO2抗性的可行性提供理论依据。
1 材料和方法
1.1 试验材料
贴梗海棠和大叶黄杨均采自山西农业大学校园。选取生长势均匀一致、无病虫斑的树种,剪下20 cm 长的枝条,经适当疏剪后,立即插入盛有knop 营养液的三角瓶中待用。
1.2 SO2 熏气处理方法
在体积为0.474 m3密闭容器中,用0.10,0.50,1.00 mg/L 3 个SO2质量浓度对2 种植物进行4 h熏气处理。每个处理3 次重复,对照放入同样条件而无SO2的熏气装置中。分别在熏气结束后0,20,30,44,54 h 采样测定其生理生化指标。
1.3 生理生化指标测定方法
超氧化物阴离子自由基(O2-)测定参照王爱国等[7]的方法进行;细胞膜透性的测定采用电导仪法;MDA 含量的测定采用硫代巴比妥酸比色法;SOD 酶活性的测定采用NBT 光还原法;POD酶活性测定采用愈创木酚法[8];CAT 酶活性测定采用高锰酸钾滴定法[9]。
2 结果与分析
2.1 SO2 对O2-产生速率的影响
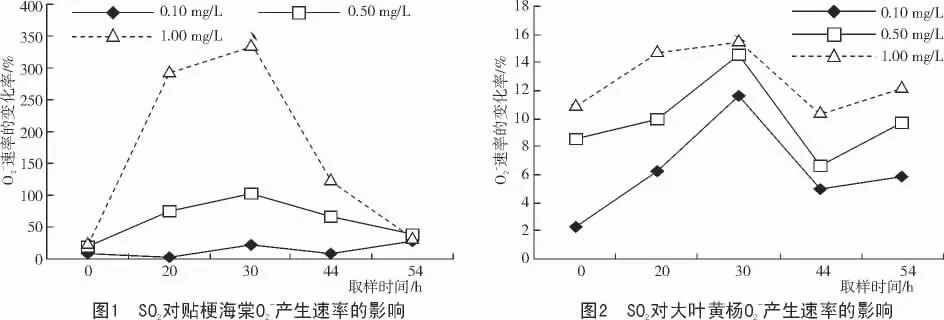
试验结果(图1,2)表明,经过0.10,0.50 和1.00 mg/L 的SO2处理4 h 后,贴梗海棠和大叶黄杨的O2-产生速率均增加,贴梗海棠O2-产生速率的增加比率远大于大叶黄杨,且随SO2质量浓度的增加,O2-产生速率的增加比率呈增加趋势。在处理初期,2 种植物的O2-产生速率都急剧增加,即产生了氧爆现象;贴梗海棠的O2-产生速率在后期下降;大叶黄杨中的O2-产生速率在中期略有下降,后期又略有回升,出现了双峰现象。
2.2 SO2 对细胞膜相对透性的影响
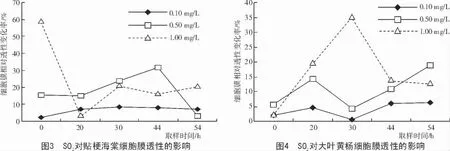
试验结果(图3,4)表明,贴梗海棠和大叶黄杨经SO2处理后,2 种植物的细胞膜透性均增加,而且贴梗海棠细胞膜相对透性增加比率大于大叶黄杨。不同质量浓度的SO2处理对叶片细胞膜相对透性的增加比率不同,基本上细胞膜相对透性的增加比率随SO2质量浓度的增加呈上升趋势。0.10,0.50,1.00 mg/L 这3 种质量浓度对大叶黄杨处理4 h 后细胞膜相对透性的增加比率依次为3.944%,10.772%和16.811%。3 种质量浓度处理贴梗海棠后,其细胞膜相对透性的增加比率依次为6.475%,17.818%和24.086%。
2.3 SO2 对叶片MDA 含量的影响
试验结果(图5,6)表明,贴梗海棠和大叶黄杨,经SO2处理4 h 后,叶片的MDA 含量均比对照增加,且贴梗海棠的MDA 含量的增加比率大于大叶黄杨。分析不同质量浓度SO2对植物的影响可看出,无论是贴梗海棠还是大叶黄杨,MDA含量的增加比率均随SO2质量浓度的增加呈升高趋势。这表明贴梗海棠和大叶黄杨在SO2胁迫时产生了膜脂过氧化作用,贴梗海棠及高质量浓度的SO2对植物脂质过氧化作用的程度更高。

2.4 SO2 对保护酶活性的影响
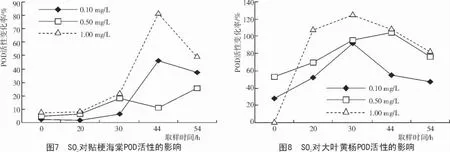
试验结果(图7,8)表明,贴梗海棠和大叶黄杨经SO2处理4 h 后,叶片体内的POD 活性均上升,抗性植物大叶黄杨增加比率较敏感植物贴梗海棠大。脱离处理后,POD 活性均出现一个应激上升的过程,随后下降,但是抗性植物大叶黄杨出现应激的时间要比贴梗海棠早。
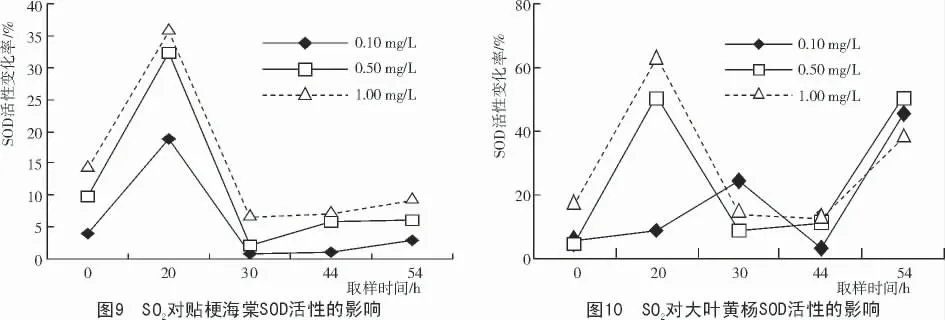
试验结果(图9,10)表明,贴梗海棠和大叶黄杨经SO2处理4 h 后,叶片内的SOD 活性均升高,但是大叶黄杨的增加比率比贴梗海棠大。随SO2质量浓度的增加,SOD 活性的增减比率增加;用0.1,0.5,1.0 mg/L SO2处理后,大叶黄杨SOD 增加比率依次为17.620%,25.303%,30.392%;贴梗海棠SOD 的增加比率依次为5.515%,11.184%和14.858%。2 种植物在处理后20 h,SOD 活性均出现一个增加峰值,其中,敏感植物贴梗海棠的SOD 活性的增幅在后期下降。而抗性植物大叶黄杨的SOD 活性在后期则呈上升趋势。
试验表明(图11,12),贴梗海棠和大叶黄杨经SO2处理4 h 后,叶片体内的CAT 活性均下降,且贴梗海棠的下降幅度大于大叶黄杨。CAT 活性的下降比率随SO2质量浓度的增加而增加。

3 结论与讨论
植物在逆境条件下会产生大量的活性氧(O2-,H2O2,·OH 和1O2等),体内POD,SOD 等保护酶难以清除,从而使植物细胞内膜发生过氧化作用或脱脂作用,使质膜受到损害,透性改变,损伤膜系统,植物受到伤害[10-12]。丙二醛(MDA)是细胞内膜脂过氧化或脱脂的产物,会严重损伤细胞的生物膜,降低膜中不饱和脂肪酸的含量,使膜的流动性降低。质膜是细胞与环境之间物质交换的界面,它能调节和控制细胞内外物质的运输和交换。当植物处于逆境胁迫时,其选择透过机能受损,透性增大,使细胞内一些可溶性物质外渗,破坏了酶及代谢作用原有的区域性,这是植物受害的原因之一。MDA 含量和细胞膜相对透性是反映细胞质膜透性的2 个重要生理指标[13]。
本试验结果表明,SO2处理使贴梗海棠和大叶黄杨产生O2-的速率、MDA 含量和细胞膜相对透性均增加,而且贴梗海棠的增加比率比大叶黄杨大,这可能与大叶黄杨对SO2的抗性强有关。随SO2质量浓度的增加,这3 个指标的增加比率均呈升高趋势。说明用这3 个指标作为监测SO2污染程度具有一定的实际意义。
自由基伤害学说[14-15]认为,在正常情况下,植物细胞中存在着活性氧的产生和清除2 个过程。逆境胁迫会促进活性氧产生,损伤膜系统[10]。有些酶如超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)等可清除活性氧自由基,从而防止自由基的毒害,为此将它们称为保护酶系统[16]。作为酶系统的重要组成成分,硫过多会直接或间接地对自由基清除系统酶的活性产生影响;又由于硫参与作物的呼吸作用和光合作用的电子传递以及次生代谢物的产生等过程,其含量的增减必然会影响到植物体内活性氧的产生和清除[17]。超氧化物歧化酶(SOD)是一种重要的自由基清除酶。一些学者认为,SOD 同植物的抗污性密切相关,SOD 含量高的叶片,抗性强,较晚出现伤害症状[18-19]。
本研究结果表明,经SO2处理后,贴梗海棠和大叶黄杨的SOD 和POD 活性均上升,抗性植物大叶黄杨的增加比率大于敏感植物贴梗海棠,随SO2质量浓度的增加,SOD 和POD 活性的增加比率升高。脱离处理后,POD 活性均出现一个应激上升的过程,随后下降,抗性植物大叶黄杨出现应激反应早于贴梗海棠。SOD 作为主要的抗氧化酶之一,在保护细胞膜免受氧化损伤中具有特殊重要的意义,在SO2胁迫下,O2-产生速率增加,SOD 酶活性升高,使植物体内活性氧的清除达到平衡,从而防止活性氧的积累对细胞膜造成的损伤。贴梗海棠和大叶黄杨经SO2处理后,CAT 活性下降,且随SO2质量浓度的增加下降比率增加。
[1] Jita P. Comparison of biochemical responses to oxidative and metal stress in Seedlings of barieyⅡ,Hordeumvulgate L[J].Environmental Pollution,1998,101:99-105.
[2]邹志荣,陆帼一.低温对辣椒幼苗膜质过氧化和保护酶系统变化的影响[J].西北农业学报,1994,3(3):51-56.
[3]黄芳,王建明,徐玉梅.SO2对不同抗性植物几种酶活性的影响[J].山西农业科学,2005,33(3):26-28.
[4]徐玉梅,王建明,高俊明,等.42 种园林植物对SO2敏感性研究[J].山西农业大学学报,2006,26(1):32-35.
[5]胡丁猛,孙明高,王太明,等.SO2对三种园林绿化苗木叶片膜脂过氧化和保护酶的影响[J].山东农业大学学报:自然科学版,2005,36(2):175-180.
[6]邹晓燕,刘厚田,柳若安.植物对二氧化硫的敏感性与超氧化物歧化酶活性的关系[J]. 中国环境科学,1989,9(6):427-432.
[7]王爱国,罗广华.植物的超氧自由基与羟胺反应的定量反应[J].植物生理学通讯,1990,26(6):55-57.
[8]邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000.
[9]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[10]陈少裕.膜脂过氧化对植物细胞的伤害[J].植物生理学通讯,1991,27(2):84-90.
[11]冯绪猛,罗时石,胡建伟,等.农药对水稻叶片丙二醛及叶绿素含量的影响[J].核农学报,2003,17(6):481-484.
[12]胡蕾,施益华,刘鹏,等.锰对大豆膜脂过氧化及POD 和CAT 活性的影响研究[J]. 金华职业技术学报,2003(1):29-32.
[13]任安之,高玉葆,刘爽.铬、镉、铅胁迫对青菜叶片几种生理生化指标的影响[J]. 应用与环境生物学报,2000,6(2):112-116.
[14] Mccord J M,Fridovich J. Superoxide dismutase: an enzymic function for erythrocuprein (Hemocaprein)[J]. Biol Chem,1969,224:6049-6055.
[15]Frdovich I,Handler P. Detection of free radical in illuminated dye solutions by initiation of sulfite oxidation [J].J Biol Chem,1960,235:1835-1838.
[16] Fridovich I. The biology of oxygen radical [J]. Science,1975,201:875-880.
[17]张秋芳,黄跃东,林真.缺硫胁迫对水稻膜脂过氧化及保护酶系统活性的影响[J].上海交通大学学报:农业科学版,2003,21(1):25-33.
[18]郑美珠,陈冬基.树木吸收二氧化硫的研究[J].浙江林学院学报,1985,2(1):21-27.
[19]Lee E H,Berrett J H.Superoxide dismutase [J].Plant Physiol,1982,69:1444-1449.

