纳膜过滤在提取红枣环磷酸腺苷(cAMP)中的应用*
王春霞,路福平,刘逸寒,杜连祥,李明润
1(工业微生物教育部重点实验室,天津科技大学生物工程学院,天津,300457)2(天津市医药科学研究所,天津,300020)
纳膜过滤在提取红枣环磷酸腺苷(cAMP)中的应用*
王春霞1,路福平1,刘逸寒1,杜连祥1,李明润2
1(工业微生物教育部重点实验室,天津科技大学生物工程学院,天津,300457)2(天津市医药科学研究所,天津,300020)
红 枣经过浸泡、打浆、酶解、压滤、树脂吸附、甲酸洗脱后,采用150 nm纳滤膜在压差为0.5~1 MPa下过滤,结果表明:纳滤截留组分经过紫外扫描在波长258 nm处峰值与环磷酸腺苷(cAMP)标准品相同,而纳滤液组分(弃去液)在波长258 nm处无峰;又经过HPLC检测纳滤截留组分与环磷酸腺苷(cAMP)标准品出峰时间相同,而纳滤液组分(弃去液)在此时间处无峰。表明纳滤截留目标产物环磷酸腺苷(cAMP)效果明显,分离了大分子组分及小分子组分,纳滤后利于浓缩、纯化得到环磷酸腺苷(cAMP)成品。
纳 膜过滤,截留组分,红枣,环磷酸腺苷,浓缩
纳膜过滤(nanofiltration,简称“纳滤”NF)技术是介于传统分离范围的超滤和反渗透之间的一种新型分子级膜分离技术。纳滤膜截留的相对分子质量约为200~1 000,可以同时进行脱盐和浓缩并具有相当快的处理速度[1-4]。本文采用经过纳膜过滤分离工艺处理后的红枣汁中大分子组分及小分子组分,被截留组分即为目标产物环磷酸腺苷(cAMP)及部分其他组分,使之达到浓缩的目的。再经结晶、纯化后为环磷酸腺苷(cAMP)纯品。
枣属药食同源植物。红枣中环磷酸腺苷(cAMP)含量为100~600 nmol/g(3.29~19.74 mg/100 g),在180多种天然植物中,红枣中的含量最高[5-6];环磷酸腺苷(cAMP)由腺嘌呤、核糖和磷酸组成,其分子中磷酸基与核糖的3’和5’位2个羟基构成两个酯键的环状结构,分子质量为329.21;环磷酸腺苷(cAMP)作为某些激素的第二信使激活心肌细胞内依赖cAMP的蛋白激酶,使底物蛋白磷酸化,对于治疗心血管疾病具有不可替代的作用,cAMP具有多种生理功能和药理作用[5],因此探索分离和纯化的手段、降低能耗,最大限度地提取红枣中的有效成分cAMP并实现工业化生产具有很大的实用价值。
1 材料与方法
1.1 材料
红枣:挑选无霉变、无虫害的天津产地红枣。
环磷酸腺苷(cAMP)标准品:德国BM公司。
205×7强碱性阴离子交换树脂(80~100目):南开大学化工厂。硅胶板GF254:青岛海洋化工厂分厂(规格:50 mm×100 mm)。
1.2 设备
小型膜分离设备(S500),不锈钢管式膜(20/150 nm),上海凯能高科技工程有限公司;10L不锈钢浸提灌(DC-TQ-10),上海达程实验设备有限公司;小型立式打浆机(TL130),保定前进食品机械有限公司;10L板式过滤机(DO-2),天津市东丽区通达滤材器厂;高效液相色谱仪(Agilent 1100),美国Agilent公司;色谱柱 TC-C18,(4.6 mm ×250 mm,10 μm),美国安捷伦科技公司;紫外光谱UV-260,SHIMADZU(岛津),日本;紫外扫描仪(722E),上海第三分析仪器厂;10 L旋转蒸发仪(RE-5210A),上海亚荣生化仪器厂;离心喷雾干燥设备(ZPG-25)常州市尔诺干燥设备有限公司;玻璃层析柱(12 cm×120 cm)等。
1.3 方法
1.3.1 工艺流程

1.3.2 操作要点
(1)红枣清洗,将其室温浸泡(果水质量比=1∶4~6)12 h、蒸煮、打浆,达到浆核分离,取浆液。
(2)浆液转入浸提罐,加入果胶酶50~60℃、2~3 h酶解、板框过滤机压滤得到红枣汁,枣渣另用。
(3)将红枣汁转入搅拌罐中与活化后的阴离子树脂混合搅拌4~6 h,进行特异性吸附、结合,过滤后得到吸附了枣汁中环磷酸腺苷(cAMP)的树脂,用约树脂2~4倍体积量的水搅拌清洗树脂,洗去絮状物等杂质;
(4)将吸附后的树脂层析柱上样,用0.5 mol/L甲酸溶液洗脱,控制流速1.8~2.2 mL/min,此时被吸附在树脂上的目标产物随着甲酸洗脱液析出;并用紫外扫描仪随时检测,当洗脱液的波峰在256~258 nm处时,吸收峰﹤0.3时表明目标产物随着甲酸洗脱液从树脂上析出,可结束洗脱。
(5)甲酸洗脱液经纳膜过滤,控制流速30~35l/h,其压差为0.5~1 MPa,截留组分中为相对分子质量200~1 000含有目标产物环磷酸腺苷(cAMP)的浓缩液,滤出组分为大分子及水和甲酸等小分子组分,此为第一步浓缩。再回收纳滤后的甲酸重复使用。
(6)纳滤后截留的含有目标产物环磷酸腺苷(cAMP)等组分的浓缩液,再用旋转蒸发器进行第二步浓缩,浓缩至原甲酸洗脱液体积的1/10停止。浓缩液进行离心喷雾干燥,得到含量30%的cAMP粉末状粗品,可用于食品添加剂;再经过乙醇结晶、纯化后得到环磷酸腺苷(cAMP)成品,可用于医药原料。
1.3.3 检测方法
1.3.3.1 紫外扫描仪测定法(UV)[7]
由1.3.2(4)层析后的甲酸洗脱液或取样品3 mL在波长200~400 nm扫描,检测到样品在256~258 nm处与环磷酸腺苷(cAMP)标准品相似的峰。该方法应用于红枣cAMP提取过程中做定性分析的检测、树脂交换力测定以及测定样品cAMP含量。
1.3.3.2 薄层色谱法(TLC)[8]
GF254硅胶板点样,展开剂为V(苯)∶V(乙酸乙酯)∶ V(甲醇)=1∶1∶3,紫外灯254 nm检测。该方法应用于红枣cAMP提取后产品性能的定性检测。
1.3.3.3 高效液相色谱法(HPLC)[9-10]
色谱柱:TC-C18;流动相0.02 mol/L KH2PO4-甲醇(体积比80∶20);检测波长:258nm。
标准品溶液的制备:精密称取cAMP标准品10 mg,置于10 mL容量瓶中,加水定容,摇匀,作为储备液。使用时稀释成100 μg/mL溶液。
样品:自红枣中提取,进样量20 μL,流速为1.0 mL/min。
工作曲线:准确称量并配制 cAMP 12、36、60、84、108 μg/mL浓度溶液,制作工作曲线,得回归方程:Y=1.692 65e-5x+0;r=0.999 6,结果可见工作曲线的线性关系良好。
该方法应用于测定红枣cAMP在12~108 μg/mL内,呈非常好的线性关系,相关系数r=0.999 6。其他各项内容均符合要求,证明此方法稳定、可靠、准确、快速,可用于红枣提取cAMP含量的测定和成品cAMP纯度测定。
1.3.3.4 回收甲酸含量测定方法
红枣cAMP分离过程中,为了观察0.5 mol/L甲酸洗脱液经纳膜过滤后弃去的甲酸能否再利用,建立甲酸含量测定方法。
酸碱滴定法:取10 mL的0.5 mol/L甲酸对照品和待测定的回收甲酸溶液,分别加入带磨口塞的三角瓶中,各加2滴酚酞指示剂,用0.5 mol/L标准氢氧化钠溶液滴定至淡粉色,比较0.5 mol/L甲酸对照组和待测定的回收组滴定消耗NaOH mL数的差别,并作统计学处理。
2 结果与讨论
2.1 红枣(天津产地)cAMP含量测定
根据1.3.3.3所述的测定方法和红枣cAMP含量样品制备方法,测定原料红枣cAMP的含量,结果如表1。

表1 红枣cAMP含量测定结果
由表1可知原料红枣cAMP含量为10.88 mg/100 g,该值与文献报道[5]接近。
2.2 洗脱时间与目标产物环磷酸腺苷(cAMP)含量的关系
2.2.1 甲酸洗脱初始的目标产物环磷酸腺苷(cAMP)含量
将1.3.2(3)经0.5 mol/L甲酸洗脱,收集从树脂柱洗脱下来的流出液做紫外扫描检测,以观察红枣提取液中cAMP与树脂交换情况(如图2所示)。图1为cAMP标准品在波长200~400 nm紫外扫描图谱,图2为甲酸洗脱初始(约1 h)在波长200~400 nm紫外扫描图谱。
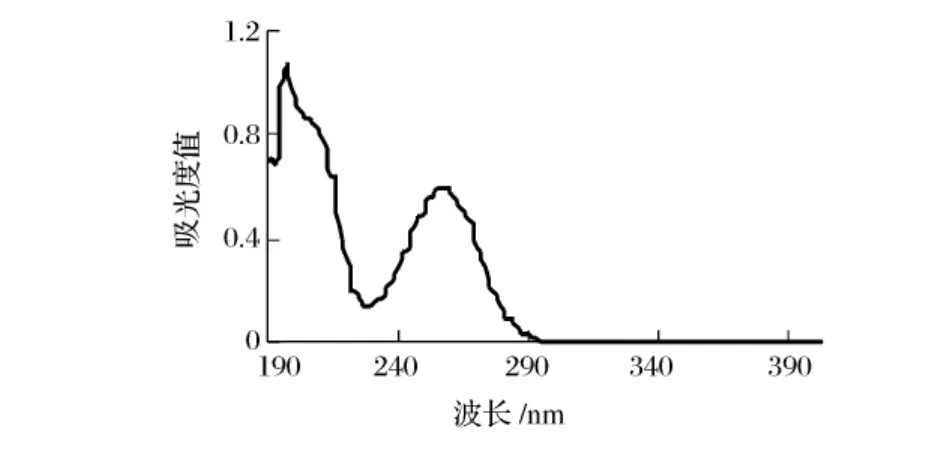
图1 cAMP标准品紫外扫描图谱
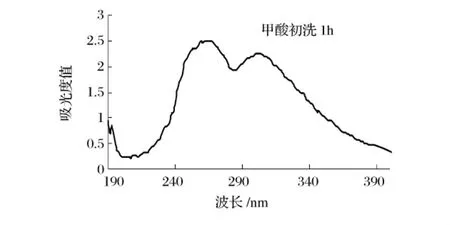
图2 甲酸初洗紫外扫描图谱
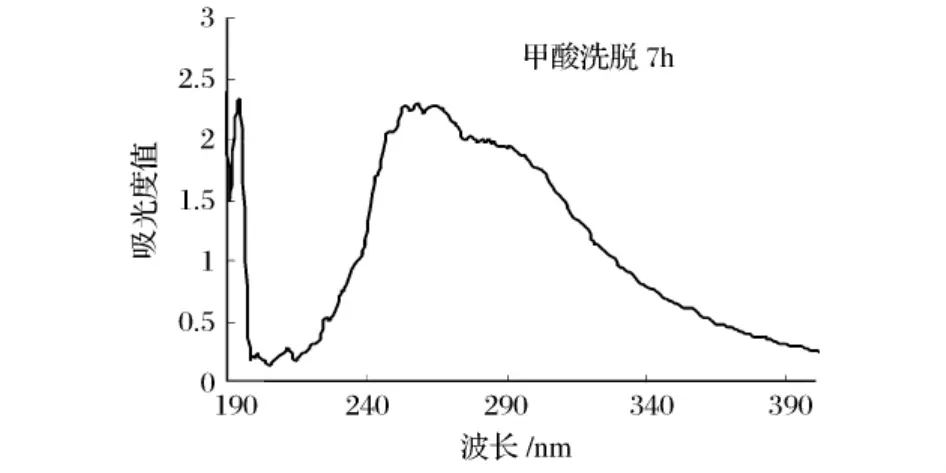
图3 甲酸洗脱7 h紫外扫描图谱
2.2.2 甲酸洗脱终点的目标产物环磷酸腺苷(cAMP)含量
甲酸继续洗脱,当杂峰<0.1时洗脱结束,图4所示。

图4 甲酸洗脱终点紫外扫描图谱
图4 结果可见,与图1的标准品比较,在波长256~258 nm处有吸收峰,具有相同的组分;波长在300 nm处已无吸收峰,表明红枣提取液中cAMP已充分与树脂交换,大约用时15~18 h。
2.3 纳滤膜分离对目标产物环磷酸腺苷(cAMP)含量的影响
红枣提取液中cAMP充分与树脂交换,收集了大量的甲酸洗脱液,为后续工艺带来了不便,因此选用纳滤膜进行浓缩,为洗脱液中目标产物环磷酸腺苷(cAMP)的提取节省了蒸发设备、降低了能耗,同时有利于进一步分离和纯化。
2.3.1 纳滤后目标产物环磷酸腺苷(cAMP)的UV结果
将1.3.2(4)加压通过150 nm纳膜过滤,分别收集截留浓缩液和纳滤液(弃去液),此时相对分子质量200~1 000的包括目标产物环磷酸腺苷(cAMP)的组分在浓缩液中,而小分子组分及大分子组分在纳滤液(弃去液)中。纳滤后做UV检测,分析纳滤膜分离截留的物质和弃去液的组分,对分离目标产物环磷酸腺苷(cAMP)含量的影响,结果如图5所示。
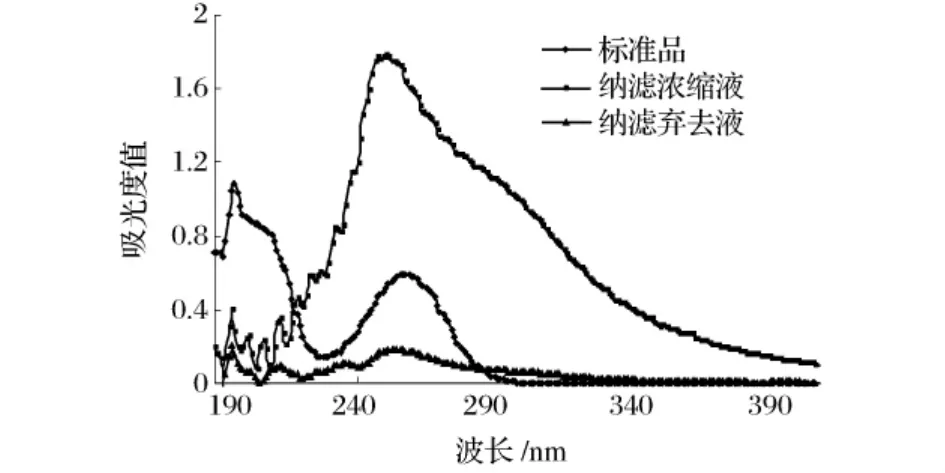
图5 纳滤截留前后料液的环磷酸腺苷(cAMP)与标准品比较UV检测图谱
由图5显示,纳滤截留浓缩液在258nm处峰型与环磷酸腺苷(cAMP)标准品相同,且含有高浓度的cAMP;纳滤液(弃去液)在258 nm处吸收峰较小,检测不出cAMP。表明纳滤截留目标产物环磷酸腺苷(cAMP)效果明显,利于cAMP分离和纯化。
2.3.2 纳滤后目标产物环磷酸腺苷(cAMP)的HPLC结果
根据2.3.1的方法,做纳滤后目标产物环磷酸腺苷(cAMP)的HPLC检测,分析纳滤膜分离截留的物质和弃去液的组分,对分离目标产物环磷酸腺苷(cAMP)含量的影响,如图6~图8所示。

图6 标准品环磷酸腺苷(cAMP)HPLC色谱图

图7 纳滤截留浓缩液中的环磷酸腺苷(cAMP)HPLC色谱图

图8 纳滤液(弃去液)中的环磷酸腺苷(cAMP)HPLC色谱图
图7 与图6对比结果显示,纳滤后截流组分出峰时间在5~5.1 min,表明与标准品为同一物质,又因截流液中包含目标产物环磷酸腺苷(cAMP)的相对分子质量200~1 000的组分,杂峰较多,需纯化;如图8与图6对比显示,纳滤液(弃去液)在5~5.1 min处已经无峰,表明没有与标准品相同的物质,纳滤液几乎不含cAMP;因此采用纳滤技术浓缩大量甲酸洗脱液,可缩短工艺周期、降低能耗,利于目标产物cAMP分离和纯化。
2.430 %cAMP样品检测结果
由1.3.2(6)得到的30% cAMP样品按照1.3.3.2、1.3.3.3的方法检测,结果如图9、图10所示。
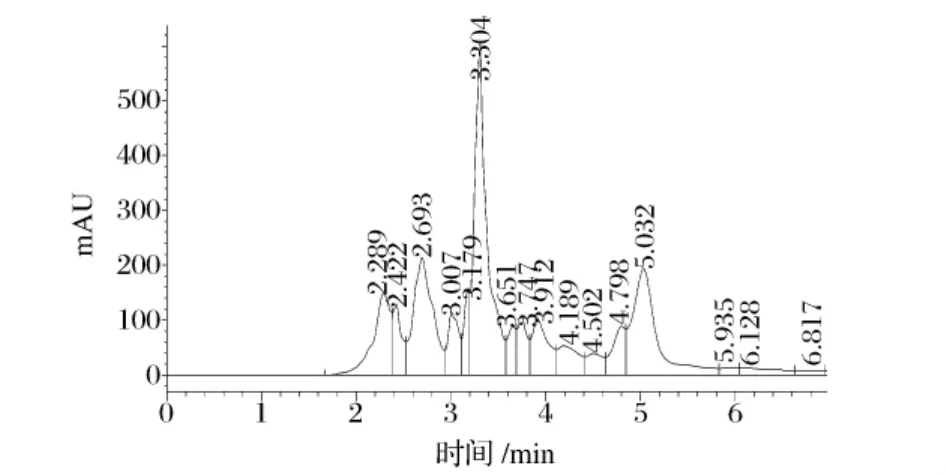
图930 %cAMP粗品的环磷酸腺苷(cAMP)HPLC色谱图

图10 30%环磷酸腺苷(cAMP)粗品的TLC图谱
图9 显示,离心喷雾干燥后得到的样品HPLC在5~5.1 min的吸收峰与图6完全相同;图10显示2样品与1 cAMP标准品的Rf值相近,表明粗品即是cAMP。
利用本工艺提取的cAMP粗品为无毒、天然制品,可作为食品添加剂使用。根据需要可进一步纯化应用于医药原料等。
2.5 回收甲酸浓度的测定
纳滤分离后弃去的甲酸量较大,需回收处理继续使用。采用1.3.3.4的方法对回收甲酸进行测定,结果如表2所示。

表2 回收甲酸含量测定
经统计学处理P>0.05,表明回收甲酸浓度与0.5 mol/L甲酸对照品无显著性差异,稍加调整便可循环使用,不但节省了试剂,而且避免了甲酸直接排放造成的环境污染。
3 结论
(1)采用分子纳膜过滤技术,选用150 nm管式膜纳滤洗脱液,截留相对分子质量200~1 000的包含目标产物环磷酸腺苷(cAMP)及部分其他组分,分离出大分子组分及小分子组分,利于浓缩、纯化得到环磷酸腺苷(cAMP)成品。工艺能耗量低,适于从红枣中提取环磷酸腺苷(cAMP)的大规模工业化生产。
(2)0.5 mol/L甲酸洗脱15~18 h后,紫外扫描图谱在256~258 nm处的最大吸收峰与环磷酸腺苷(cAMP)标准品的峰型相同,表明甲酸能把交换到树脂上的环磷酸腺苷(cAMP)洗脱下来。
(3)纳滤后截留组分经HPLC检测,出峰时间在5~5.1 min,与环磷酸腺苷(cAMP)标准品相近,表明为同一物质,由于截留液中包含目标产物环磷酸腺苷(cAMP)的相对分子质量为200-1 000的组分,杂峰较多,需纯化;纳滤液(弃去液)在5~5.1 min处已经无峰,表明没有与环磷酸腺苷(cAMP)标准品相同的物质,纳滤液几乎不含cAMP;因此采用纳滤技术浓缩大量甲酸洗脱液,可缩短工艺周期,降低能耗,利于目标产物cAMP分离和纯化。
(4)管式膜虽然膜比表面积小,造价高,但料液可不经预处理,并不易堵塞,方便清洗。
(5)在纳滤过程中,由于无机物和有机物在纳滤膜上的浓缩滞留易于形成特殊的物质与营养环境或是大分子和胶体悬浮物,有利于微生物在膜表面生长,增加渗透阻力,使膜的通透性下降,降低纳滤过滤通量,使膜分离性能恶化,并导致目标产物的收率降低。因此使用完毕,先将膜设备中的过滤溶液顶洗干净,用温水冲洗20~40 min(水温最高50℃),进行循环清洗,通过浓缩液及渗透口排放,将出口封死并采取合适的方法保存。
[1] 王薇,杜启云.纳滤膜分离技术及其进展[J].工业水处理,2004,24(3):5 -8.
[2] 何毅,李光明,苏鹤祥,等.内滤分离技术的研究进展[J].过滤与分离,2004,24(3):5 -8.
[3] 宫慧慧,高群玉,陈惠音.纳滤膜技术在食品和发酵中的应用[J].食品工业科技,2002,23(10)87 -89.
[4] 陈小霞,岳振锋,吴振强,等.纳膜过滤技术及其在食品与发酵工业中的应用[J].武汉工业学院学报,2000,(2):37-40.
[5] 米东,王瑛,李明润.红枣环磷酸腺苷(cAMP)的提取工艺[J].上海师范大学学报:自然科学版,2007,36(3):77-79.
[6] 刘孟军,王永惠.枣和酸枣等14种园艺植物cAMP含量的研究[J].河北农业大学学报,1991,14(10):20-22.
[7] 国家药典委员会.中华人民共和国药典2005版一部[S].北京:化学工业出版社,附录ⅤA:28.
[8] 国家药典委员会.中华人民共和国药典2005版一部[S].北京:化学工业出版社,附录ⅥB:31-32.
[9] 国家药典委员会.中华人民共和国药典2005版一部[S].北京:化学工业出版社,附录ⅥD:33-35.
[10] 吴世斌,葛跃,耿莉,等.高效液相色谱法测定环磷酸腺苷及其制剂的含量[J].中国生化药物杂志,2001,22(1):32-33.
[11] 温辉梁.保健食品加工技术与配方[M].南昌:江西科学技术出版社,2002:42-72.
[12] 徐涛,潘见,袁传勋,等.大孔树脂SPE-RP-HPLC检测大枣中的 cAMP[J].食品科学,2005,26(12):179 -181.
The Application of Nanofiltration in the Extraction of Jujube Cyclic Adenosinemonophosphate(cAMP)
Wang Chun-xia1,Lu Fu-ping1,Liu Yi-han1,Du Lian-xiang1,Li Ming-run2
1(Key Laboratory of Industrial Microbiology,Ministry of Education ,College of Bioengineering,Tianjin University of Science and Technology,Tianjin 300457,China)2(Tianjin Institute of Medical and Pharmaceutical Sciences,Tianjin 300020,China)
Nanofiltration was used in the extraction of cAMP from Jujube.Jujube was first soaked,then through puree,enzyme hydrolysis,filtration,resin adsorption and formic acid elution.The results showed:Nanofiltration fraction have a peak at a wavelength of 258nm by UV which was the same as the cyclic adenosine monophosphate(cAMP)standard;the Nanofiltration discard part has no peak at 258nm;HPLC showed that Nanofiltration interception fraction has the same retention time as the cyclic adenosine monophosphate(cAMP)reference,while the Nanofiltration discard liquid do not have the peak at the same time point.This indicated that nanofiltration intercepted the target product of cyclic adenosine monophosphate(cAMP),successfully separated molecular,purified and concentrated cAMP.
nanofiltration,Intercept fraction,jujube,cAMP,concentrate
大学专科,高级实验师。
*天津市农业科技成果转化与推广计划项目(0702170)
2010-03-08,改回日期:2010-12-06

