铅冰铜控制电位选择性氯化浸出
文剑锋,杨天足,王 安,肖 峰,杨际幸
(中南大学冶金科学与工程学院,湖南长沙 410083)
铅冰铜控制电位选择性氯化浸出
文剑锋,杨天足,王 安,肖 峰,杨际幸
(中南大学冶金科学与工程学院,湖南长沙 410083)
采用控制电位氯化浸出铅冰铜,介绍了控制电位浸出的原理和过程,并在试验的基础上,探讨了电位、[H2SO4]、[HCl]、反应温度、反应时间对铜、铅、铁、银浸出率的影响,结果表明,浸出过程中,电位、[H2SO4]、[HCl]对铜、铁、银的浸出率有较大影响,而反应温度和反应时间对整个过程影响较小,同时确定了控制电位氯化浸出铅冰铜的最佳条件为[H2SO4]=2.0 mol/L,[HCl]=2.0 mol/L,L∶S=5∶1,电位400 mV,温度353K,时间2 h。在此条件下,铜、铁、铅、银的浸出率分别为98.27%、99.07%、4.21%、1.54%,实现了铜、铅、银的有效分离。
铅冰铜;控制电位;氯化浸出;铜;银
冰铜[1]是铜火法冶炼中产出的一种冶金副产品,其主要成分为 Cu、Fe的硫化物,熔解有少量PbS、ZnS、Ni3S2、Co3S2、FeO、Fe3O4及贵金属 Au、Ag,通常称之为锍。鼓风炉炼铅时亦会产出冰铜,其中的铅含量远高于传统的冰铜,被称之为铅冰铜,其化学成分大致为/%:Cu 20~50,Fe 0.5~30,S 12~25,Pb 10~35,Sb 0.2~6,Ag 0.35~0.75,Zn 0.15~3,As 0.1~6。
铅冰铜的传统处理是作为铜冶炼的原料,当其中含铜较高时,直接进入转炉进行吹炼,铅和硫氧化挥发进入气相,铅以烟尘的形式回收,硫以SO2的形式进入制酸系统,产出粗铜,再进行火法精炼和电解精炼。此工艺流程长,金属回收率低,成本高;当含铜较低时,通常先进行氧化焙烧脱硫,将硫化铜或硫化亚铜转化为氧化铜或硫酸铜,再用硫酸浸出法将铜、铅分离,此工艺焙烧过程容易烧结,硫化铜的氧化不彻底,导致铜回收率低,过程产生低浓度二氧化硫,污染环境[2]。为克服现有铅冰铜处理方法的不足,有效地实现贵贱金属的分离,且过程基本无污染,实验研究了在氯化体系中控制电位处理铅冰铜的湿法冶金方法。控制电位氯化浸出是湿法冶金的一种有效手段,利用各金属的电位差异,进行选择性浸出,实现金属间的分离。1975年加拿大鹰桥公司在挪威的克里斯蒂安桑精炼厂首次用控制电位选择性氯化浸出处理铜镍高锍的盐酸浸出渣[3~5],镍、铜的浸出率≥98%;20世纪80年代,控制电位氯化工艺开始用于处理金泥,1993年王友平[6]等报道了中原冶炼厂用控制电位氯化法处理金泥,实现了铜的浸出率≥99.5%,浸出渣中贱金属含量≤3%;2002年李元坤[7]等采用分步控制电位选择性氯化浸出方法处理含铜、铅、锌、银复杂多金属硫化矿,实现了锌的浸出率≥99%,随后的浸铅和分铜工序里,铅和铜的浸出率都在99%以上。可以看出,控制电位氯化浸出可有效地分离贵、贱金属。本研究采用控制电位氯化浸出铅冰铜,研究过程中溶液电位、酸度、反应温度、反应时间对浸出率的影响,并探讨了其中铜、铅、铁、银的行为。
1 控制电位选择性氯化原理
控制电位选择性氯化法是利用各种元素的氧化还原电位的差异,达到选择性浸出和分离的目的。在试验过程中,一般是通过加入氯气、氯酸钠等氧化剂来控制电位。在体系控制的电位内,电位较负的元素,被优先氧化进入溶液中,而电位较正的元素,则不被氧化或很少氧化而留在渣中,从而达到选择性浸出和分离的目的。因此,元素的氧化还原电位值相差愈大,选择性浸出和分离的效果就愈好。湿法冶金过程中,常见元素的标准电位[8]列于表1。
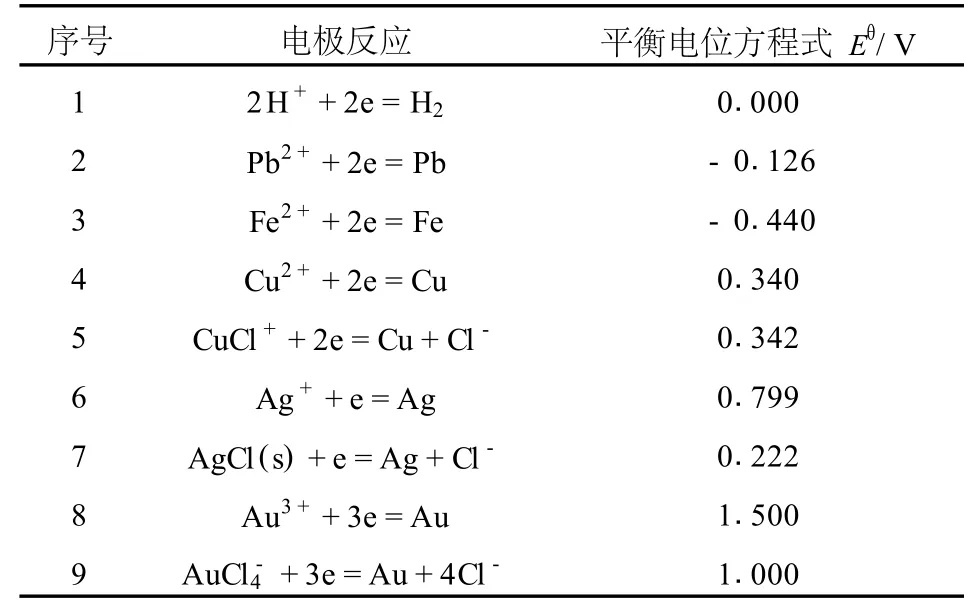
表1 常见元素标准电极电位
试验原料为铅冰铜,主要为铜、铅、铁的硫化物,将其加入至一定浓度的盐酸溶液中,并插入铂电极和甘汞电极,作为电位测试装置,选用环保高效的双氧水作为氧化剂,当通入双氧水后,体系内电位逐渐升高,同时贱金属铜、铅、铁的硫化物开始溶解,当电位升高至一定程度时,银发生溶解,造成损失;当停止通入双氧水后,体系电位因双氧水被消耗而逐渐下降,贵金属停止溶解,贱金属则不能完全浸出,故控制体系适宜的电位是该过程成败的关键,若体系内电位较低,贵金属虽不溶出,但贱金属浸出效果较差;若电位控制较高,贱金属浸出效果虽好,但贵金属会浸出损失。因此,需要确定最佳电位,才能有效地进行贵、贱金属的分离。
2 实验研究方法
2.1 实验原料
铅冰铜试样取自湖南郴州某冶炼厂,其成分分析结果列于表2。化学物相分析法表明:铜主要以硫化物及少量单质铜的形式存在;铁主要以硫化物及氧化物的形式存在;铅、银绝大多数以硫化物形式存在。
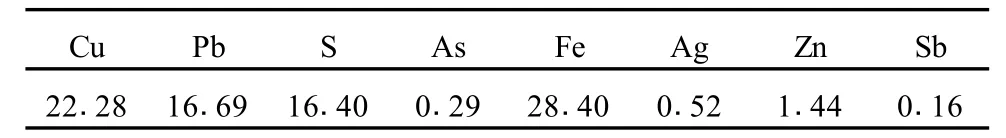
表2 铅冰铜各元素含量 %
2.2 实验过程
2.2.1 控制电位浸出
铅冰铜控制电位浸出实验,是将30 g冰铜加入到体积为150 mL的具有一定浓度的硫酸与盐酸混合液中,在一定温度下,以一定的流速通入双氧水,同时测量溶液的电位,进行搅拌浸出。当溶液电位达到选定值范围时,需严格控制氧化剂加入速度,即保持溶液电位在选定范围之内进行氯化浸出,反应完毕后,对矿浆进行过滤。
实验过程中,主要发生的化学反应有:

2.2.2 电位的监测
溶液电位的测量是在氯化浸出反应器内,插入测定电位的铂电极和甘汞电极,分别作为指示电极和参比电极,以MT320—SpH计为显示仪,所显示的电位是溶液中金属离子的混合电位与甘汞电极电位之差。298 K时,甘汞电极相对于标准氢电极的电位为242 mV。
2.2.3 溶液中各种金属离子的分析[9]
Cu2+的测定采用碘量法滴定,Pb2+的测定采用EDTA滴定法,Fe3+采用重铬酸钾法滴定,Ag+的测定采用硫氰酸钾滴定法。
3 结果与讨论
3.1 电位对浸出率的影响
在[H2SO4]=2.0 mol/L,[HCl]=2.0 mol/L, L∶S=5∶1,温度353 K,时间2 h的基本条件下,控制反应在不同电位下进行,考察电位对氯化浸出过程中铜、铅、铁、银的影响,从而确定最佳值,结果如图1所示。
从图1中不难发现,电位在320~400 mV时,铁、铅、银的浸出率变化很小,铁的浸出率>99%,铅、银均在7%以下,铜的浸出率随电位的升高而升高,电位约400 mV时,其浸出率≥98%;当电位超过400 mV后,铜、铁和铅的浸出率几乎没有变化,此时银的浸出率迅速上升。根据Ag2S的半反应式:
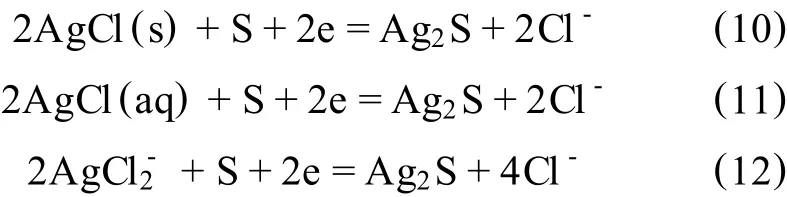

图1 电位对浸出率的影响
参考有关文献[10,11]中的热力学数据及标准半反应电极电位的计算方法可得:

式中ΔrGθ为标准反应吉布斯自由能;z为参加反应的电子数;F为法拉第常数。
计算可得反应式(10)、(11)、(12)在温度为298 K时的电极电位分别为428 mV、809 mV、694 mV。当实测电位约440 mV时,其相对标准氢电极的电位约682 mV,此电位接近于Ag2S以形式溶解的标准电极电位,即694 mV,若进一步结合溶液中银配离子、氯离子浓度及温度的影响进行实际电位的计算,其值应在690 mV左右的范围内变化;反应过程中双氧水的用量与控制的电位高低密切相关,维持400 mV电位,氯化浸出2 h,需消耗浓度为30%的双氧水约18 mL,维持440 mV电位,氯化浸出2 h,需消耗双氧水约26 mL。因此,考虑到双氧水的成本及防止银溶解,实测电位应控制在440 mV以下。可以得出结论,电位接近400 mV时,溶液中铜、铁的硫化物98%以上均被氧化,银只有少量溶解,其浸出率约为1.54%,即400 mV为理想的电位值。另一方面,硫化铅的电位较硫化铜低,理论上应先于铜浸入溶液中,但实际中铅浸出率较低,为4.21%,这是由于溶液中存在 Cl-、,使其以 PbCl2、PbSO4的沉淀形式入渣[12]。
3.2 盐酸浓度对浸出率的影响
当[H2SO4]=2.0 mol/L,L∶S=5∶1,温度353 K,时间2 h,电位值为400 mV时,在不同的盐酸浓度条件下,考察[HCl]对选择性氯化浸出过程中铜、铅、铁、银的影响,结果如图2所示。
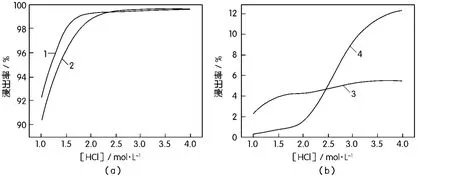
图2 盐酸浓度对浸出率的影响
从图2中可以看出,[HCl]介于1.0~2.0 mol/L时,铜、铁的浸出率由90%左右迅速升高,当[HCl] =2.0 mol/L时,铜、铁浸出率接近99%,此时铅、银的浸出率变化不大,均在5%以下;当[HCl]>2.0 mol/L时,铜、铁、铅的浸出率几乎不变,而银的浸出率迅速上升,当[HCl]=4.0 mol/L,银的浸出率约12.36%,这说明[Cl-]较高时,银与氯离子发生配位反应,大量溶解浸入溶液中。故[HCl]应不超过2.0 mol/L为宜。
3.3 硫酸浓度对浸出率的影响
当[HCl]=2.0 mol/L,L∶S=5∶1,温度353 K,时间2 h,电位值为400 mV时,在不同的硫酸浓度下,考察[H2SO4]对选择性氯化浸出过程中铜、铅、铁、银的影响,结果如图3所示。
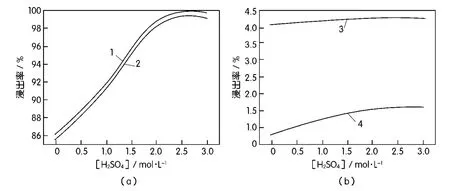
图3 硫酸浓度对浸出率的影响
由图3可知,当[H2SO4]为0~2 mol/L时,铜、铁的浸出率随[H2SO4]的升高而升高,[H2SO4]= 2 mol/L时,铜、铁的浸出率分别为 98.27%和99.07%;当[H2SO4]>2 mol/L时,铜、铁的浸出率变化很小。在[H2SO4]为0~4 mol/L整个浓度范围内,铅、银的浸出率几乎没有变化,分别在4.15%与1.39%左右波动。结合相关研究分析[12],此时大部分铅以氯化铅的形式沉淀入渣,由于氯化铅在热水中溶解度较大,而实验过程中,矿浆并非冷却后进行过滤,故在氯化浸出液中,铅有一定的溶解,故硫酸的加入也仅仅起到调节酸度的作用,溶液中并没有形成大量硫酸铅沉淀。因此,硫酸的最佳浓度选为2 mol/L较为合适。
3.4 反应时间对浸出率的影响
在[H2SO4]=2.0 mol/L,[HCl]=2.0 mol/L, L∶S=5∶1,温度353 K,电位值为400 mV的条件下,考察时间对氯化浸出过程中铜、铅、铁、银的影响,结果如图4所示。
从图4中可以看出,当1h<t<2h时,铜、铁的浸出率分别由75.46%、88.37%升高至98%以上,与此同时,铁的浸出率始终高于铜,说明铁优先于铜浸入溶液,在此期间,FeS可发生两类反应,即式(5)、(6),可以看出,FeS既可以直接与酸反应,也可以在酸性条件下与氧化剂发生氧化还原反应,而Cu2S、CuS均需酸性条件下存在氧化剂才能发生反应,这是铁优先于铜浸入溶液的原因之一。
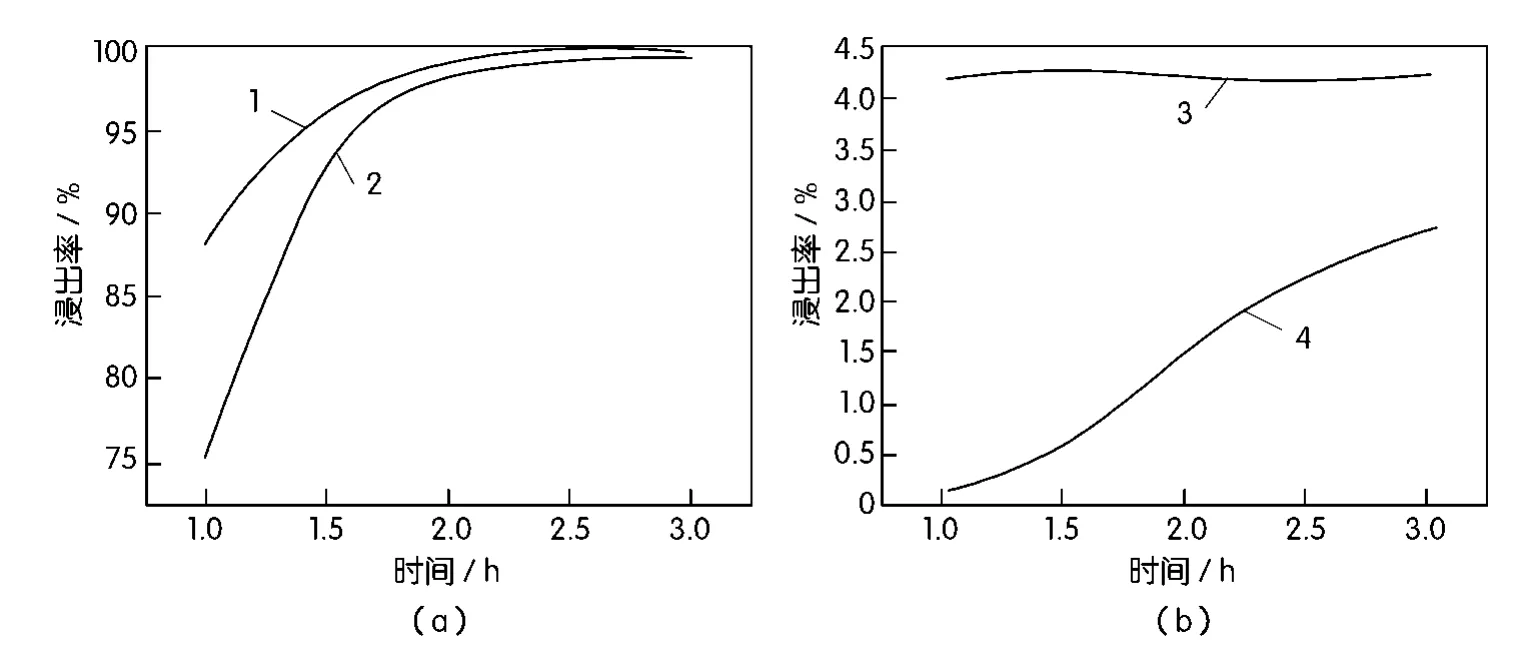
图4 反应时间对浸出率的影响
另一方面,由FeS、Cu2S、CuS氧化溶解的半反应为:

根据式(14)、(15)、(16),结合式(13),可以计算出298 K时,Cu2S、CuS、FeS的标准电极电位分别为563 mV、594 mV、113 mV,可以看出,FeS的电位明显低于CuS与Cu2S,这一点也可以说明FeS较CuS、Cu2S易于氧化。
在当前的实验条件下,若保证铜完全浸出,时间应不低于2 h。对于铅和银,时间的影响很小,图4显示,时间在3 h以内,铅的浸出率变化不大,银的浸出率升高1%左右,t=3 h时,铜的浸出率虽有提高,但并不显著。因此,时间取2 h较为合适。
3.5 反应温度对浸出率的影响
在[H2SO4]=2.0 mol/L,[HCl]2 mol/L,L∶S= 5∶1,时间2 h,电位值为400 mV的条件下,考察反应温度对氯化浸出过程中铜、铅、铁、银的影响,结果如图5所示。
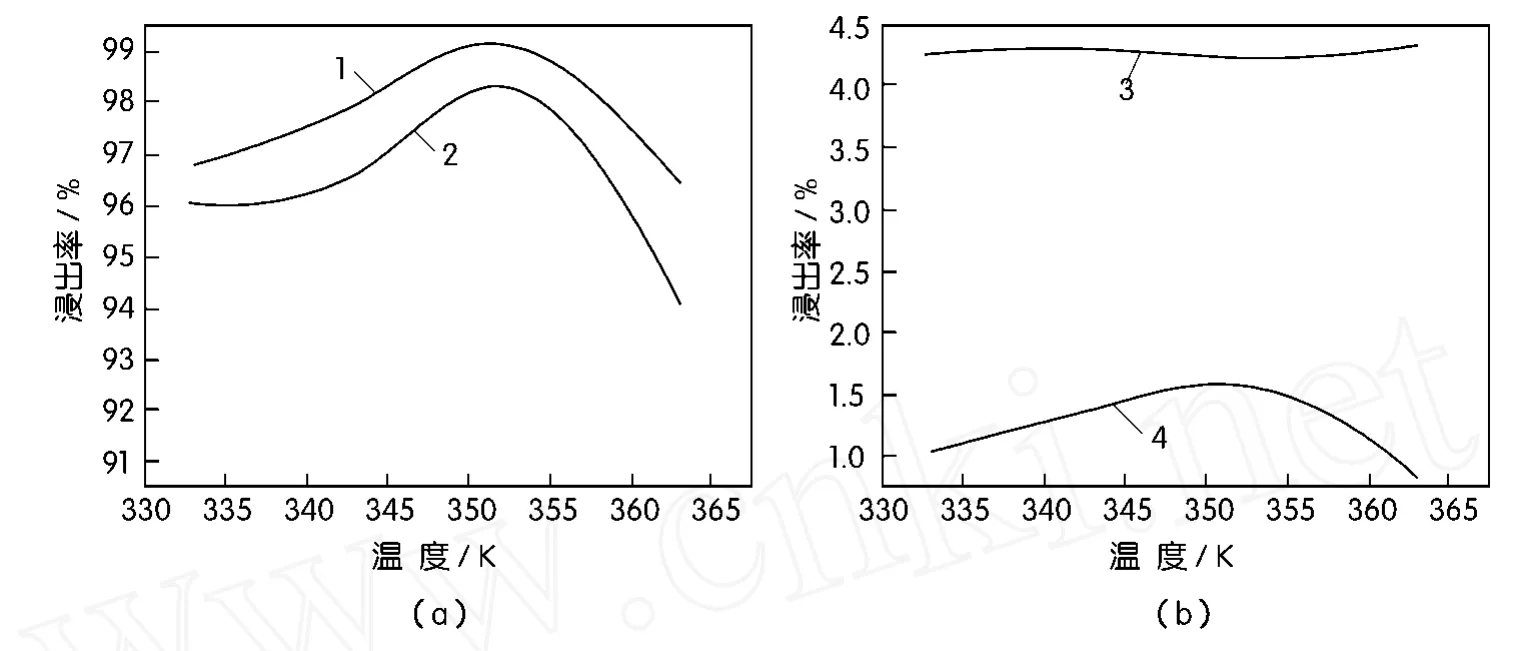
图5 反应温度对浸出率的影响
由图5可看出,当333 K<T<363 K时,铅、铁、银的浸出率无明显变化,可以认为温度对其影响较小;当333 K<T<353 K时,铜的浸出率由95%升高至98%,而当T>360 K时,铜的浸出率出现下降3%左右,这主要是因为实验过程所用的氧化剂为双氧水,当温度大于353 K时开始大量分解,不能完全参加氧化还原反应。与此同时,当温度发生变化时,参比甘汞电极的电位也会发生一定的变化,如表3所示,当温度为 373 K时,甘汞电极电位约为189 mV,这样,控制同样的电位,溶液相对标准氢电极的实际电位偏低。

表3 饱和氯化钾溶液中甘汞电极在不同温度下的电极电位[13]
因此,温度对铜的浸出过程有一定影响,但不是主要因素,综合考虑,353 K为适宜的温度条件。
另一方面,由表2可知,物料中除铜、铅、铁、银等元素外,还有含量较低的锌、锑、砷,在实验完成后,对酸性浸出渣取样分析发现,其中只有微量的锌、锑、砷,从这个角度来说,锌、锑、砷均浸入溶液中,但因其含量分别仅为1.44%、0.16%、0.29%,浸出过程的数据不具有代表性,故对其行为没有说服力,因此,实验过程中并未对锌、锑、砷的行为进行具体探讨。
4 结 论
1.采用控制电位选择性氯化的工艺浸出铅冰铜,从理论上介绍了控制电位浸出的原理和过程,并根据原理进行了试验,取得了较好的结果。
2.在探索试验的基础上,通过单因素条件实验,重点考察了电位、酸度、时间、温度对选择性氯化浸出中铜、铁、铅、银的影响,结合相关理论讨论了各因素的作用机理,并确定了电位、硫酸浓度、盐酸浓度是主要影响因素,时间与温度为次要因素。
3.电位较低时,铜的浸出率不理想,电位较高时,银的浸出率相应升高,造成分散,不便回收,同时会增大双氧水的用量;盐酸浓度的影响根源于氯离子,当氯离子浓度大于2.0 mol/L时,会增大银的溶解度,故盐酸浓度不超过2.0 mol/L为宜,但这样不能保证反应所需的酸度,需加入硫酸补充酸度,浸出过程中硫酸浓度保持2.0 mol/L。反应过程中,因硫化亚铁更易氧化,铁优先于铜浸入溶液中,时间应控制在2 h的范围内;反应温度较低时,固液传质较慢,不利于反应的进行,温度较高时,作为氧化剂的双氧水大量分解,降低了氧化效果,加之甘汞电极的相对电位有所下降,造成实际电位偏低,故实验过程中反应温度不宜过高。综上所述,确定了实验过程的最佳条件为:[H2SO4]=2.0 mol/L,[HCl]=2.0 mol/L, L∶S=5∶1,电位400 mV,温度353 K,时间2 h。
4.通过控制电位选择性氯化浸出铅冰铜,实现了铜、铅、银的有效分离,在所选的最佳条件下,铜的浸出率达到98.27%,铁的浸出率为99.07%,铅、银仅为4.21%、1.54%,效果十分理想。得到的酸性含铜浸出液可直接生产粗铜粉或经净化等工序生产电积铜,得到的酸性浸出渣可返回铅冶炼的火法系统,其中铅、银的品位,由铅冰铜中的16.69%和0.52%富集到34%和1.06%。
[1] 朱屯.现代铜湿法冶金[M].北京:冶金工业出版社,2002.
[2] 陈丰,陈立三.控制电位选择氯化富集贵金属[J].株冶科技, 1996.11,24(4):40-44.
[3] 黎鼎鑫,王永录.贵金属提取与精炼[M].长沙:中南大学出版社,2003.312-329.
[4] 谭庆麟.铂族金属性质冶金材料应用[M].北京:冶金工业出版社,1990.184-198.
[5] Chu Yuncheng,F Lawson.Leaching copper matte in acidic oxygenante sulphate-chloride solution[A].Chen Jiayong.Proceedings of second International conference on hydrometallurgy[C].Bei jing:international Academic Publishers,1992.215-220.
[6] 王友平,谢斌,赖友芳,等.控电氯化法在处理氰化金泥中的应用[J].黄金,1993,14(8):45-46.
[7] 李元坤,寇建军.铜铅锌银多金属矿湿法分离新工艺[J].有色金属(冶炼部分),2002,(3):11-15.
[8] 刘伟锋.控制电位选择性氯化分离贵锑中贵贱金属的工艺研究[D].长沙:中南大学冶金科学与工程学院,2005.
[9] 北京矿冶研究总院分析室.矿石及有色金属分析手册[M].北京:冶金工业出版社,2001.59-92.
[10]杨显万.高温水溶液热力学数据计算手册[M].北京:冶金工业出版社,1983.11-255.
[11]迪安.兰氏化学手册[M].北京:科学出版社,2003.166.
[12]夏星,杨天足,刘伟锋.贵锑选择性氯化浸出富集金过程中铅的行为研究[J].贵金属,2008,29(1):5-10.
[13]朱元保,沈子琛,张传福,等.电化学数据手册[M].长沙:湖南科学技术出版社,1985.135-164.
Chlorination-leaching of Lead-matter at Controlled Potential
WEN Jian-feng,YANGTian-zu,WANGAn,XIAO Feng,YANGJi-xing
(School of Metallurgical Science and Engineering,Central South University,Changsha410083,China)
Chlorination-leaching processof lead-matter was investigated by controlling potentia1.The principle and process were introduced,and the influence of potentia1,[H2SO4],[HCl],temperature and time acting on the leaching ratio of copper,lead,iron and silver was discussed,based on the experiment process.The results show that potential,[H2SO4]and[HCl]have great effects on the leaching ratio of copper,iron and silver in the process,the influence of temperature and time is less.At the same time,the optimum condition of Chlorination-leaching process by controlling potential,which is[H2SO4]=2.0mol/L,[HCl]=2.0 mol/L,L∶S=5∶1,potential 400 mV,temperature 353 K,time 2 h,was confirmed.In these conditions,the leaching ratio of copper,lead,iron and silver is respectively 98.27%,99.07%,4.21%and 1.54%,and the effective separation was achieved.
lead-matter;controlled potential;chlorination-leaching;copper;silverq
TF111.31
A
1003-5540(2011)01-0024-06
文剑锋(1985-),男,硕士研究生,主要从事重金属及贵金属冶金研究工作。
2010-11-15

