氢氧化铜/过氧化聚吡咯修饰电极的制备及其对葡萄糖的催化氧化
金 君,于 浩,王 飞,宋诗稳,刘珍叶,齐广才
(延安大学 化学与化工学院,陕西 延安 716000)
氢氧化铜/过氧化聚吡咯修饰电极的制备及其对葡萄糖的催化氧化
金 君,于 浩,王 飞,宋诗稳,刘珍叶,齐广才*
(延安大学 化学与化工学院,陕西 延安 716000)
采用循环伏安法制备了氢氧化铜/过氧化聚吡咯膜修饰电极(Cu(OH)2/PPyox/CCE),并对其进行了表征。研究了该修饰电极对Glu的电催化氧化活性。结果表明,该修饰电极对Glu的氧化具有良好的电催化活性。在优化条件下,安培法检测Glu的线性范围为2.0×10-7~1.2×10-3mol·L-1,灵敏度最高为 2500.0μA·mmol-1·cm-2,检出限(3Sb)为 1.0 ×10-7mol·L-1,加标回收率为96.5%~100.6%。该方法已用于血清中葡萄糖含量的测定。
氢氧化铜;过氧化聚吡咯;电催化氧化;葡萄糖
糖尿病是一种常见的代谢内分泌疾病,通常伴随着诸如心脑血管疾病、肾衰竭、中风、高血压、失明和神经紊乱等各种并发症,严重威胁人类的身体健康[1],所以,准确、快速的测定血液中葡萄糖的浓度有着重要的意义。
非酶葡萄糖传感器解决了酶葡萄糖传感器在测定葡萄糖时易受温度影响、容易失活等缺点。贵金属如Au、Pt以及某些过渡金属如Co、Cu、Fe等的氢氧化物修饰电极在非酶葡萄糖传感器的研制中受到了广泛关注[2-6],非酶葡萄糖电化学传感器在实际应用中存在的最大问题是易受试样中Vc等还原性物质的干扰。文献中曾报道利用Nafion膜消除Vc的干扰[7]。过氧化聚吡咯膜(PPyox)能有效提高修饰电极的稳定性,同时具有优异的阳离子选择性,能有效的消除Vc的干扰[8]。
基于此,本文采用电化学方法制备了氢氧化铜/过氧化聚吡咯复合膜修饰电极,研究了该修饰电极在碱性介质中对葡萄糖的电催化活性,并用于血清中葡萄糖含量的测定。
1 实验部分
1.1 仪器和试剂
LK98BⅡ型电化学工作站(天津市兰力科化学电子高技术有限公司)。实验采用三电极系统电化学池:以修饰电极为工作电极,饱和甘汞电极(SCE)为参比电极,铂丝(Pt)为辅助电极。
无水葡萄糖(Glu,分析纯,汕头市光华化学厂),吡咯(Py,分析纯,国药集团化学试剂有限公司,用前进行减压蒸馏),HAuCl4(分析纯,上海化学试剂厂),其余试剂均为分析纯,实验用水为二次蒸馏水。
1.2 修饰电极的制备
1.2.1 过氧化聚吡咯膜(PPyox)修饰电极的制备
本研究中以复合陶瓷碳电极(composite ceramic carbon electrode,CCE)为基础电极。该电极制备方法参考Tsionsky[9]等人的工作及本实验室前期的工作[10]。将处理好的 CCE 置于 0.10 mol·L-1Py+0.10 mol·L-1KCl溶液中,控制工作电位为0.80 V,恒电位沉积5 s。取出电极冲洗后置于0.20 mol·L-1NaOH中,控制工作电位0.80 V,恒电位过氧化30 min,即得 PPyox/CCE。
1.2.2 氢氧化铜/过氧化聚吡咯复合膜修饰电极(Cu(OH)2/PPyox/CCE)的制备
采用两步电化学法制备了氢氧化铜/过氧化聚吡咯修饰电极。首先参考本实验室前期的工作[10]制备了铁氰化铜/过氧化聚吡咯复合膜修饰电极(CuHCF/PPyox/CCE)。然后将CuHCF/PPyox/CCE电极置于 0.10 mol·L-1NaOH 中以 50 mV·s-1的扫速在-0.2~0.6 V范围内扫描一定圈数,即得Cu(OH)2/PPyox/CCE修饰电极。
1.2.3 实验方法
循环伏安实验:将制得的修饰电极(或裸CCE)表面冲洗干净后,置于一定的支持电解质溶液中以不同的扫描速率记录一定电位范围内的循环伏安图。
动力学计时安培实验:以修饰电极为工作电极,控制工作电极电位为一定值,向一连续搅拌的溶液中每隔一定的时间加入一定量的葡萄糖,记录i-t曲线。
2 结果与讨论
2.1 吡咯膜厚度的影响
采用循环伏安法考察了吡咯膜厚度对修饰电极电催化活性的影响。结果发现,当吡咯浓度过大时,聚吡咯膜不均匀,因此选择吡咯浓度为0.10 mol·L-1,并通过控制电沉积时间以控制膜的厚度。沉积时间t较短时,形成的膜太薄,不能有效减小Vc等还原性物质的干扰。而当沉积时间过长时,形成的膜太厚,掺杂入膜内的阴离子被PPy所覆盖,最里层的阴离子在过氧化处理时难以迁出膜外,最终不能形成直达基底电极的离子通道。因此实验选择吡咯浓度0.10 mol·L-1,电沉积时间为5 s(表1)。

表1 沉积时间的影响
2.2 Cu(OH)2/PPyox复合膜修饰电极的制备

图1 CuHCF/PPyox/CCE的循环伏安图
本研究采用在线电化学衍生法从CuHCF制备Cu(OH)2以控制其表面形貌。图1是 CuHCF/PPyox复合膜修饰电极在0.10 mol·L-1KCl溶液中的循环伏安图。其中式量电位为0.70 V的氧化还原峰来源于CuHCF电对的电极反应[10]。图2是将CuHCF/PPyox复合膜修饰电极置于0.10 mol·L-1NaOH溶液中循环扫描时记录的循环伏安图,其中式量电位为0.2 V处的一对氧化还原峰来源于Cu-HCF分解后生成的的电极反应。由图可以看出,随着扫描的进行,该氧化还原峰的峰电流逐渐减小至完全消失,表明电极表面的CuHCF在NaOH溶液中已完全分解,分解后生成的Cu2+离子与OH-生成Cu(OH)2,并沉积于电极表面。
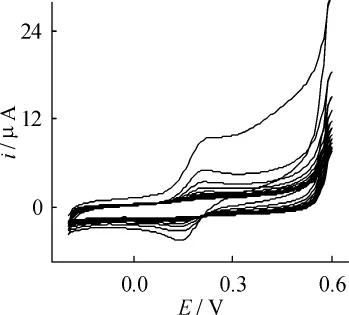
图2 CuHCF/PPyox/CCE的循环伏安图
2.3 修饰电极对葡萄糖的电催化氧化
采用循环伏安法考察了Cu(OH)2/PPyox/CCE电极对Glu的电催化活性(图3)。图中曲线a、c分别为裸CCE电极及Cu(OH)2/PPyox/CCE修饰电极在0.10 mol·L-1NaOH溶液中的循环伏安图,曲线b、d分别为裸CCE电极及Cu(OH)2/PPyox/CCE修饰电极在0.10 mol·L-1NaOH+1.0 ×10-3mol·L-1Glu溶液中的循环伏安图。由图可见,与裸电极相比,Glu在Cu(OH)2/PPyox/CCE修饰电极上电氧化时,阳极峰电流明显增加,表明该修饰电极对Glu的氧化具有强的催化活性。在优化条件下,循环伏安法测定葡萄糖的线性范围是5.0×10-5~9.0×10-4mol·L-1,相关系数是 0.9987。

图3 Glu在裸电极与Cu(OH)2/PPyox/CCE修饰电极上的循环伏安图
3 安培法检测葡萄糖
由于吸附于电极表面的OH-离子可以加快Glu的电氧化速率,故非酶葡萄糖电化学传感器经常在碱性条件下用于测定Glu[11]。实验中选择0.10 mol·L-1NaOH溶液作为支持电解质。
3.1 工作电位的选择
采用动态安培法考察了工作电位对测定的影响。结果表明,当工作电位从0.40~0.75 V变化时,修饰电极对Glu的电流响应先增大后基本不变,在0.60 V时电流响应达到最大,故选择0.60 V作为安培法检测Glu的工作电位。
3.2 线性范围、检出限
图4为连续加入100 μMGlu的动力学计时安培图。由图可见,随着Glu的加入,电流随之以台阶状增大,符合稳态电流的特征。在优化条件下,电流与Glu浓度分别在2.0×10-7~5.6×10-4mol·L-1(r=0.9960)与5.6 ×10-4~1.2 ×10-3mol·L-1(r=0.9972)范围内成线性关系,检出限(3sb)为1.0×10-7mol· L-1,灵 敏 度 分 别 为 为 2500.0 μA ·mmol-1·cm-2和 1250.0 μA·mmol-1·cm-2,响应时间小于5 s。

图4 连续加入100μMGlu的安培响应
葡萄糖的电氧化过程中会生成一系列反应中间体,它们可以吸附于电极表面而使电极表面电活性中心钝化,从而降低了测定的灵敏度,当对溶液进行搅拌时,这种吸附作用能有效的被减小,但随着Glu的不断加入,这种吸附就无法避免,因此造成了在高浓度时对Glu的催化灵敏度有所降低,故校正曲线分段成线性[12-15]。
3.3 干扰实验
对于0.10 mmol·L-1的 Glu溶液,当相对误差不大于±5%时,10倍的Fe3+、Cu2+不干扰测定,其他常见的无机离子如 K+,Na+,Ca2+,Mg2+,Ba2+,NO3-,Cl-等均对测定无影响。Vc在碱性条件下带负电荷,受到带负电荷的PPyox膜的排斥,减小了其对测定的干扰。
3.4 样品分析
取血样1份,离心分离得血清。准确移取1.00 mL血清,用0.10 mol·L-1NaOH溶液稀释100倍,采用标准加入法定量测定,测定结果如表2所示。

表2 人体血清中葡萄糖含量的测定
3.5 修饰电极的稳定性及重现性
在优化条件下,对1.0 ×10-5mol·L-1的 Glu 溶液连续进行10次平行测定,RSD为3.9%;电极干态储存30 d后,对Glu进行测试,电流响应几乎不变,表明该修饰电极对Glu的测定具有较好的稳定性和重现性。
[1]冯琳洁,吴芳华,徐继明,等.基于聚吡咯纳米阵列的葡萄糖传感器研究[J].化学传感器,2007,27(3):23-28.
[2]汪海燕,王晔,宋琼,等.葡萄糖在纳米金修饰金电极上电化学行为研究[J].分析科学学报,2007,23(2):185-188.
[3]陈翠莲,魏小兰,沈培康.葡萄糖在纳米Pt/C电极上的电催化氧化[J].电化学,2006,12(1):20-24.
[4]苏桂琴,吴华强,徐冬梅,等.葡萄糖在碳纳米管负载钴修饰电极上的电催化氧化[J].安徽师范大学学报,2007,30(6):675 -678.
[5]丁海云,周晔,张树静等.纳米铜修饰玻碳电极的制备及其对葡萄糖的催化氧化[J].分析化学研究简报,2008,6(36):839 -842.
[6]Cao X,Wang N.A novel non - enzymatic electrochemical glucose sensor modified with FeOOH nanowire[J].Electrochemistry Communications,2010,12:1581 -1584.
[7]王学技,张丽丽,苗力孝,等.Au/Nafion/玻碳修饰电极上L-半胱氨酸的氧化和检测[J].Science China Chemistry,2011,54(3):521 -525.
[8]Li J,Lin X Q.Electrodeposition of gold nanoclusters on overoxidized polypyrrole film modified glassy carbon electrode and its application for the simultaneous determination of epinephrine and uric acid under coexistence of ascorbic acid[J].Analytical Chimica Acta,2007,596(2):222 -230.
[9]Tsionsky M,Gun G,Glezer V,et al.Sol- Gel derived ceramic carbon composite electrodes:introduction and scope of applications[J].Analytical Chemistry,1994,66(10):1747-1753.
[10]Yu H,Song S W,Lian Y Y,et al.Electrochemical preparation of copper hexacyanofer-rate nanoparticles under the synergic action of EDTA and HAuCl4[J].Journal of Electroanalytical Chemistry,2010,650:82 -89.
[11]Feng D,Wang F,Chen Z L.Electrochemical glucose sensor based on one-step construction of gold nanoparticle-chitosan composite film[J].Sensors and Actuators B 2009,138:539-544.
[12]Ernst S,Heitbaum J.The electrooxidation of glucose in phosphate buffer solutions[J].Journal of Electroanalytical Chemistry,1979,100:173 -183.
[13]Rong L Q,Yang C,Qian Q Y,et al.Study of the nonenzymatic glucose sensor based on highly dispersed Pt nanoparticles supported on carbon nanotubes[J].Talanta,2007,72:819-824.
[14]Sirilak S,Panote T,Chongdee T,et al.Fabrication of Nanoporous Copper Film for Electrochemical DetectionofGlucose[J].Electroanalysis,2009,21(21):2371 -2377.
[15]Khatib K M E,Hameed R M A.Development of Cu2O/Carbon Vulcan XC-72 as non-enzymatic sensor for glucose determination[J].Biosensors and Bioelectronics,2011,26:3542 -3548.
Catalytic Oxidition of Glucose at Copper Hydroxide/Overoxidized Polypyrrole Composite Film Modified Electrode
JIN JUN,YU HAO,WANG FEI,SONG Shi-wen,LIU Zhen-ye,QI Guang-cai*
(College of Chemistry and Chemical Engineering,Yan an University,Yan an 716000,China)
Copper hydroxid/overoxidized polypyrrole composite film modified electrode was fabricated by using cyclic voltammetry and characterized by electrochemistry.The electrochemical behavior of glucose on the modified electrode was investigated by cyclic voltammetry and amperometric techniques in 0.10 mol·L-1NaOH.The results showed that the resulting modified electrode exhibited high electrocatalytic activity for the oxidation of glucose.Under the optimum conditions,the calibration curve was over the range of 2.0 × 10-7mol·L-1to 1.2 × 10-3mol·L-1with the detection limit of 1.0 ×10-7mol·L-1(3Sb).The highest sensitivity for the determination of glucose was 2500.0 μA·mmol-1·cm-2.The RSD(n=10)for the determination of 1.0 ×10-5mol·L-1Glu was 3.9%and the recoveries were 96.5% ~ 100.6%.The proposed method was applied to detect glucose in the serum.
copper hydroxid;overoxidized polypyrrole film;electrocatalytic oxidation;glucose
O657.1
A
1004-602X(2011)04-0039-04
2011-08-10
陕西省自然科学基金项目(2010JQ2005)和延安大学专项科研基金(YD-2007-7)
金 君(1987—),女,河南周口人,延安大学在读硕士研究生。 *为通讯作者。
[责任编辑 李晓霞]

