改良新生大鼠雪旺细胞的体外培养和纯化
陶晓宇, 滕晓华, 刘 波, 段 答, 卢 明
(湖南师范大学第二附属医院(解放军第163医院)神经外科, 中国 长沙 410003)
雪旺细胞( Schwann cells, SCs)是周围神经系统由胚胎时期的神经嵴前体细胞演化形成的胶质细胞,可吞噬变性坏死碎片[1]、分泌神经营养营养因子和神经生长因子[2]以及引导轴突再生[3].多项研究[ 4-7]表明雪旺细胞移植能促进脊髓损伤、周围神经损伤和中枢神经系统脱髓鞘性疾病等的功能恢复.近年来已成为周围神经修复领域研究的热点.本实验研究了从新生大鼠中获得高纯度SCs并于体外不断传代和增殖的方法.
1 材料和方法
1.1 材料和试剂
新生SD大鼠(出生第5 d)10只(中南大学湘雅医学院动物部),DMEM培养基(Gibco),胎牛血清FBS(Hyclone),胰蛋白酶和胶原蛋白酶(Gibco),L-多聚赖氨酸(Sigma ),阿糖胞苷(Ara-C)(Sigma ),鼠抗S-100(Sigma),小鼠二步法检测试剂盒(中彬金桥生物工程有限公司),D-Hank’s液和0.01 mol/L PBS均为本实验室配制,离心管和50 mL玻璃培养瓶,解剖显微镜(北京泰克仪器有限公司),倒置相差显微镜(OLYMPUS).
1.2 雪旺细胞的分离和培养
将新生SD大鼠放入盛有络合碘的烧杯中浸泡(完全淹没)消毒15 min,用无菌组织剪依次剪开皮肤、皮下组织,充分暴露坐骨神经,换另外一把组织剪剪取双侧坐骨神经置于盛有D-Hank’s的培养皿中,解剖显微镜下仔细剥离神经鞘膜,PBS洗涤2遍,眼科剪剪碎成0.5 mm3大小, 0.25%(体积分数,全文同)胰蛋白酶和0.03%胶原酶Ⅰ37 ℃水浴混合消化30 min,摇匀后沉淀5 min,吸取上清单细胞悬液移入盛有含10% FBS的 DMEM培养液终止消化,向剩余沉淀内继加上述胰酶和胶原酶继续于37 ℃水浴中混合消化30 min后加入含10% FBS的 DMEM 培养液终止消化,巴氏吸管吹打后用80 μm的细胞筛过滤,离心 (1 500 r/min,5 min),弃上清液,用含 10% FBS的 DMEM培养液重新悬浮,吹散制成单细胞悬液,调整细胞密度至 1×105个/mL,接种到50 mL玻璃培养瓶内,置于37 ℃、5%CO2温箱中培养.
1.3 雪旺细胞的纯化
差速贴壁法+Ara-c抑制法:将上述单细胞悬液接种到50 mL玻璃培养瓶内侧放入培养箱,15 min后转另外一侧放置,30 min后平放,45 min后将未贴壁细胞悬液调整浓度为1×105个/mL,重新接种到多聚赖氨酸包被的50 mL玻璃培养瓶内,24 h后加入Ara-C(终浓度为2 mg/L),48 h后全量换液,并用PBS洗涤一遍,以除去Ara-C的作用,加入不含血清的DMEM培养液,置于37 ℃、5%(体积分数)CO2培养箱中培养,以后每2~3 d半量换液一次.待细胞长满培养瓶底部 80%面积时,进行传代,加入适量0.125%胰蛋白酶,在倒置相差显微镜下控制消化时间,待雪旺细胞突起收缩后,立即加入含10%(体积分数)胎牛血清的DMEM培养液终止消化,用吸管轻轻吹打瓶底,再行差速贴壁 15 min×1次,30 min×1次.
1.4 雪旺细胞的鉴定
将纯化后的雪旺细胞调整细胞浓度为1×105个/mL,接种到盖玻片(事先用多聚赖氨酸包被)的六孔培养板内,继续培养2 d后,细胞长满玻片的80%,取出盖玻片,行S-100免疫组化染色鉴定,具体步骤:(1)10.6 g/L PBS洗涤2遍,3 min/遍.4%(体积分数)多聚甲醛固定液于4 ℃冰箱中固定20 min;(2)滴加3%(体积分数)双氧水去内源性酶活性15 min;(3)兔血清37 ℃孵育30 min;(4)滴加鼠单克隆抗体S-100,4 ℃湿盒中过夜;(5)滴加小鼠二步法检测试剂盒工作液,室温下30 min;(6)滴加DAB液显色3~5 min.以上各步骤之后均以10.6 g/L PBS洗涤2遍,3 min/遍.
2 结果
消化后初接种的细胞呈圆形,原代接种24 h后85%以上的细胞呈椭圆或短梭形,胞体饱满,透光性好,有短小突起,其中仍可见少量胞体较大、轮廓不清、透光性较差的成纤维样细胞,Ara-C作用24 h后,极少见到成纤维样细胞,易于与SCs区分.培养第3 d,SCs开始缓慢增殖,SCs 胞体变得更细长、 狭窄, 突起更长、排列更紧密.培养第8、9天,SCs迅速增殖,细胞密集、融合呈漩涡状.S-100免疫细胞组化染色阳性反应细胞达98%,胞质和突起呈棕褐色,胞核淡染.相差显微镜下不同时间点SCs形态照片和S-100免疫细胞化学染色后的SCs照片见图1~4.
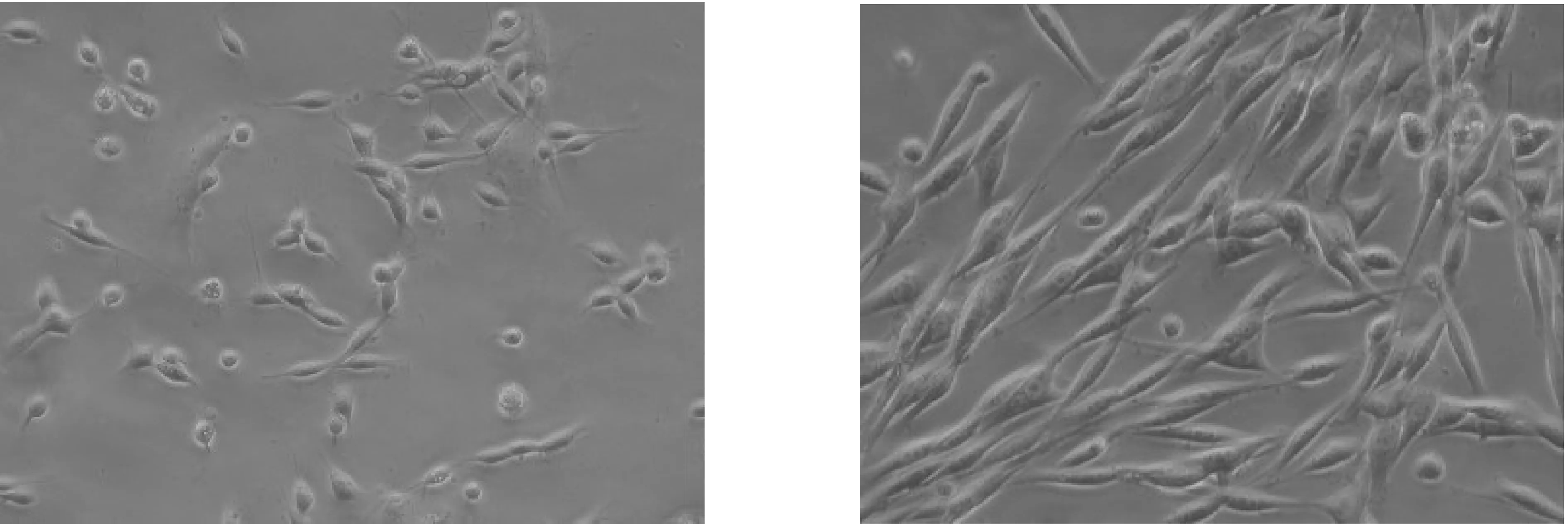
图1 相差显微镜下原代培养24 h雪旺细胞形态(×200) 图2 相差显微镜下原代培养7 d雪旺细胞形态(×400)

图3 相差显微镜下原代培养9 d雪旺细胞形态(×400) 图4 第2代S-100免疫组化阳性细胞(×400)
3 讨论
新生大鼠坐骨神经含结缔组织较少,操作方便,接种后容易贴壁生长,成纤维细胞相对较少,SCs增殖分裂能力比成年大鼠的强[8],但刚出生1~2 d的新生大鼠坐骨神经十分细小,且与周围组织粘连,不易于分离,故选用出生后第5天的.消化时间过长会损害分离出的单个细胞,消化时间过短,分离出的单细胞太少,本试验采用分步消化的方法,避免了消化酶对细胞的过多损害并获取了大量高活性的单细胞.污染细胞主要为成纤维细胞,在光滑玻璃瓶内,成纤维细胞一般在接种后30 min左右开始贴壁,SCs则一般需1 h以上,本实验在传统的差速贴壁方法上做了改进,利用梯度时间点行差速贴壁,在最大程度降低成纤维细胞数量的同时也减少了SCs的丢失,阿糖胞苷是有丝分裂抑制剂,在接种24 h后加入可在成纤维细胞生长高峰期显著抑制其分裂增殖[9],新生鼠细胞增殖能力和速度强,对阿糖胞苷敏感,因此时间从既往的作用48 h缩短到24 h,而雪旺细胞在培养初的几天内增殖缓慢,到第8、9天达到增殖的高峰期,阿糖胞苷对其影响小,从而改良后的实验方法既起到了抑制成纤维细胞的作用,同时对雪旺细胞的扩增无明显影响.该实验通过梯度时间点多次差速贴壁联合24 h阿糖胞苷抑制法获得了高纯度和高活性的雪旺细胞,鼠抗S-100免疫组化证实SCs纯度达到98%.说明通过精细取材,分步消化,阶段差速贴壁法和适时阿糖胞苷抑制法纯化后SCs的纯度得到提高.
SCs作为周围神经系统的髓鞘形成细胞,能分泌生长因子和为轴突生长提供良好的微环境,在轴突延伸过程中兼起接触引导和神经营养作用[2-3],在周围神经再生中起重要的作用,对于周围神经缺损修复有重要意义.SCs体外培养和纯化是进一步研究其分泌蛋白、神经修复功能的前提.本实验所建立的培养和纯化方法在其他研究的基础上有所改进,不仅简单易行而且从最大程度上去除了可能污染的细胞,使细胞得到了纯化,为利用SCs做进一步的研究提供了一定的理论基础.
参考文献:
[1] BIGBEE J W, YOSHINO J E, DEVRIES G H,etal. Morphological and prolife rative responses of cultured Schwann cells following rapid phagocytosis of a myelin-enriched fraction[J].J Neurocytol, 1987,16(4):487-496.
[2] OUDEGA M, XU X M. Schwann cell transplantation for repair of the adult spinal cord[J].J Neurotrauma, 2006,23(3-4):453-467.
[3] TORIGOE K. The role of migratory Schwann cells in nerve regeneration as studied by the film model[J].J Peripher Nerv Syst, 1997,2(3):227-231.
[4] PAPASTEFANAKI F, CHEN J, LAVADAS A A,etal. Grafts of Schwann cells enoneered to express PSA-NCAM promote functional recovery after spinal cord injury[J].Brain, 2007,130(8):2159-2174.
[5] PEARSE D D, SANXHEZ A R, PEREIRA F C,etal. Transplantation of Schwann cells and /or olfactory ensheathing glia into the contused spinal cord: Survival, migration, axon association, and functional recovery[J].Glia, 2007,55(9):976-1000.
[6] FANSA H, KEILHOFF G, FORSTER G,etal. Acellular muscle with Schwann cell implantation: an alternative biologic nerve conduit[J].J Reconstr Microsurg, 1999,15(7):531-537.
[7] JEFFERY D, KOCSIS, STEPHEN G,etal. Schwann cells and their precursors for repair of central nervous system myelin[J].Brain, 2007,130(8):1978-1980.
[8] 潘良春,尹宗生, 王 伟, 等. 新生和成年大鼠雪旺细胞培养、纯化的实验研究[J].中国康复医学杂志, 2005,20(11):817-819.
[9] BROCKES J P, FIELDS K L, RAFF M C. Studies on culture rat Schwann cells: establishment of purified population from culture of peripheral nerve[J].Brain Res, 1979,165(1):105-118.

