新型混配配合物双(3,5-二甲基吡唑)和2,6-吡啶二甲酸合锌的合成及其晶体结构*
朱万仁, 丁树红, 李家贵, 陈 渊, 刘国聪, 朱宇林, 黄肇宇
(玉林师范学院 化学与生物系,广西 玉林 537000)
吡唑类化合物具有良好的除草、杀虫、杀菌活性,因其高效、低毒,以及吡唑环上取代基可以多方位变换,在农药领域得到广泛应用[1~5];对一些吡唑与其它杂环相连的化合物的研究已成为成为当今农药界的热点之一[6]。
多取代吡唑的研究相对较少,为了有效地研制杀虫剂或杀菌剂,本文合成了新型配合物双(3,5-二甲基吡唑)和2,6-吡啶二甲酸合锌[1, Zn(C7H3NO4)(C5H8N2)2],其结构经1H NMR, IR, 元素分析和X-射线单晶衍射分析表征。
1 实验部分
1.1 仪器与试剂
WRS-1B型数字熔点仪(温度计未校正);Bruker AVANCE-500型核磁共振仪(CDCl3为溶剂,TMS为内标);Nicolet-460型红外光谱仪(KBr压片);PE-2400Ⅱ型元素分析仪;Bruker Smart-1000 CCD型X-射线衍射仪。
2,6-吡啶二甲酸,自制;其余所用试剂均为分析纯或化学纯。
1.2 合成
(1) 配体3,5-二甲基吡唑的合成[7]
在三颈烧瓶中加入乙酰丙酮6.0 g(60 mmol)的95%乙醇(25 mL)溶液,搅拌下滴加80%水合肼4.8 g(72 mmol)的95%乙醇(15 mL)溶液, 回流反应4 h。旋蒸浓缩至约15 mL,冷却析晶,抽滤,滤饼用50%乙醇重结晶,干燥得无色片状晶体3,5-二甲基吡唑4.26 g,产率74.1%, m.p.106 ℃~107 ℃;1H NMRδ: 11.20(s, 1H, NH), 2.37(s, 3H, CH3), 2.79(s, 3H, CH3), 5.89(s, 1H, ArH); IRν: 3 212, 1 596, 1 484, 1 428, 1 306 cm-1; Anal. calcd for C5H8N2: C 62.47, H 8.39, N 29.14; found C 61.89, H 8.54, N 28.85。
(2) 1的合成
在三颈烧瓶中依次加入3,5-二甲基吡唑385 mg(4 mmol)的无水乙醇(5 mL)溶液,2,6-吡啶二甲酸334 mg(2 mmol)和碳酸钠212 mg的水(3 mL~5 mL)溶液,无水醋酸锌367 mg(2 mmol)的水(3 mL~5 mL)溶液,搅拌下回流反应30 min。冷却,过滤,滤液移至三角瓶(25 mL)中,用保鲜膜封口,扎两个小孔以利于溶剂挥发,贴上标签,静置培养晶体14 d得无色晶体1。IRν: 3 256, 3 152, 1 602, 1 597, 1 482, 1 426, 1 306, 544, 485 cm-1; Anal.calcd for C17H19N5O4Zn: C 48.30, H 4.53, N 16.57; found C 47.92, H 4.16, N 16.39。
1.3 1的晶体结构测定
取0.25 mm×0.15 mm×0.12 mm的1单晶置于X-射线单晶衍射仪上,用石墨单色化的Mo Kα辐射为光源,于2.65°≤θ≤23.46°收集6 436个强反射数据,其中1 724个为独立衍射点(Rint=0.036 2)。晶体结构由直接法解出,非氢原子的坐标是在以后的数轮差值Fourier合成中陆续确定的,对全部非氢原子的坐标及各向异性参数用SHELXL-97程序以最小二乘法精修F2。
2 结果与讨论
2.1 1的IR分析
在1的IR谱图中,位于3 256 cm-1处的吸收峰归属为吡唑环的N-H键伸缩振动;在3 152 cm-1附近出现吡唑环的C-H伸缩振动吸收;在1 602 cm-1处出现C=O双键的伸缩振动,但已经明显红移;在544 cm-1出现一个振动吸收峰,这主要是锌与吡唑环上的氮形成配位键的伸缩振动产生的吸收[8],这些都说明形成了配合物。
2.2 1的晶体结构解析
1的部分键长和键角见表1;分子结构图,沿c轴方向晶胞图和晶胞堆积图见图1~图3。
晶体结构解析表明,偏差因子R1=0.036 3,wR2=0.098 6。1(C17H19N5O4Zn, Mr=422.76)属单斜晶系,空间群C2/c,晶胞参数a=13.976(5) Å,b=9.541(3) Å,c=14.238(7) Å,α=90.000°,β=111.386(3)°,γ=90.000°,Z=4,V=1 767.8(12) Å3,Dc=1.588 g·cm-3,μ=1.424 mm-1,F(000)=872。差值电子密度最高和最低峰为293 e·nm-3和-279 e·nm-3。
由图1和表1可见,1中吡唑环的各键长:C5-N3, C7-N2, C5-C6, C6-C7, N2-N3在1.334(4) Å~1.390(4) Å,各键长非常接近,介于单双键之间;且吡唑环内角C5-N3-N2, N3-C5-C6, C5-C6-C7, N2-C7-C6, C7-N2-N3在105.5(2)°~111.7(2)°,与五边形内角108° 基本接近,表明此五元环还具有良好的共平面性和共轭性。
由图1和表1还可以看出,1由2个3,5-二甲基吡唑,1个2,6-吡啶二羧基,1个中心Zn(Ⅱ)
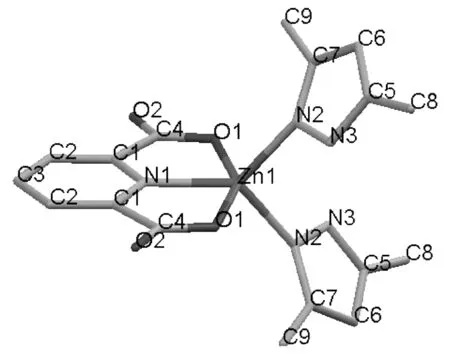
图 1 1的分子结构图

表 1 1的部分键长和键角
离子组成,中心离子Zn(Ⅱ)与2,6-吡啶二羧基形成盐,再分别与2个3,5-二甲基吡唑的N2配位,形成四面体结构。配位键键长O1-Zn1和N2-Zn1分别为2.161(2) Å和2.012(2) Å; 键角N2-Zn1-N2, N2-Zn1-N1, N2-Zn1-O1, N2-Zn1-O1, N1-Zn1-O1,O1-Zn1-O1分别为105.11(13)°, 127.44(7)° , 91.91(9)°, 104.66(8)°, 76.38(6)°和152.76(12)。其中键角O1-Zn1-O1最大,接近153°,是键角N1-Zn1-O1(较小,略微受到挤压)的两倍。
从晶胞堆积图(图3)可以看出,1晶体主要是靠分子间作用力形成的。从图2和图3还能看出,晶体内存在氢键O┈H┈N,这对于稳定整个晶体结构起到了重要的作用, 通过氢键使晶体结构扩展形成三维体型结构。

图 2 沿c轴方向1的晶胞图

图 3 1的晶胞堆积图
3 结论
通过2,6-吡啶二甲酸和3,5-二甲基吡唑为配体,合成了混配配合物1。1属单斜晶系,空间群为C2/c。1中锌离子位于变形六面体的中心,变形六面体的5个顶点分别由来自于2个配体2,6-吡啶二羧基吡啶环上的氮原子和2个甲酸根上的氧原子,以及两个吡唑环上各自一个N原子,组成3N+20型的五配位环境,每个吡唑环均以单齿方式参与配位,而2,6-吡啶二甲羧基作为二双齿配体参与配位,与锌离子发生配位形成混配配合物1。通过氢键使晶体结构扩展形成三维体型晶体结构。
[1] Jennifer A Townes, Adam Golebiowski, Michael P,etal. The development of new bicyclic pyrazole-based cytokine synthesis inhibitors[J].Bioorg Medi Chem Lett,2004,14(19):4945-4948.
[2] Sharp S, Boxall K, Matthews T,etal. Biological evaluation of a novel,synthetic pyrazole class of Hsp90 inhibitors[J].Euro J of Cancer Supplements,2004,2(8):105-108.
[3] 邹小毛,程永浩,任雪玲,等. 新型吡唑腙类化合物的合成[J].有机化学,2005,25(5):554-557.
[4] 刘长令,雷新,刘武成,等. 新型吡唑甲酰脲类化合物的合成及其生物活性[J].合成化学,1997,5:394-398.
[5] 田官荣,房立真,吴明根,等. 稻田除草剂吡唑特的合成和除草效果[J].杀虫剂,2005,44:205-207.
[6] 李梅,王振宁,宋宝安,等. 吡唑类衍生物杀菌活性研究进展[J].农药,2008,47:391-397.
[7] 朱万仁,胡培植,李美英,等. 2,6-吡啶二甲酰双吡唑衍生物的合成[J].合成化学, 2004,12(1): 28-30.
[8] 马卫兴,钱保华,李善忠,等. 混配配合物[Zn(CF3)2(C7H6NS)2]的合成、晶体结构及表征[J].无机化学学报,2006,22(10):1925-1928.

