国家基本药物制度框架下药品电子监管政策研究Δ
丁锦希,李媛,高强(.中国药科大学国际医药商学院,南京市98;.南京市食品药品监督管理局,南京市 98)
国家基本药物制度框架下药品电子监管政策研究Δ
丁锦希1*,李媛1,高强2(1.中国药科大学国际医药商学院,南京市211198;2.南京市食品药品监督管理局,南京市 211198)
目的:为完善我国国家基本药物制度框架下药品电子监管政策提供参考。方法:系统介绍我国药品电子监管政策实施的目的、特点及推行步骤,通过对该政策实施绩效评价及借鉴国外成功经验,得出我国完善该政策的策略。结果与结论:药品电子监管是药品监管的必然趋势,当前的实施工作仍有不足之处。我国应借鉴国外成功经验,与本国实际相结合,进一步完善药品电子监管政策。
国家基本药物制度;药品电子监管;监管码
我国国家基本药物制度于2009年正式启动,并计划于2020年覆盖至全国城乡范围。国家基本药物制度可确保人民群众安全、合理和有效地使用基本药物,是深化“新医改”政策、实现我国“十二五”规划的核心内容之一,也是解决民生问题的重中之重。因此,保障基本药物用药安全意义重大。
进入21世纪以后,随着药品、药店及医疗卫生机构数量的增加及药品安全风险提高,传统药品监管模式日益凸显其不足,而现代电子信息技术则为更新监管形式提供了可能。药品电子监管即运用电子信息化手段对药品实行监管,是国家食品药品监督管理局利用现代信息、网络、编码技术下发给药品生产企业每一件药品唯一的“电子身份证”,并对药品流通全过程实施电子监控。药品电子监管政策实施以来,以其特有的监管模式,有力地保障了国家基本药物制度的顺利推行。然而,在此过程中也出现一些问题需要及时调整。鉴于此,笔者通过评价我国药品电子监管政策的实施效果、分析问题产生原因,并借鉴国外药品电子监管成功经验为我国该项制度的完善提出相关建议。
1 我国药品电子监管政策概述
1.1 政策设计初衷
“齐二药”、“欣弗”系列药害事件引起社会的强烈关注,国家食品药品监督管理局局长邵明立曾表示,我国目前处在药品安全的风险高发期和矛盾凸显期,药品安全亟待提高。
2008年,国家食品药品监督管理局召开新闻发布会,提出建立全国药品监督管理网络,逐步实施药品“电子身份证”监管政策,为国家基本药物制度的推行提供后备支持。该政策以实现药品真假判断、不良反应监测、缺陷药品召回、药品供应商及消费者利益维护为宗旨。因此,本文将对假劣药的打击力度、缺陷药品的召回速度以及对药品供应商利益维护程度作为衡量此项政策实施效果的主要指标。
1.2 功能和特点
在实现药品监控、追溯、预警及药品监督和稽查人员移动执法方面,药品电子监管发挥着强大的功能。其主要特点如下:
(1)唯一性和便利性。药品电子监管码是被标志在药品最小销售单元外包装上的条形码,每件药品被赋予一个号码作为该商品唯一的识别标志。号码长度为20位,1~7位为药品类别码即药品本位码,8~16位为单件序列号,最后4位为加密码。由于任何两件同样类型商品的监管码都不同,因此使得对药品的真假判断、产品追溯召回与跟踪具体到每一件药品上成为可能。
药品电子监管码的唯一性为药品流通带来极大的便利。一方面,药品监管和稽查人员可以通过移动执法系统便利地在现场进行药品信息查询;另一方面,消费者可以通过短信、电话和网络进行监管码的查询,获得包括药品的制剂包装规格、生产企业、生产日期、产品批号及有效期等信息。
(2)全程监控。由于带有电子监管码标志药品的出厂、入库和出库都必须扫码上传数据,因此电子监管使得药品生产、流通和销售各个环节串联起来。药品电子监管网全程采集药品生产源头、流通消费的信息,为实现对产品的质量追溯、责任追究、问题召回和执法打假提供了必要的信息支撑。
(3)预警机制。药品电子监管网会对某种药物短时期内大量售出提示可能的疾病流行或药物滥用预警。当企业超资质生产、经营、药品销售数量异常时发出“红灯警报”,提醒监管部门注意;并且能够对药品入库与出库时数量和品种进行核实,及时发现药品是否流失。
1.3 推行步骤
我国于1979年开始参加世界卫生组织(WHO)基本药物行动计划,1996年首次发布国家基本药物行动计划。为配合国家基本药物制度的开展,2001年我国开始筹备药品电子监管工作;2005年11月1日实施《麻醉药品和精神药品管理条例》。国家食品药品监督管理局于2006年启动建设特殊药品监控信息网络,后又建立起中国药品电子监管网,着手所有入网药品的管理工作。
我国药品电子监管依据“分步实施、稳步推进”的原则,按照从特殊药品、“四大类”药高风险品种、基本药物到全覆盖的目标,分类、分批、分步骤地推进,其具体推进步骤详见表1。

表1 药品电子监管政策推进步骤[1]Tab 1 Implementing steps toward drug electronic supervision policy
2010年7月底,药品生产企业已入网504家,其中有302家企业申请了监管码,293家企业开始通过监管网上报生产数据,共涉及药品1097种;药品批发企业已入网9397家。2010年底,北京、安徽、江西、甘肃、宁夏等省(区、市)生产企业入网率已达100%。截至2011年3月6日,全国3567家基本药物生产企业中,已有1906家办理了入网手续。
2 我国药品电子监管政策实施绩效评价
我国药品电子监管政策从2007年特殊药品监控信息网络启动至今已将近5年。笔者研究发现,国内学者大多从理论方面分析其实施的可行性,本文尝试采用实例从该政策设计角度对其实施前、后做比较分析,从而对其绩效作出客观评价。药品电子监管政策实施绩效评价框架图见图1。
图1 药品电子监管政策实施绩效评价框架图Fig 1 Framework of performance evaluation of drug electronic supervision policy
2.1 我国药品电子监管政策打假力度分析
WHO曾统计,全球药品流通市场上,假药比例高达10%[2],而在我国这一比例更高。假劣药品不仅严重威胁到人们生命安全,而且容易引起巨大的社会恐慌。因此,一个新的监管政策的评价标准很大程度要看其对假劣药的打击程度。本文选取2006-2010年国家食品药品监督管理局查处的假药、劣药案件总量,对药品电子监管政策实施前、后其数量的变化进行分析,详见图2。
图2说明,我国假劣药案件数量逐年呈下降趋势。假劣药案件数量下降受多方面因素影响,然而从图2可知,2007年比2006年下降仅为0.9%;2008和2009年均较之前一年假劣药总量有所下降,下降幅度分别约为18%和26%;效果最为显著的是2010年,假劣药案件总量同比降低63%,而这恰好与药品电子监管政策的实施时间相吻合。2007年10月,麻醉品和一类精神药品纳入药品电子监管网;2008年11月,血液制品、疫苗、中药注射剂和二类精神药品入网,此类药品因售价较高、利润大,发生“窜货”、被造假的可能性较普通药品更大。因此,加入监管网有利于对其流通过程的监控。随着电子监管政策的推行,2010年更多的药品生产流通企业加入到电子监管网中。
药品电子监管政策规定,带有监管码标志的药品从出厂至出库均须扫码,监管范围涉及整个药品流通链条,在任何一个环节出现问题都会及时上报至监管网从而使得假药、劣药的发生率大大降低。
从药品电子监管政策本身机制、假劣药案件较大的下降幅度与该政策实施时间的吻合度可以说明,该政策对打击药品假冒伪劣行为发挥了强大的作用。然而由图2得知,假劣药总量依然庞大,因此该政策的打假力度还有待进一步加强。
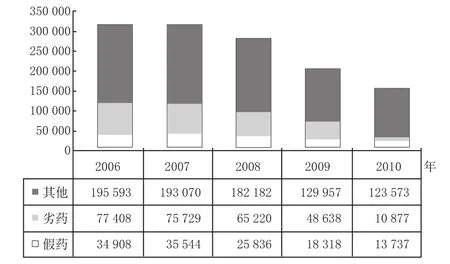
图2 2006-2010年我国假劣药案件总量统计数据来源:中国食品药品监督管理年鉴(2006-2010)Fig 2 Number of adulterated drug and misbranded drug cases in China during 2006-2010data source:China Food and Drug Supervision and Administration Year-book(2006-2010)
2.2 我国药品电子监管政策缺陷药品召回效率分析
药品具有一地生产、全国流通的特点,因此一旦出现缺陷药品,在短时期内快速、大量的召回至关重要。然而,传统的监管制度使得药品召回的成本高、难度大且无法辨析召回的药品是否为发生质量问题和不良反应批次的产品。药品电子监管政策为药品召回提供了新的可能。本文选取2种第二期纳入电子监管中的药品,对其在该政策实施前、后召回的效率作比较分析,详见表2。
2008年10月5日,中药注射剂刺五加注射液出现严重不良反应,10月13日,生产厂家召回涉嫌问题的2批疑似产品2600瓶,包括已销售未使用产品。据悉,该企业生产的刺五加注射液年产量约400万瓶,而此次召回的疑似问题产品不足总量的10%。
2010年5月23日,武汉生物制品研究所发现冻干人用狂犬病疫苗细菌内毒素超出标准规定,决定召回该批产品。截至5月24日24时,召回了全部未使用的2526份。
中药注射剂和疫苗均为第二期纳入我国药品电子监管的药品,因此二者在出现不良反应时召回效率的比较具有代表性。由表2可知,刺五加注射液不良反应事件发生在2008年,尚未加入药品电子监管网;而冻干人用狂犬病疫苗事件发生在2010年,此时疫苗已加入监管网1年多。二者均在全国范围内召回,然而召回所用的时间却相差较大。刺五加注射液用了7天时间才召回10%不到的药品,然而冻干人用狂犬病疫苗仅用1天便实现了对未使用的不良反应药品的全部召回。这得益于药品电子监管政策对药品流通全过程的监督,使得监管人员实时掌握药品流向,对出现问题的药品能够及时、准确的召回。
2.3 我国药品电子监管政策对企业效益作用分析
企业对被纳入药品电子监管所进行的设备、人员配备及生产线改造等投入可以进行量化,如现阶段企业在此方面投入主要分为生产线硬件改造(15~20万元)、人力成本的投入(每年4~6万元),然而该政策给企业带来的保障和收益(如为企业营造良好的市场环境、为企业节省打假费用、信息化成本等)却是难以量化分析的。因此,本文采用实例对现阶段药品电子监管政策对企业的效益影响进行说明。
2009年初,上海信谊制药二厂的5个品种7个规格的二类精神药品纳入电子监管,该厂共投入2条生产线,设备成本18万元,新增人工成本及其他成本4.55万元,其他成本4万元,平摊到单位最小包装上,每最小包装药品成本增加0.031元。但由于实行电子监管后订单增加,产量同比增加35.3%,销售额增加14.8%。
然而,多数基本药物生产企业表示行业本身利润微薄,单个产品增加0.03~0.04元的成本对企业来说难以承受;流通企业因为经营品种多、业务流程复杂,电子监管使其成本急剧增加。广州医药表示该公司在此方面增加费用高达5000万元,在行业总体利润只有8%的情况下,此举影响到1~2个利润点[3]。
以上实例说明,电子监管政策的实施需要企业进行设备的投入和原有生产线的改造,必然会造成生产成本的上涨。政府应该出台相关政策,补偿企业相关投入成本,从而提高企业推行电子监管制度的主动性。

表2 药品电子监管政策实施前后2例不良反应药品召回表Tab 2 Tablet for drug recall of 2ADR cases before and after the implementation of drug electronic supervision policy
3 我国药品电子监管政策实施中存在的问题及原因探讨
本研究结果表明,我国药品电子监管政策实施以来,在打击假劣药、缺陷药品召回及维护企业效益方面取得了一定的成绩。然而,该政策实施以来也同样存在着一些问题。从对打击假劣药力度、缺陷药品召回效率和对企业效益的影响来看,综合起来有以下3点:
3.1 打假力度不足,监管范围有待扩大
首先,药品电子监管政策法律不够完备。现行《药品管理法》尚未涉及药品电子监管的内容,因此监管部门的监管行为只能依据行政命令,缺乏足够的法律依据;就规范内容而言,现有规章主要集中在对药品电子监管的指导性介绍,如监管码式样、入网审批流程等,而在监管内容及相应的处罚方式和处罚程序方面缺乏明确的规定[4]。
其次,覆盖范围较为狭窄。现行药品电子监管仅覆盖了药品生产和流通环节,而占有80%药品销售的医疗卫生机构并未纳入监管范围。其中,乡镇医疗卫生机构恰恰为假药、劣药多发区域。麻醉、精神类药品价格高,利润空间较大,出现假药、劣药的几率更大,但国家药品电子监管尚未覆盖进口麻醉精神类药品。此外,部队医疗卫生机构使用的麻醉精神药品来自于各地区部队药品采购供应单位,在入库时并未进行监管码扫描,因此这些药品的流向无法通过监管网查询[5]。
3.2 企业执行力度不够,降低召回效率
药品电子监管政策在缺陷产品的召回方面取得了显著效果。然而,在实际操作中部分生产企业电子监管码的质量欠佳、打印或贴标不规范,导致手持终端扫码困难,直接影响数据上传速率。药品流通过程中,存在一些企业上传信息、核注核销不及时的问题[6]。
本次调查结果表明,在已实施电子监管的流通企业中,由于对新兴电子监管模式的不适应,大量企业未能及时对药品进行核注核销。这导致监管部门无法及时掌握药品生产流通信息、无法实施远程监管,一旦药品出现不良反应等问题依然只能进行现场排查,失去药品电子监管的动态监管、及时追溯的政策意义。
3.3 企业短期内成本上升,影响经济效益
药品电子监管码政策中对于赋码设备、信息采集设备、相应的人员投入全部由企业消化,企业还要对原有生产线进行重新改造,以实现企业现行企业资源计划(ERP)系统与药品电子监管系统的对接,这直接导致企业运营成本的增加。对一些资金雄厚的企业而言,电子监管对其效益的提升立竿见影。但是一些利润微薄的生产基本药物、大输液的企业表示担忧。由前文可知,实施电子监管码以后,每个包装增加成本将近0.04元。对价格已经压得很低的基本药物来说,增加成本超过0.01元都是难以接受的。而且基本药物本身品种、剂型、手工包装比较多,加印(贴)监管码对企业生产效率也将产生较大影响。
此外,目前市场上电子集成商良莠不齐,有的只顾眼前利益,将赋码系统卖给药品生产企业后不再提供技术支持而使得企业利益受损[7]。作为以盈利为目的企业,如果监管政策的实施对企业发展造成负面影响,势必影响其对监管政策的贯彻执行,对国家基本药物制度的推行也会有阻碍作用。
4 国外药品电子监管政策研究
药品电子监管政策在全球范围内并非新事物,许多国家已经对药品进行电子监管并积累了大量的经验。由于篇幅所限,本文选取几个在药品电子监管方面具有代表性的国家或地区进行分析,以为完善我国的药品电子监管政策提供参考和借鉴。
4.1 美国——强大的法律支撑
美国于2003年开始实行药品电子监管制度,其采用无线射频识别技术(RFID)对药品建立电子谱系(E-Pedigree)[8]。美国最早实行该制度的是加利福尼亚州,慢慢普及至全国。截至2010年1月,美国已在联邦范围内普及并实现了对处方药和非处方药的电子监管。
美国为实施药品电子监管制定了完备的法律,美国食品药品管理局(FDA)也采取积极措施保障此项制度的实施。如,《联邦食品、药品和化妆品法案》第21章中作出相关规定[9],其余23个州也通过了法律要求药品必须有“电子谱”;FDA组建“RFID工作组(RFID Workgroup)”监督RFID技术在药品供应链中的应用,积极主动地发现与这一新技术的应用引起的监管问题;2008年,FDA推出“哨兵行动(Sentinel Initiative)”[10],旨在创建并推行一个全国范围的、综合的电子系统来监测药品安全。
4.2 欧盟——积极的解决方案
欧盟电子监管系统采用的是二维矩阵码(2D Data Matrix Code)技术。与我国药品电子监管一维码相比,二维矩阵码在水平和垂直方向均能存储信息,因此能记录更大量、更清晰的信息。
针对电子监管推行过程中遇到的一些问题,欧洲制药工业协会联合会(EFPIA)提出了改进措施。如,对于系统优先阅读药品包装一维条码信息,造成药剂师不能通过对二维矩阵码系统验证药品的安全性的问题,建议企业将一、二维码距离拉大并优化现有的认证审核系统,使其具有提醒监测的功能[11]。针对监管码本身反应不够准确和灵敏的问题,EFPIA建议配备专业的队伍对编码验证审核监管系统进行定时的检查更新,以确保信息系统的准确性。每个销售终端建立反馈信息的报告日志,若出现异常情况应予以详细记录以便进一步追踪监察[12]。
4.3 韩国——政府的大力支持
韩国电子监管同样采用RFID技术,其最大的特征是政府对企业实行电子监管给予大力支持。如,为让制药公司使用简单的RFID技术,将研发医药用RFID标准产品;研发符合安瓿、PTP包装、液剂、注射包等各种类型医药品的标准RFID标签。并拟对积极执行RFID的制药厂商或零售商额外提供税收优惠。
为实行电子监管,韩国知识经济部在2011年经济政策调整会议上,发布了“RFID推广战略”[13]。韩国政府还颁布了《制药与IT融合发展战略》,该制度的实施将会推动韩国50%以上医药品截止2015年贴上可简易确认、追踪的RFID电子标签[14]。
5 我国药品电子监管政策相关建议
5.1 健全法律法规,扩大监管范围
目前,我国药品电子监管政策正逐步建立、完善,因此必须从我国国情出发,尽快建立系统的、与之相配套的法律法规。为进一步发挥电子监管作用,应尽快将进口药品和销往部队的麻醉和精神药品纳入电子监管范围。考虑到该类药品的特殊性,可采取特殊处理方法,如在监管网体系内对其做一些标注、备注等。
5.2 加强企业执行力度
药品生产、流通企业是实施药品电子监管的主体,该政策实施效果的优劣取决于药品生产、流通企业的执行力度。因此,企业应树立主人翁意识,提高监管码质量和手持终端的精确性以提升二者的匹配程度,减少在扫码环节中出现的问题。此外,可借鉴欧盟电子监管中在销售终端建立反馈信息的报告日志的做法,使企业及时上传数据至药品电子监管网以使国家及时掌握药品流通信息,一旦药品出现问题可以及时、准确地召回。
5.3 企业投入与国家补助相结合
短期看来,企业为实施电子监管所进行的投入等可能会对其经济效益产生影响,但药品电子监管政策对保障企业长期发展的作用毋庸置疑。因此,企业应该积极适应,寻找改进措施。目前,已有企业总结出行之有效的赋码及生产线改造方案,其他企业应多参考实施电子监管中的成功案例,并根据自身情况制定适合自身发展的企业战略。
当然,国家应考虑到不同企业对实施电子监管政策承受能力的差异,可借鉴美国各州根据自身情况对药品实行电子监管梯度化监管措施,给予部分入网企业适当的政策补助以提高企业入网积极性。
6 结语
药品电子监管是保证国家基本药物制度的有力政策,是信息化时代药品监管发展的必然趋势。我国实施药品电子监管政策尚处于起步阶段,但已在打击假劣药品、缺陷药品召回及维护企业权利等方面取得了较好的社会效应。然而,药品电子监管政策的实施需要国家与企业间的通力合作,才能从根本上为国家基本药物制度保驾护航。
[1] 国家食品药品监督管理局.我国基本药物电子监管取得阶段性成果[EB/OL].http://www.sda.gov.cn/WS01/CL0051/60165.html.2011-03-31.
[2] WertheimerA,Norris J.Safeguarding against substandard/counterfeit drugs:Mitigating a macroeconomic pandemic[J].Res Social Adrn Pharm,2009,5(1):4.
[3] 方剑春.基本药物目录药品将进入电子监管时代[N].中国医药报,2010-04-22.
[4] 陈 芳,陈玉文.完善药品电子监管的建议[J].中国食品药品监管,2010,19(16):4.
[5] 姚胜林,彦 玲,刘琳倩,等.利用药品电子监管网提高特药监管效能的研究[J].首都医药,2011,18(6):15.
[6] 庞岳利.切实加强对药品的电子监管[J].中国食品药品监管,2010,19(5):75.
[7] 张建国.电子监管吹响集结号逐步扩展到所有上市药品[N].中国医药报,2010-10-19.
[8] 崔 欣.美国力推药品电子谱系打击假冒伪劣[N].中国防伪报道,2008-04-01.
[9] GPO.Code of Federal Regulations[EB/OL].http://www.gpoaccess.gov/cfr/.2010-01-13.
[10] FDA.The Sentinel Initiative:A National Strategy for Monitoring Medical Product Safety[EB/OL].http://www.fda.gov/Safety/FDAsSentinelInitiative/ucm089474.htm.2011-02-24.
[11] Anthony Barron.EFPIA Product Verification Project[EB/OL].http://www.efpia.eu/Content/Default.asp?PageID=559&DocID=8770.2010-04.
[12] EFPIA.A vision for the coding and identification of pharmaceutical products in Europe[D].version 4.0.EFDIA,2008:1.
[13] 佚 名.韩国步入移动RFID时代[EB/OL].http://intl.ce.cn/hqcy/zxdt/201103/17/t20110317_22307151.shtml.2011-03-17.
[14] 中国经济网.韩国政府出台制药与IT融合战略[EB/OL].http://news.cntv.cn/20110118/105680.shtml.2011-01-18.
Research on Drug Electronic Supervision Policy under the Framework of National Essential Drug System
DING Jin-xi,LI Yuan(School of International Business,China Pharmaceutical University,Nanjing 211198,China)
GAO Qiang(Nanjing Food and Drug Administration,Nanjing 211198,China)
OBJECTIVE:To provide proposals to improve drug electronic supervision policy under the framework of National Essential Drug System.METHODS:This paper presented an in-depth analysis including the purpose,features and implementing steps toward drug electronic supervision policy.Suggestions were made to improve this policy through performance evaluation and introduction of drug electronic supervision policies in other countries.RESULTS&CONCLUSIONS:Drug electronic supervision is a natural trend but still in its infancy.We should combine foreign experience with own conditions to promote this policy.
National essential drug system;Drug electronic supervision;Supervision code
R95
C
1001-0408(2011)48-4513-04
Δ江苏省食品药品监督管理局资助项目(20110016)
*副教授,硕士研究生导师。研究方向:医药政策与法规。E-mail:dingjinxi@yahoo.com.cn
2011-07-24
2011-11-18)

