影响脊柱侧凸患者肺功能的脊柱胸廓畸形指标
郝 冉,吴志宏,韩江娜,孟淑珍,朱元珏,于 斌,王以朋,邱贵兴
中国医学科学院 北京协和医学院 北京协和医院 1呼吸科 2骨科,北京 100730
·论著·
影响脊柱侧凸患者肺功能的脊柱胸廓畸形指标
郝 冉1,吴志宏2,韩江娜1,孟淑珍1,朱元珏1,于 斌2,王以朋2,邱贵兴2
中国医学科学院 北京协和医学院 北京协和医院1呼吸科2骨科,北京 100730
目的研究脊柱侧凸患者的肺功能及影响肺功能的脊柱胸廓畸形指标。方法采用配对研究的方法,将78例先天性和特发性脊柱侧凸患者与正常受试者以性别和年龄1:1配对。测定两组受试者的肺功能和侧凸患者的脊柱胸廓畸形影像学指标。结果脊柱侧凸患者第1秒用力呼气容积和用力肺活量成比例下降,肺总量和功能残气量降低,呈现以肺容积下降为特征的限制性通气功能障碍。弥散量相应降低,单位肺泡弥散量正常或略偏高。气道阻力和气道传导未受累。先天性脊柱侧凸患者除了上述改变外,还出现了气道阻力和残气量的异常。多元线性回归分析显示,受累胸椎数、胸腰椎高度、侧凸度数是肺容积降低的主要影响因素,解释肺容积下降的40%~51%。结论脊柱侧凸患者的肺功能为限制性通气功能障碍伴弥散量降低。累及胸椎数越多、胸腰椎高度越低、侧凸度数越大,肺容积损害越明显。
特发性脊柱侧凸;先天性脊柱侧凸;肺功能;脊柱胸廓畸形
脊柱侧凸是儿童青少年常见的脊柱胸廓畸形疾病。脊柱弯曲和胸廓畸形不仅影响患者外观,更重要的是影响肺脏的正常生长发育,导致不可逆的肺功能损害。严重病例甚至出现呼吸衰竭,生存期缩短。研究显示脊柱侧凸患者肺功能主要呈现限制性通气功能障碍,表现为第1秒用力呼气容积和用力肺活量下降;肺总量降低;弥散量下降[1-2]。上述肺容积降低主要与受累胸椎数和侧凸度数有关[2-5],但相关系数偏低[2,5-6]。其他脊柱胸廓畸形指标比如顶椎位置、胸腰椎高度、顶椎偏距是否也影响肺功能结论尚不一致[4-7]。本研究入组了先天性和特发性脊柱侧凸患者,纠正以往研究只录入青少年特发性脊柱侧凸患者脊柱胸廓畸形较轻的抽样偏倚[2,5],系统研究了肺功能损害特点。除肺量测定和肺容积测定外,还测定了气道阻力和弥散功能。在此基础上,分析各项肺功能指标与脊柱畸形影像学指标间的关系,找出影响肺功能的脊柱胸廓畸形指标。
对象和方法
对象选取2007年7月至2009年8月北京协和医院骨科确诊准备接受脊柱侧凸矫正术的患者78例,男性22例、女性56例,年龄5.9~29.3岁,平均(14.7±3.4)岁。其中特发性脊柱侧凸患者47例,男性5例、女性42例,年龄10.1~20.6岁,平均(14.6±2.5)岁;先天性脊柱侧凸患者31例,男性17例、女性14例,年龄5.9~29.3岁,平均(14.7±4.5)岁。入选标准:(1) 根据全脊柱X光片和体格检查结果,诊断为先天性或特发性脊柱侧凸患者;(2)年龄在6~29岁;(3)未接受过脊柱侧凸矫正术;(4)无神经肌肉疾病,无心脑血管疾病;(5)能配合完成肺功能测定。78例正常受试者为北京地区的学生或工作人员,年龄5.8~29.7岁,平均(14.7±3.5)岁,其中特发性脊柱侧凸对照组年龄10.3~21岁,平均(14.7±2.6)岁;先天性脊柱侧凸对照组年龄5.8~29.7岁,平均(14.7±4.5)岁。入选标准:(1)性别和年龄与侧凸患者配对;(2)无躯体疾病;(3)近4周无呼吸系统症状;(4)无肥胖;(5)不吸烟。
方法采用配对研究的方法,将脊柱侧凸患者和正常受试者以性别和年龄1:1配对。测定两组受试者肺功能和脊柱侧凸患者的脊柱胸廓畸形影像学指标。肺功能测定:使用康讯公司的肺功能仪(LF8 Ganshorn Medizin Electronic GmbH,Germany)。测定方法根据美国胸科学会/欧洲呼吸病学会制定的系列标准[8-11]和儿科肺功能测定标准[12]。最大呼气流速采用用力肺量测定法[13],肺容积和气道阻力测定采用体描箱法[14],弥散测定采用实时气体分析的一口气弥散法[15]。肺功能指标包括用力肺活量(forced vital capacity,FVC)、第1秒用力呼气容积(forced expiratory volume in one second,FEV1)、一秒率(FEV1/FVC%)、最大呼气峰流速(peak expiratory flow,PEF);肺总量(total lung capacity,TLC)、功能残气量(function residual capacity,FRC)、残气量(residual volume,RV)、残总比(RV/TLC%)、气道阻力(airway resistance,Raw)、比气道阻力(speci- fic airway resistance,sRaw)、气道传导(airway conductance,Gaw )、比气道传导(specific airway conductance,sGaw );弥散量(carbon monoxide diffusion capacity,TLCO )、单位肺泡弥散量(diffusion coefficient,KCO )。
脊柱畸形影像学指标:由骨科医师分析站立位全脊柱正位X光片获得,包括累及胸椎数目、胸腰椎高度、侧凸度数、顶椎位置、累及椎体数目、顶椎偏距。侧凸度数测定采用cobb法[16]。
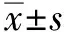
结 果
一般情况特发性脊柱侧凸患者中女性多见,而先天性脊柱侧凸患者中男性多见。脊柱侧凸患者身高(154.47±11.68 )cm较正常受试者( 159.62±10.79 )cm显著降低(P<0.05),体重(43.39±8.83)kg较正常受试者( 54.46±13.11)kg显著降低(P<0.0001)。其中,先天性脊柱侧凸患者身高(149.0±15.3)cm较正常受试者( 159.2±14.1)cm显著降低(P<0.05),体重(42.0±11.9)kg较正常受试者(51.9±14.2)kg显著降低(P<0.05);特发性脊柱侧凸患者体重(44.3±6.0)kg较正常受试者( 56.2±12.2)kg显著降低(P<0.0001),身高(158.1±6.6)cm 与正常受试者(159.9±8.0)cm相比,差异无统计学意义(P>0.05)。
脊柱侧凸患者肺功能与正常受试者比较,脊柱侧凸患者FEV1、FVC、PEF和sRaw降低,sGaw升高(P<0.05,P<0.01),与正常受试者比较,先天性脊柱侧凸患者还出现了Raw升高(P<0.05)(表1)。静态肺容积测定TLC和FRC减低(P<0.01),RV无变化, RV/TLC升高(P<0.01)。其中先天性脊柱侧凸患者出现了RV降低(P<0.05)(表2)。由于脊柱侧凸患者肺容积减小,仅36例完成了弥散功能测定,这组患者TLCO(7.15±1.47)mmol/(min·kPa)较正常受试者(8.54±2.43)mmol/(min·kPa)显著降低(P<0.05),KCO(1.94±0.28)mmol/(min·kPa·L)较正常受试者(1.80±0.26)mmol/(min·kPa·L)显著升高(P<0.05)。
脊柱侧凸患者脊柱胸廓畸形与特发性脊柱侧凸患者比较,先天性脊柱侧凸患者胸腰椎高度更低(P<0.01),侧凸度数更大(P<0.05)。累及胸椎数、顶椎位置、累及椎体数和顶椎偏距差异均无统计学意义(表3)。

表 1 脊柱侧凸患者和正常受试者肺量测定和气道阻力
与正常受试者比较,aP<0.05,bP<0.01
aP<0.05,bP<0.01 compared with normal subjects
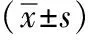
表 2 脊柱侧凸患者和正常受试者肺容积和弥散功能
与正常受试者比较,aP<0.05,bP<0.01
aP<0.05,bP<0.01 compared with normal subjects
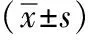
表 3 脊柱侧凸患者脊柱畸形的影像学测量结果
与先天性脊柱侧凸患者比较,aP<0.05,bP<0.01
aP<0.05,bP<0.01 compared with patients with congenital scoliosis
脊柱胸廓畸形对肺功能的影响影响FVC的脊柱畸形指标是累及胸椎数、胸腰椎高度、侧凸度数,它们共同解释了FVC的51%,受累胸椎数越多、胸腰椎高度越低、侧凸度数越大,FVC越低(P<0.01);影响FEV1的指标是累及胸椎数、侧凸度数、顶椎位置,它们共同解释了FEV1的45%,累及胸椎数越多、侧凸度数越大、顶椎位置越高,FEV1越低(P<0.01);影响TLC的指标是累及胸椎数、胸腰椎高度、侧凸度数,它们共同解释了TLC的50%,累及胸椎数越多、胸腰椎高度越低、侧凸度数越大,TLC越低(P<0.01);影响FRC的脊柱畸形影像学指标是胸腰椎高度和累及胸椎数,它们共同解释了FRC的40%,胸腰椎高度越低、累及胸椎数越多,FRC越低(P<0.01)。TLCO和KCO由于病例数限制,多元线性分析显示无相关性(图1)。
讨 论
本研究显示脊柱侧凸患者(包括先天性和特发性)肺功能明显受损,表现为第1秒用力呼气容积和用力肺活量成比例下降,肺总量降低;呈现以肺容积下降为特征的限制性通气功能障碍;弥散量相应降低,而单位肺泡弥散量正常或略偏高;气道阻力和气道传导未受累。先天性脊柱侧凸患者除了上述表现外,还出现了气道阻力和残气量的异常。上述肺功能损害,与脊柱畸形有直接关系。多元线性回归分析显示,受累胸椎数、胸腰椎高度、侧凸度数是肺容积降低的主要影响因素,可以分别解释肺容积(包括FVC、FEV1、TLC、FRC)下降的40%~51%。即累及胸椎数越多、胸腰椎高度越低、侧凸度数越大,肺容积损害越重。而顶椎位置、累及胸椎数目和顶椎偏距与肺功能指标无相关关系。
本研究采用所谓“学科互动”的模式,呼吸科和骨科学者通过互相交流和影响,探讨了影响脊柱侧凸患者肺功能的脊柱胸廓畸形指标。与以往研究比较[2,4-5],本研究录入了先天性和特发性脊柱侧凸患者,目的是纠正以往研究只录入青少年特发性脊柱侧凸患者的抽样偏倚,拓宽肺功能损害和脊柱胸廓畸形的严重程度。 青少年特发性脊柱侧凸患者脊柱胸廓畸形一般较轻,肺功能损害相应较轻,干扰了肺功能与脊柱畸形影像学指标间的相关分析[2,5-6]。再次,肺功能预计值由受试者年龄、性别和身高计算得出。由于脊柱侧凸患者身高发育受到脊柱畸形的影响,一般低于同龄健康人,给预计值计算带来困难[17]。以往研究中,有的学者采用臂展替代身高[6],有的用校正身高[3],使预计值出现偏差,干扰了肺功能与脊柱畸形影像学指标间的相关分析[3,5-6]。本研究直接使用肺功能实测值,避免脊柱侧凸患者身高测量不准确,使用预计值造成的偏差。为验证这一点,本研究尝试用肺功能指标的预计值与脊柱畸形影像学指标进行多元回归分析,以FVC为例,R2由0.51降低到0.31。
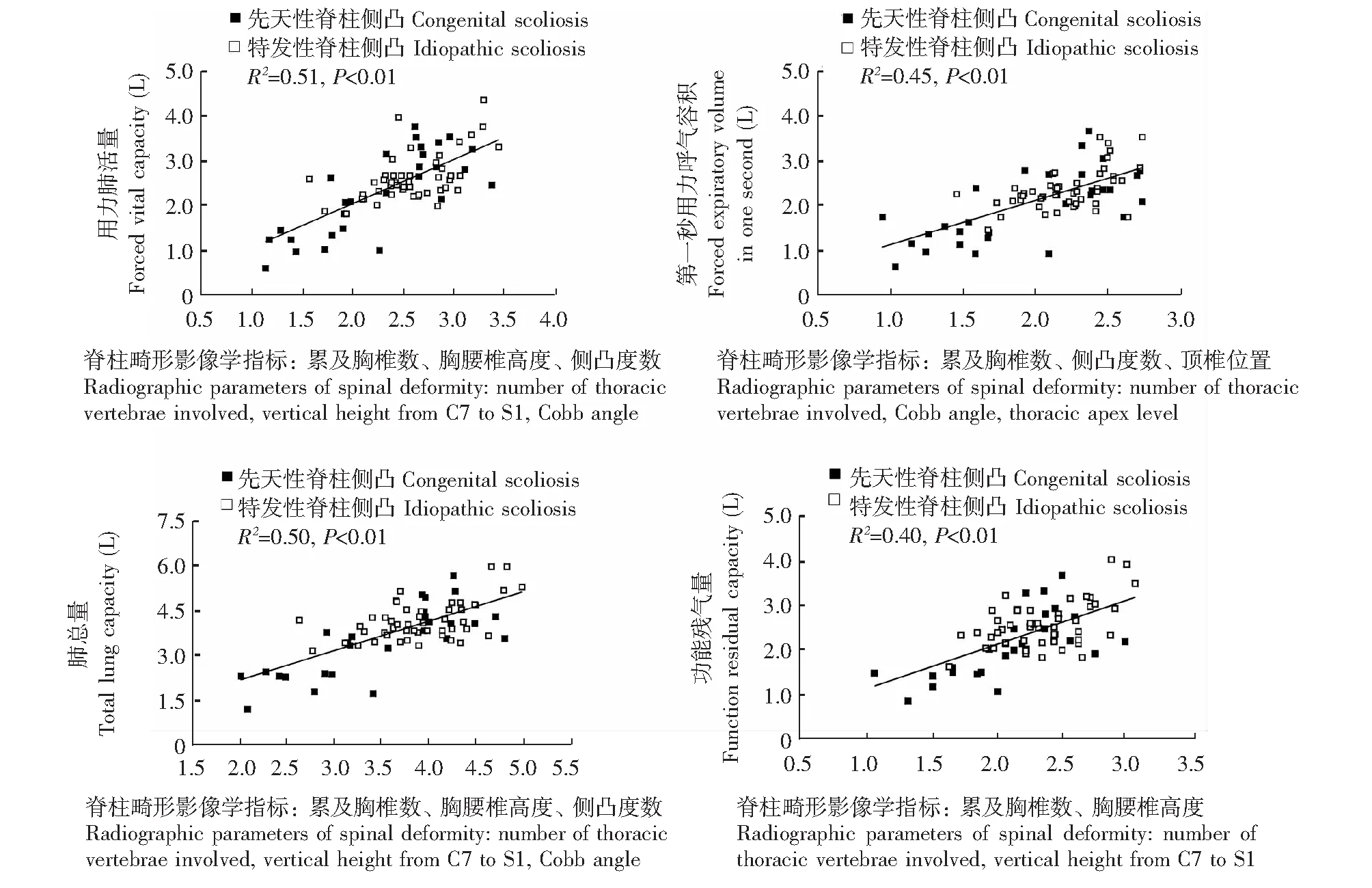
图1 脊柱侧凸患者肺功能指标与脊柱畸形影像学指标间的多元线性回归分析Fig 1 Multiple linear regressions analysis of pulmonary function and radiographic parameters of spinal deformity in patients with scoliosis
有报道严重的脊柱侧凸(侧凸度数115度),由于气管扭曲,可以出现大气道阻塞的肺功能特点[18]。本研究脊柱侧凸患者侧凸度数平均59度(表4),sRaw均数未增大,sGaw均数未下降(表3)。本研究4例侧凸度数>110度,其中3例sRaw增大(占预计133%~164%)。
本研究存在一定局限性。首先,由于脊柱侧凸患者肺容积的减小,仅有不足半数患者完成了一口气法弥散功能测定,内呼吸法弥散功能测定有可能弥补这一缺憾,有待进一步研究补充。其次,本研究筛选出影响肺容积指标的3项脊柱畸形影像学指标,其稳定性和可重复性仍有待大样本量研究证实。
综上,脊柱侧凸患者肺功能呈现以肺容积下降为特征的限制性通气功能障碍。弥散量相应降低,单位肺泡弥散量正常或略偏高。气道阻力和气道传导未受累。先天性脊柱侧凸患者还出现了气道阻力和残气量的异常。上述肺功能损害,与脊柱畸形有直接关系。受累胸椎数、胸腰椎高度、侧凸度数是肺容积降低的主要影响因素,累及胸椎数越多、胸腰椎高度越低、侧凸度数越大,肺容积损害越明显。
[1] Siegler D, Zorab PA. The influence of lung volume on gas transfer in scoliosis [J]. Br J Dis Chest, 1982, 76(1):44-50.
[2] Kearon C, Viviani GR, Kirkley A, et al. Factors determining pulmonary function in adolescent idiopathic thoracic scoliosis [J]. Am Rev Respir Dis, 1993, 148(2):288-294.
[3] Aaro S, Ohlund C. Scoliosis and pulmonary function [J]. Spine, 1984, 9(2):220-222.
[4] 董明岩, 崔宽龙, 陈君长,等.青少年特发性胸段脊柱侧凸患者肺功能受限的决定因素[J].中华骨科杂志,1998, 3(18):134-136.
[5] Newton PO, Faro FD, Gollogly S, et al. Results of preoperative pulmonary function testing of adolescents with idiopathic scoliosis. A study of six hundred and thirty-one patients[J]. J Bone Joint Surg Am, 2005, 87(9):1937-1946.
[6] Upadhyay SS, Mullaji AB, Luk KD, et al. Relation of spinal and thoracic cage deformities and their flexibilities with altered pulmonary functions in adolescent idiopathic scoliosis[J]. Spine, 1995, 20(22):2415-2420.
[7] McMaster MJ, Glasby MA, Singh H, et al. Lung function in congenital kyphosis and kyphoscoliosis[J]. J Spinal Disord Tech, 2007, 20(3):203-208.
[8] Miller MR, Crapo R, Hankinson J, et al. General considerations for lung function testing[J]. Eur Respir J, 2005, 26(1):153-161.
[9] Miller MR, Hankinson J, Brusasco V, et al. Standardisation of spirometry [J]. Eur Respir J, 2005, 26(2):319-338.
[10] Wanger J, Clausen JL, Coates A, et al. Standardisation of the measurement of lung volumes [J]. Eur Respir J, 2005, 26(3):511-522.
[11] Macintyre N, Crapo RO, Viegi G, et al. Standardisation of the single-breath determination of carbon monoxide uptake in the lung [J]. Eur Respir J, 2005, 26(4):720-735.
[12] Hammer J, Eber E. Paediatric pulmonary function testing [M].Basel: Karger, 2005:98-99.
[13] American Thoracic Society. Standardization of spirometry, 1994 update [J]. Am J Respir Crit Care Med, 1995, 152(3):1107-1136.
[14] Dubois AB, Botelho SY, Comroe JH Jr. A new method for measuring airway resistance in man using a body plethysmograph: values in normal subjects and in patients with respiratory disease [J]. J Clin Invest, 1956, 35(3):327-335.
[15] Huang YC, Macintyre NR. Real-time gas analysis improves the measurement of single-breath diffusing capacity [J]. Am Rev Respir Dis, 1992, 146(4):946-950.
[16] Goh S, Price RI, Leedman PJ, et al. A comparison of three methods for measuring thoracic kyphosis: implications for clinical studies [J]. Rheumatology, 2000, 39(3):310-315.
[17] Bjure J, Grimby G, Nachemson A. Correction of body height in predicting spirometric values in scoliotic patients[J]. Scand J Clin Lab Invest, 1968, 21(2):191-192.
[18] Borowitz D, Armstrong D, Cerny F. Relief of central airways obstruction following spinal release in a patient with idiopathic scoliosis [J]. Pediatr Pulmonol, 2001, 31(1):86-88.
SpinalFactorsAffectingPulmonaryFunctioninPatientswithScoliosis
HAO Ran1,WU Zhi-hong2,HAN Jiang-na1,MENG Shu-zhen1,ZHU Yuan-jue1,YU Bin2, WANG Yi-peng2, QIU Gui-xing2
1Department of Respiratory Medicine,2Department of Orthopaedics, PUMC Hospital,CAMS and PUMC,Beijing 100730, China
HAN Jiang-na Tel: 010-65295051, E-mail:janet_han2000@hotmail.com
ObjectiveTo investigate pulmonary function impairment and the spinal factors that may determine pulmonary function in patients with scoliosis.MethodsSeventy-eight patients with idiopathic scoliosis or congenital scoliosis and 78 age- and gender-matched healthy subjects were enrolled in this study. The radiographic parameters of spinal deformity were obtained from patients with scoliosis. Both two groups
pulmonary function tests.ResultsPatients with scoliosis demonstrated a restrictive pattern of pulmonary function impairment with a proportional decrease in both forced expiratory volume in one second and forced vital capacity. Total lung capacity and functional residual capacity were reduced. Carbon monoxide diffusion capacity was decreased, while diffusion coefficient remained normal or slightly higher. Airway resistance and conductance were not affected. In addition, airway resistance and residual volume were found abnormal in patients with congenital scoliosis. Multiple linear regression analysis showed that three spinal factors including involved thoracic vertebrae, vertical height from C7 to S1, and Cobb angle were independently responsible for 40%-51% of total variances of forced vital capacity, forced expiratory volume in one second, total lung capacity, and functional residual capacity.ConclusionsPatients with scoliosis have restrictive ventilation defects. More thoracic vertebrae involvement, lower vertical height, and larger Cobb angle are associated with severer impairment of lung volume.
idiopathic scoliosis; congenital scoliosis; pulmonary function; spinal deformity
ActaAcadMedSin,2011,33(2):194-199
韩江娜 电话:010-65295051,电子邮件:janet_han2000@hotmail.com
R682.3
A
1000-503X(2011)02-0194-06
10.3881/j.issn.1000-503X.2011.02.019
首都医学发展科研基金(2007-2013)Supported by the Medical Science Foundation of Capital (2007-2013)
2010-10-29)

