miR-26a mimics转染人肝癌细胞株HepG2的表达蛋白质组分析*
刘友平, 李 娟, 代荣阳, 段春燕, 陈绍坤, 严冬梅, 陈川宁, 李 洪△
(泸州医学院 1 生物化学教研室,2人类疾病细胞信号与调控四川省高校重点实验室,3 医学生物学与遗传学教研室, 四川 泸州 646000)
·短篇论著·
miR-26a mimics转染人肝癌细胞株HepG2的表达蛋白质组分析*
刘友平1, 李 娟2, 代荣阳1, 段春燕1, 陈绍坤3, 严冬梅1, 陈川宁1, 李 洪1△
(泸州医学院1生物化学教研室,2人类疾病细胞信号与调控四川省高校重点实验室,3医学生物学与遗传学教研室, 四川 泸州 646000)
目的通过分析microRNA-26a(miR-26a)mimics转染对人肝癌细胞株HepG2 表达蛋白质组的影响,以确定miR-26a与肝癌发生发展的相关性。方法常规培养人肝癌细胞株HepG2,经miR-26a mimics转染48 h后进行细胞周期分析,并裂解转染72 h的HepG2细胞提取蛋白,双向电泳分离,匹配对比各蛋白斑点的表达量,筛选主要差异表达蛋白进行质谱鉴定。结果HepG2细胞经miR-26a mimics转染后细胞增殖受到抑制;其蛋白2-DE图谱与对照组比较,差异表达超过2倍的蛋白斑点有11个。其中,有3个蛋白斑点为表达上调,有8个蛋白斑点为表达下调。质谱鉴定为:膜联蛋白A1、过氧化物酶4、增殖细胞核抗原、载脂蛋白A1、细胞色素C 氧化酶5a、细胞周期蛋白E2、磷酸核糖焦磷酸激酶3、周期素依赖性蛋白激酶1和磷脂酰乙醇胺结合蛋白。结论miR-26a可能通过影响上述蛋白分子的表达,直接或间接地调控HepG2肝癌细胞的增殖、分化和死亡,以发挥其抗癌作用。
miR-26a mimics; 微小RNA; HepG2细胞; 蛋白质组
微小RNA(mircoRNAs,miRNAs)是一类长度为21-23 核苷酸,进化上比较保守的非编码单链小RNA 分子,可识别特异的mRNA,影响靶mRNA 的稳定性或抑制其翻译,进而调节靶基因的表达,参与调控细胞的增殖、分化、发育、死亡和代谢等生理过程[1,2]。目前预测人类基因组中约有1 000个miRNA,它们可能对约30%的人类基因转录本起调控作用。超过50%的miRNAs基因位于癌症相关基因组区域或脆性位点上[3]。新近研究表明miRNAs异常表达与肿瘤的发生、发展密切相关,不同类型的肿瘤具有特异的miRNAs异常表达谱[4,5],它们与肿瘤的发生、病理分级、临床分期、耐药性及预后等密切相关。
miR-26a在多种组织中广泛表达,但对于其生物学功能还知之甚少[6]。目前多项研究证实,miR-26a在多种恶性肿瘤中表达失调[7,8],并可能参与了肿瘤的发生和发展过程。已有研究指出,miR-26a在正常肝脏中呈高丰度表达,但在肝细胞性肝癌(hepatocellular carcinoma,HCC)中表达却显著下调[9],其分子机制不详。本实验以人肝癌细胞株HepG2为研究对象,采用比较蛋白组学的研究技术并结合质谱(MS)鉴定技术,筛选和鉴定经miR-26a mimics转染后肝癌细胞株HepG2的差异表达蛋白质,以便为进一步研究miR-26a参与肝癌发生发展的分子机制提供线索。
材 料 和 方 法
1材料
1.1实验对象 人肝癌细胞株HepG2,购自中国科学院上海生命科学研究院。
1.2主要试剂和仪器 miR-26a mimics及对照的mimic购自上海吉玛制药技术有限公司,miR-26a mimics序列为 5’-UUCAAGUAAUCCAGGAUAGGCU-3’,阴性对照的mimic序列为 5’-UUCUCCGAACGUGUCACGUTT-3’;DMEM培养基购自Sigma;丙烯酰胺、甲叉双丙烯酰胺、三羟甲基氨基甲烷、超纯尿素、二硫苏糖醇、CHAPS、甘氨酸、TEMED、TBP、过硫酸铵、十二烷基磺酸钠、固相pH梯度干胶条(pH 3-10,17cm)和矿物油购自Bio-Rad;蛋白分子量marker和苯甲基磺酰氟(PMSF)购自碧云天生物技术研究所;其它常规试剂均购自GE Healthcare。低温台式离心机(TDZ4-WS)购自长沙湘仪离心机仪器有限公司;双向电泳系统、ChemiDoc XRS蛋白凝胶成像系统购自Bio-Rad;EPICS流式细胞仪。
2方法
2.1细胞培养及细胞周期分析 HepG2肝癌细胞用含10%胎牛血清的DMEM培养基,在37 ℃、5% CO2条件下培养。传代培养至细胞对数生长期,随机将细胞分为对照组和实验组2组。采用脂质体转染法将miR-26a mimics和对照mimics分别转染实验组和对照组HepG2细胞24 h后,细胞置于无血清DMEM培养基中饥饿12 h,饥饿后换用DMEM完全培养基继续培养。12 h后离心收集细胞,弃上清,用预冷PBS洗细胞2次,加入预冷70%乙醇,于4 ℃固定过夜。离心收集细胞,PBS洗细胞1次,加入PBS溴化乙啶染色液(含50 mg/L PI, 100 mg/L RNase A, 0.2% Triton X-100)37 ℃避光孵育30 min,流式细胞仪检测。
2.2细胞转染及细胞蛋白提取与定量 HepG2肝癌细胞培养条件同上,至细胞对数生长期,随机将细胞分为对照组和实验组2组。转染试剂为Lipofectamine 2000,具体方法如下:以合适的密度将HepG2接种到6孔培养板上,12 h后细胞达到80%-90%的融合后进行转染。用无血清培养基245 μL分别稀释Lipofectamine 2000(5 μL)和miR-26a mimics(5 μL)或对照mimics(5 μL)。温育5 min后,混合稀释好的Lipofectamine 2000和mimics,指弹法混匀,温育25 min后分别加入细胞培养液。细胞在37 ℃、5%CO2中孵育6 h后更换正常培养基,HepG2细胞继续培养66 h。对照组和实验组HepG2细胞用0.25%的胰酶消化并离心。PBS液重悬细胞并转移至EP管内(每组各收集1管),10 000 ×g离心5 min。各EP管加细胞裂解液(8 mol/L 尿素,4% CHAPS,5 mL/L Bio-lyte 3/10,1‰TBP)300 μL,冰浴30 min(其间间断振荡2-3次)后13 000 ×g离心30 min。上清液采用Brandford法测定蛋白浓度。重复细胞转染过程并分批收集细胞3批。
2.3蛋白质组双向电泳分离 各组蛋白样品150 mg,加水化液(8 mol/L 尿素,4% CHAPS,DTT 10 g/L,Bio-lyte 3/10 5 mL/L,0.1%溴酚蓝 痕量)至总量350 μL/胶条,混匀后加入水化槽,放上pH 3/10的IPG胶条,1 h后加入矿物油覆盖胶条过夜。将水化后的胶条转移至等电聚焦(IEF)电泳系统(Bio-Rad),于17 ℃进行聚焦,程序设置为250V,2 h → 500 V,1 h → 1 000 V,1 h → 5 000 V,2 h →10 000 V,总伏时数6万伏时结束IEF电泳。平衡2次后用10%SDS聚丙烯酰胺凝胶按照Bio-Rad公司说明书进行第二向电泳分离。最后采用银染法进行染色获得2-DE图谱。每批细胞蛋白重复双向电泳3次。
2.4凝胶成像及双向电泳图谱分析 将染色后的凝胶置ChemiDoc XRS凝胶成像系统中照相成像。采用ImageMaster 2D Platinum 5.0(Amersham) 双向电泳图谱分析软件进行斑点自动识别、半定量检测及配对分析。获得各蛋白斑点的实验等电点(isoelectric point,pI)和分子量(molecular weight,MW),筛选每批比较标准化总灰度值(%Vol)均相差2倍及以上的蛋白斑点,采用基质辅助激光解析电离-飞行时间质谱仪(MALDI-TOF-MS)进行质谱检测。质谱检测和蛋白斑点的匹配鉴定由北京华大中生科技发展有限公司完成。
3统计学处理
数据的统计分析在Excel及SPSS 11.0软件上进行。
结 果
1miR-26amimics转染后细胞的生长状态
实验组和对照组HepG2肝癌细胞在未处理之前生长状态相当,且均处于对数生长期。细胞分别经miR-26a mimics和对照mimics处理48 h后,用流式细胞仪检测各组细胞周期情况,可见HepG2经miR-26a mimics处理后细胞增殖明显受到抑制(P<0.05,n=5),见图1。
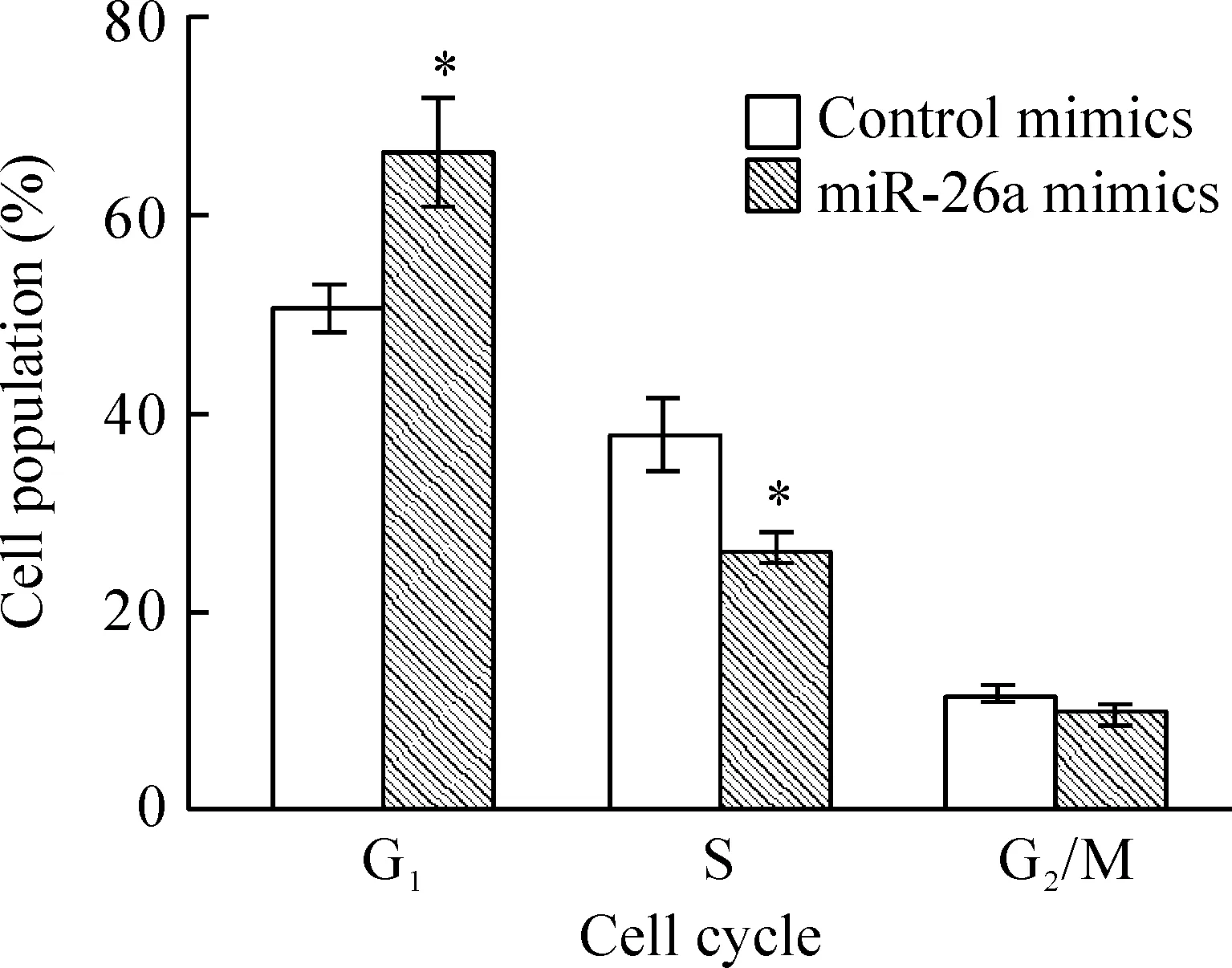
Figure 1. Phases of the cell cycle of HepG2 cells treated with or without miR-26a mimics for 48 h. Cell population of each phase was measured using flow cytometry.±s.n=3.*P<0.05 vs control value.
2双向电泳及蛋白斑点匹配分析
HepG2肝癌细胞表达蛋白质组经双向电泳分离和银染后获得的2-DE图谱见图2。各蛋白斑点分离较好,大多数分布在pI 4-8,分子量20-85 kD的范围内。经ImageMaster 2D Platinum 5.0软件分析,对照组共有可稳定重复的蛋白斑点(1 345±65)个,实验组共有可稳定重复的蛋白斑点(1 220±48)个,对照组与实验组自动匹配配对(883±31)对,匹配率约72%。
图2和图3中箭头所示为每批3次双向电泳结果均出现标准化总灰度值(%Vol)相差达2倍以上的蛋白斑点。图3A、C、D为对照mimics转染HepG2 72 h后的双向电泳结果,图3 B、D、F为miR-26a mimics 转染HepG2 72 h后的双向电泳结果。从图3和表1可见:蛋白点1、2和4的表达明显上调,而蛋白点3、5、6、7、8、9、10和11的表达则明显下调。
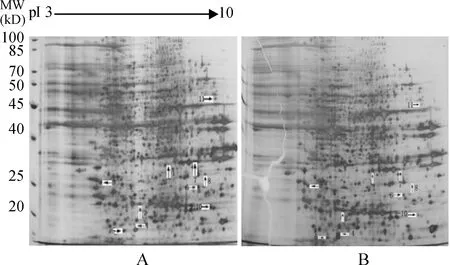
Figure 2. The two-dimensional electrophoresis patterns of HepG2 cells with control mimics treatment(A) and HepG2 cells with miR-26a mimics treatment(B). The proteins over/under-expressed by more than 2 folds between the two groups were shown by the arrows.

Figure 3. The enlarged images of the 11 identified protein spots with differential expression levels between control group and miR-26a mimics treatment group(A,C and E were control group; B,D and F were miR-26a mimics treatment group; arrows showing the corresponding spots or location ).Spot 1,2 and 4 were obviously over-expressed while spot 3, 5, 6, 7, 8, 9, 10 and 11 were under-expressed in miR-26a mimics treatment group compared with control group.
3蛋白斑点的质谱鉴定
采用MALDI-TOF-MS分别对图3中11个差异表达的蛋白斑点进行肽指纹图谱分析。使用NCBInr蛋白质数据库在Mascot搜索引擎(http:∥www. matrixscience.com)上进行数据解析,搜索物种(species search)为人,将所搜索到的结果, 结合双向凝胶电泳相应点的表现:等电点、分子量及质谱匹配肽段的多少( 3个片段以上)和覆盖率(>13%) 以及蛋白检索得分进行综合分析,共鉴定出9种蛋白。其中,斑点9和10为同一种蛋白,斑点6未获鉴定结果,具体相关信息见表1。
讨 论
国内外研究发现,肝癌中存在miRNAs的异常表达,因而推测miRNAs参与了肝细胞癌变的病理过程[4]。根据差异表达的miRNAs来区分肝癌组织与正常组织的精确度远远高于差异表达的编码基因。由此可见,把关键miRNA作为肝癌生物诊治的靶分子可能会比把编码基因作为靶分子更加有效[10,11]。
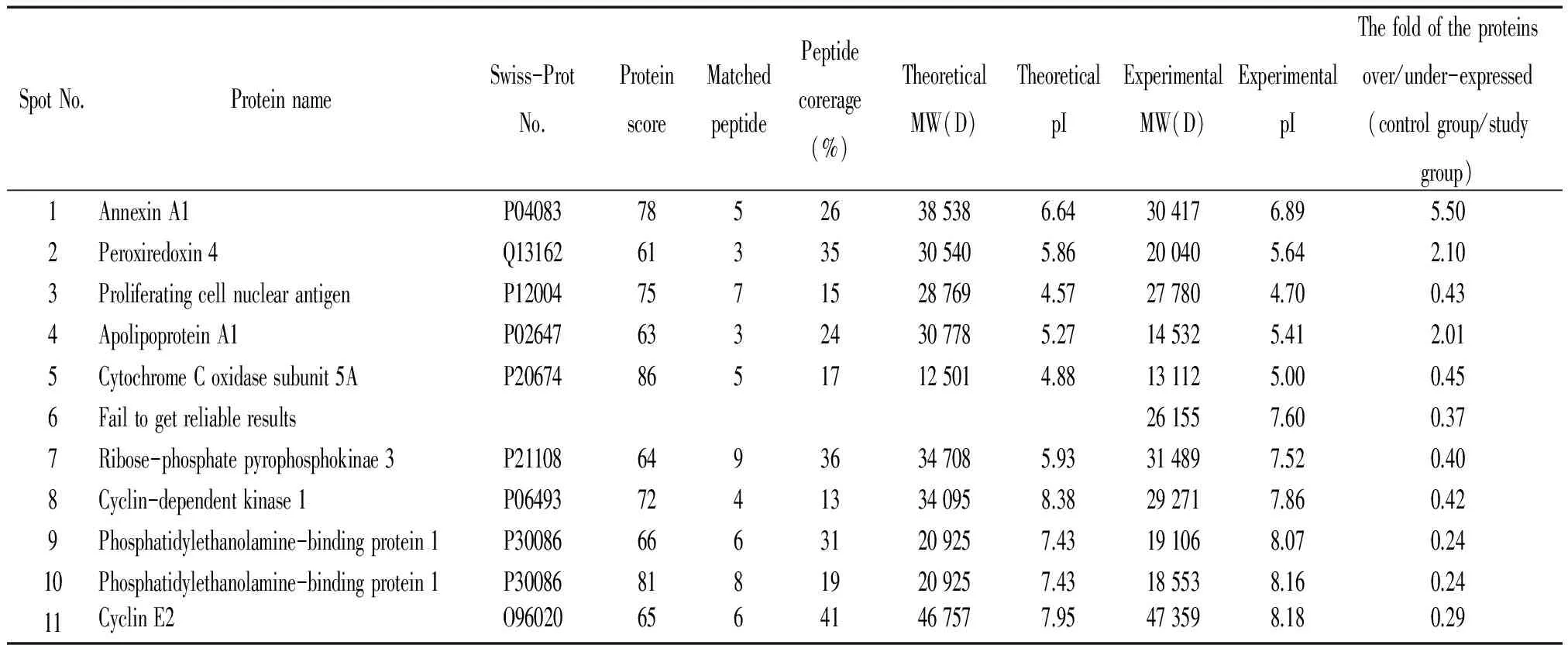
表1 差异表达蛋白斑点的质谱鉴定结果
本实验通过双向电泳和质谱技术对HepG2肝癌细胞中miR-26a mimics转染后表达蛋白组的变化进行了分析,对标准化总灰度值相差达2倍以上的差异表达蛋白斑点进行质谱鉴定,发现这些蛋白质为:膜联蛋白A1、过氧化物酶4、增殖细胞核抗原、载脂蛋白A1、细胞色素C氧化酶5a、磷酸核糖焦磷酸激酶3、周期素依赖蛋白激酶1、磷脂酰乙醇胺结合蛋白和周期素E2。其中,膜联蛋白A1、过氧化物酶4和载脂蛋白A1(蛋白斑点1、2、4)的表达明显上调,而增殖细胞核抗原、细胞色素C氧化酶5a、磷酸核糖焦磷酸激酶3、周期素依赖蛋白激酶1、磷脂酰乙醇胺结合蛋白和周期素E2(蛋白斑点3、5、7、8、9、10、11)的表达则明显下调,见图3。
膜联蛋白A1是钙和磷脂结合蛋白,在很多方面发挥重要生物学功能,参与细胞增殖和死亡信号的调节、凋亡细胞的吞噬以及肿瘤的发生与发展,具有抗细胞增殖和诱导凋亡的作用。已有研究表明,膜联蛋白A1的抗增殖作用是通过激活MAPK/ERK信号途径实现的。若通过基因转染,使膜联蛋白A1过度表达,可以减弱细胞的生长和克隆形成能力,并且增加细胞凋亡[12]。本实验发现肝癌细胞HepG2经miR-26a mimics转染后表达量出现明显上调,见图3 C、D。可见,膜联蛋白A1可能参与了miR-26a抵抗肝癌细胞HepG2的增殖和诱导HepG2发生凋亡的作用。
周期素是调控细胞周期和变构激活周期素依赖性蛋白激酶(CDKs)所必需的调节亚基[13]。以周期素为核心的G1/S期细胞周期网络的调控系统,是肿瘤发生和发展中最常改变的共同通路。目前已发现在哺乳动物细胞中有大约20种周期素和10种CDKs。其中周期素E2的表达水平在非转化的细胞中几乎难以检测到,而在肿瘤源性细胞中周期素 E2 mRNA的表达则明显高于正常对照[14]。本实验中,肝癌细胞HepG2经miR-26a mimics转染后周期素 E2的表达出现明显下调,见图3 E、F,此结果不仅与相关的文献报道相符,而且进一步证实了miR-26a的高表达可能通过下调周期素D2 和周期素E2的水平来抑制肝癌细胞的细胞周期,从而发挥其抑癌作用[9]。
增殖细胞核抗原(PCNA)是DNA复制所必需的一种聚合酶的附属蛋白,对细胞由G1期向S期过渡起调节作用,其含量的变化与细胞增殖的进程同步,可作为衡量细胞增殖状态的客观指标之一[15]。一般认为,肿瘤分化程度越低,其增殖能力越强,PCNA表达也越高。本实验发现,肝癌细胞HepG2经miR-26a mimics转染后PCNA的表达量出现明显下调,见图3 A、B,说明miR-26a可通过调控PCNA的表达而参与肿瘤细胞的增殖、分化、凋亡和周期调控。除此之外,经miR-26a mimics转染后CDK1和磷脂酰乙醇胺结合蛋白的表达量也出现明显下调,见图3 C、D,相关报道证实它们也与细胞周期调控相关[16,17]。
肿瘤的发生发展与细胞增殖和凋亡的失调密切相关。本实验通过表达蛋白质组学技术发现肝癌细胞HepG2经miR-26a mimics转染后出现显著差异表达的蛋白质参与了细胞的增殖、分化、凋亡调节及细胞代谢等生理活动,见表1。表达上调的蛋白,如膜联蛋白A1主要起促进细胞凋亡的作用。而表达下调的蛋白,如PCNA、cyclin E2、CDK1和PEBP1主要参与细胞周期的调控。因此,miR-26a可能通过调控这些蛋白的表达,参与肝癌细胞周期的调控以抑制肝癌细胞的增殖,从而达到抑制肝癌的发生发展,这与结果图-1较吻合。通过对这些差异表达蛋白质分子机制的深入研究,将为阐明miR-26a的抗癌作用提供进一步的线索和依据。
[1] Kato M, Slack FJ. microRNAs: small molecules with big roles-C.elegansto human cancer [J]. Biol Cell, 2008,100(2):71-81.
[2] 邹 健, 于晓峰, 虞 阳,等. MicroRNA在人结肠癌干细胞中的表达谱[J]. 世界华人消化杂志,2010,18(2):173-178.
[3] 王旭丹,杨惠玲,郭禹标,等. 不同辐射抗拒鼻咽癌细胞微小RNA差异表达的研究[J]. 中国病理生理杂志,2007,23(6):1045-1048.
[4] Ji J, Shi J, Budhu A, et al. MicroRNA expression, survival, and response to interferon in liver cancer [J]. N Engl J Med, 2009,361(15):1437-1447.
[5] 李育敏,费 嘉. MicroRNA与血液系统肿瘤发生、诊断和治疗[J]. 中国病理生理杂志,2009,25(11):2225-2229.
[6] Calin GA, Sevignani C, Dumitru CD, et al. Human microRNA genes are frequently located at fragile sites and genomic regions involved in cancers [J].Proc Natl Acad Sci USA, 2004, 101(9):2999-3004.
[7] Yanaihara N, Caplen N, Bowman E, et al. Unique microRNA molecular profiles in lung cancer diagnosis and prognosis [J]. Cancer Cell, 2006,9(3):189-198.
[8] Visune R, Pallante P, Vecchione A, et al.Specific microRNA are downregulated in human thyroid anaplastic carcinomas [J].Oncogene, 2007,26(54):7590-7595.
[9] Kota J, Chivukula RR, O’Donnell KA, et al. Therapeutic microRNA delivery suppresses tumorigenesis in a murine liver cancer model [J]. Cell, 2009,137(6):1005-1017.
[10]Murakami Y, Yasuda T, Saigo K, et al. Comprehensive analysis of microRNA expression patterns in hepatocellular carcinoma and non-tumorous tissues [J]. Oncogene, 2006,25(17): 2537-2545.
[11]Zhang B, Pan X, Cobb GP, et al. microRNAs as oncogenes and tumor suppressors [J]. Dev Biol, 2007,302(1):1-12.
[12]Hsiang CH, Tunoda T, Whang YE, et al. The impact of altered annexin I protein levels on apoptosis and signal transduction pathways in prostate cancer cells [J]. Prostate, 2006, 66(13):1413-1424.
[13]Loeb KR, Kostner H, Firpo E, et al. A mouse model for cyclin E-dependent genetic instability and tumorigenesis [J]. Cancer Cell, 2005,8(1):35-47.
[14]薛惠平, 倪培华, 吴洁敏,等. 细胞周期蛋白 E2基因 mRNA在胃癌组织中的表达[J]. 上海交通大学学报(医学版), 2007,27(1):95-98.
[15]Taftachi R, Ayhan A, Ekici S, et al. Proliferating-cell nuclear antigen(PCNA) as an independent prognostic marker in patients after prostatectomy: a comparison of PCNA and Ki-67 [J]. BJU Int, 2005,95(4):650-654.
[16]Zhao XF, Gartenhaus RB. Phospho-p70S6K and cdc2/cdk1 as therapeutic targets for diffuse large B-cell lymphoma [J]. Expert Opin Ther Targets, 2009,13(9):1085-1093.
[17]罗新华, 杨 勤, 张 权,等.肝纤维化组织相关功能蛋白质组的差异分析[J]. 中华医学杂志,2007,87(48):3411-3414.
AnalysisofexpressiveproteomeinhumanhepatocarcinomacellHepG2transfectedwithmiR-26amimics
LIU You-ping1, LI Juan2, DAI Rong-yang1, DUAN Chun-yan1, CHEN Shao-kun3, YAN Dong-mei1, CHEN Chuan-ning1, LI Hong1
(1DepartmentofBiochemistry,2KeyLaboratoryofSichuanCollegesandUniversitiesforCellSignalandRegulationinHumanDiseases,3DepartmentofMedicalBiologyandGenetics,LuzhouMedicalCollege,Luzhou646000,China.E-mail:lihong7188@163.com)
AIM: To determine whether microRNA-26a(miR-26a) is involved in development of liver cancer by analysis of proteomic expression profile of human hepatocarcinoma cell HepG2 transfected with miR-26a mimics.METHODSHepG2 cells were cultured by a routine method and transfected with miR-26a mimics for 48 h for cell cycle analysis. The expressive proteome profiles of HepG2 cells with or without miR-26a mimics treatment were established by the methods of two-dimensional electrophoresis separation following lysis of the cells and extraction of the proteins. The proteomic expression profiles were analyzed by comparative proteomics technique to discover the important protein spots with differential expression. The identification of the proteins was conducted by matrix-assisted laser desorption/ionization time-of-flight mass spectrometry(MALDI-TOF-MS).RESULTSmiR-26a brought down the proliferation of HepG2 cells. Total 11 protein spots with alteration of expressive amounts more than 2 times were successfully identified in the proteomic expression profile of HepG2 cells treated with miR-26a mimics, including annexin A1, peroxiredoxin 4, proliferating cell nuclear antigen, apolipoprotein A1, cytochrome C oxidase subunit 5A, cyclin E2, ribose-phosphate pyrophosphokinase 3, cyclin-dependent kinase 1 and phosphatidylethanolamine-binding protein 1. Among these, the expression of 3 protein spots was up-regulated and 8 of them was down-regulated.CONCLUSIONmiR-26a contributes to the anti-cancer effect by expressive regulation of the proteins mentioned above, or directly or indirectly controls the proliferation, differentiation and death of hepatocarcinoma cells.
miR-26a mimics; microRNA; HepG2 cells; Proteome
Q291
A
10.3969/j.issn.1000-4718.2011.02-029
1000-4718(2011)02-0367-05
2010-08-02
2010-10-23
国家自然科学基金资助项目(No.81000886);四川省教育厅科技基金资助项目(No.09ZA050);四川省卫生厅科技基金资助项目(No.2007-431)
△通讯作者 Tel:0830-3160283; E-mail: lihong7188@163.com

