siRNA沉默LBH基因促进人支气管上皮细胞周期进展*
刘启才, 王颖峰, 杨春祥, 李晓艳, 彭 燕, 彭 杰, 李 冰, 李 立
(1广州医学院实验医学研究中心, 广东 广州 510182; 2荆门市第二人民医院神经内科, 湖北 荆门 448000;3中山大学附属第一医院肾内科,4华南肿瘤学国家重点实验室,中山大学肿瘤防治中心影像介入科, 广东 广州 510060)
siRNA沉默LBH基因促进人支气管上皮细胞周期进展*
刘启才1△, 王颖峰1, 杨春祥2, 李晓艳3, 彭 燕1, 彭 杰1, 李 冰1, 李 立4△
(1广州医学院实验医学研究中心, 广东 广州 510182;2荆门市第二人民医院神经内科, 湖北 荆门 448000;3中山大学附属第一医院肾内科,4华南肿瘤学国家重点实验室,中山大学肿瘤防治中心影像介入科, 广东 广州 510060)
目的利用合成的小分子干扰RNA(siRNA)转染人支气管上皮细胞16HBE,观察LBH(limb-bud and heart) 基因表达下调对16HBE细胞周期及相关基因表达的影响。方法脂质体2000转染靶向LBH基因的siRNA到16HBE细胞,荧光定量RT-PCR检测siRNA转染后LBH基因表达,流式细胞术检测LBH基因沉默后16HBE 细胞周期的改变,荧光定量RT-PCR及Western blotting检测LBH基因沉默后细胞周期素E1和E2表达水平。结果50 nmol/L siRNA转染16HBE细胞48 h后,LBH基因的表达水平只有对照组的14%;siRNA转染16HBE细胞48 h,其G1期细胞百分率比对照组减少9.28%,而S期细胞百分比增加14.08%;16HBE细胞在50 nmol/L siRNA的转染后,细胞周期素E2的表达水平为对照组的2倍,而细胞周期素E1的表达没有发生明显改变。结论靶向于LBH基因的siRNA能有效沉默16HBE细胞中LBH基因的表达,LBH基因的表达下调促进了16HBE细胞周期G1/S期的进展;细胞周期素E2的表达上调参与了LBH沉默导致的细胞周期G1/S期的进展。
RNA干扰; 基因,LBH; 16HBE细胞; 细胞周期
应用抑制性消减杂交获得鼻咽癌组织和细胞系中的表达下调基因表达序列标签(expressed sequence tags,ESTs) NP9(GenBank No.BF718797)[1,2],通过序列同源比对,发现其序列与肢体及心脏早期发育过程中一种保守核蛋白表达基因(limb-bud and heart,LBH)[3]的同源性高达99%。研究发现LBH基因是脊椎动物中一个序列高度保守的组织特异性转录共活化因子(co-activator),其在胚胎发育中发挥重要作用[3-5]。前期研究结果提示与LBH同源的NP9基因的表达可通过下调增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)和细胞周期素D1(cyclin D1)来抑制鼻咽癌细胞的裸鼠成瘤[6],而对其在肿瘤发生中的作用和机制所知甚少。我们以LBH基因正常表达的人支气管上皮细胞16HBE为模型[1],通过基因沉默技术使LBH表达下调,观察其沉默对16HBE细胞周期的影响并初步分析其机制,为阐明LBH基因的功能和探讨该基因下调在肿瘤发病中的作用提供必要的理论依据。
材 料 和 方 法
1材料
1.1细胞系 人支气管上皮细胞系16HBE由广州医学院实验医学研究中心保存和复苏。
1.2主要试剂 RPMI-1640培养基、胎牛血清及总RNA提取试剂Trizol、转染试剂Lipofectamine2000和逆转录试剂盒为Invitrogen产品;荧光定量RT-PCR试剂盒为Stratagen产品。抗cyclin E1多克隆抗体为Alphagenix产品、抗cyclin E2及抗GAPDH抗体购自CST。
2方法
2.1siRNA合成 根据siRNA序列设计原则,利用Ambion公司网站(http://www.ambion.com/techlib/misc/siRNA_finder)提供的siRNA设计工具,获得沉默LBH基因(GenBank No. NM_030915)的靶序列AAGATGACTGAGGTGATGATG,根据靶序列合成正义和反义RNA链,序列分别为5′- GAUGACUGAGG UGAUGAUGTT -3′和3′- TTCUACUGACUCCACUACUAC -5′。提交序列给Ambion公司合成dsRNA.
2.2细胞培养及siRNA转染 16HBE细胞培养于含10%胎牛血清的RPMI-1640培养液中,于37 ℃、5% CO2的培养箱中常规培养。处于对数增长期的16HBE细胞按3×106cells/well接种6孔板后常规培养,待细胞生长至90%融合度时,分别以25 nmol/L、50 nmol/L和100 nmol/L的特异siRNA及非特异siRNA转染细胞,非特异siRNA用来阴性对照。转染时每孔按对应的浓度取一定量的siRNA和4 μL Lipofectamine 2000分别溶于250 μL无血清Opti-MEM 培养基中,待Lipofectamine 2000溶解5 min后,将脂质体溶液与siRNA溶液混合,室温放置20 min,最后将两者的混合液加入含2 mL的完全培养液的6孔细胞培养板的各孔中,24 h后更换新培养基,并分别于转染24 h和48 h后收集细胞。
2.3荧光定量 RT-PCR检测LBH基因表达 设计人LBH基因和人GAPDH基因荧光定量RT-PCR引物(序列见表1)。提交引物序列给TaKaRa公司合成。按方法2.2最后收集的细胞加1 mL Trizol试剂裂解,提取细胞总RNA,取2 μg总RNA,按照Thermoscript first cDNA合成试剂盒说明书进行cDNA合成,然后以cDNA为模板,进行LBH基因、GAPDH基因的荧光定量RT-PCR反应。荧光定量RT-PCR采用SYBR green I法,反应体系包括: 2×master mix 25 μL; 2 μmol/L(上游+下游)引物 5 μL,100×ROX 0.5 μL,cDNA产物 2 μL,反应在Stratagen Mx3000p上进行,运行条件为:先94 ℃ 10 min, 然后 94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,共40个循环,在每个循环的第2步结束后收集荧光信号,以荧光信号对反应循环数作图。每个反应设3个复孔,取平均Ct值,通过ΔΔCt法计算各组细胞中LBH基因的相对表达水平。
2.4细胞周期分析 以确定沉默LBH的有效siRNA量再次转染16HBE 细胞,于48 h后0.25%胰蛋白酶消化收集细胞,冰冷PBS清洗2次后,预冷的70%乙醇固定,4 ℃过夜,上机前离心除去乙醇,PBS清洗3次,100 mg/L RNase A 37 ℃消化40 min;50 g/L PI 4 ℃染色1 h,流式细胞仪检测细胞DNA含量,确定siRNA转染对细胞周期的影响。
2.5荧光定量RT-PCR检测细胞周期素E1和E2 收集50 nmol/L siRNA转染48 h后的16HBE细胞和对照组细胞,Trizol提取总RNA,然后用设计的细胞周期素E1和 E2 的引物(序列见表1),按照方法2.3的操作和反应条件对实验组和对照组细胞的细胞周期素E1和 E2的表达进行荧光定量RT- PCR检测,确定实验组细胞中细胞周期素E1和E2的表达改变。
2.6Western blotting检测细胞周期素E1和E2的表达 4.5×106个细胞接种25 cm2培养瓶,第2 d用50 nmol/L siRNA转染,48 h后收集转染siRNA的16HBE细胞和对照组细胞,预冷的PBS(pH 7.4)洗3次,细胞裂解液裂解细胞,超声处理,BCA蛋白分析试剂盒(Pierce)测定蛋白浓度,取80 μg蛋白上样,进行丙烯酰胺凝胶电泳,转至硝酸纤维素膜上,5%脱脂奶粉封闭,Ⅰ抗4 ℃孵育过夜(cyclin E1、cyclin E2及GAPDH的稀释度分别是:1∶500、1∶500和1∶1 000),1∶2 000稀释的辣根过氧化物酶标记的Ⅱ抗室温孵育1 h,加入发光底物,X光胶片感光,显影和定影。
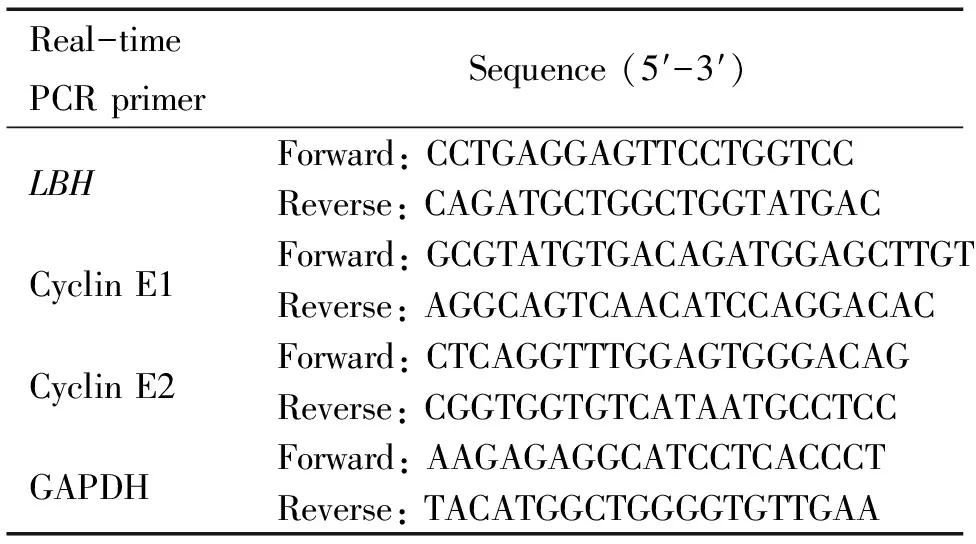
表1 荧光定量PCR的引物序列
3统计学处理
结 果
1siRNA转染后LBH基因的表达
siRNA转染16HBE细胞后24 h,相对对照组(对照组为非特异性dsRNA),25 nmol/L、50 nmol/L和100 nmol/L dsRNA转染组均没有发现LBHmRNA出现显著下调。转染48 h后,25 nmol/L、50 nmol/L和100 nmol/L转染组细胞出现不同程度的LBH表达下调,以50 nmol/L siRNA转染组最为显著(P<0.05),其LBHmRNA水平只有对照组细胞的14%,见图1, siRNA浓度达到100 nmol/L,LBH表达水平未见更明显的下调。
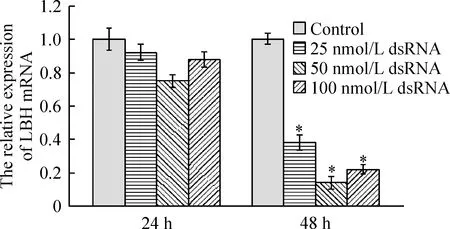
Figure 1. The relative expression of LBH mRNA detected by real-time RT-PCR after siRNA transfection for 24 h and 48 h.±s. n=6.*P<0.05 vs control.
2细胞周期的改变
50 nmol/L siRNA 转染16HBE细胞48 h,与对照组细胞相比,转染组细胞的细胞周期出现G1期细胞百分比减少和S期细胞百分比增加,G1期细胞从对照组的67.30%减少为58.02%,S期细胞从对照组的21.54%增加到35.62%,见图2,呈现明显的细胞周期G1/S期的进展。
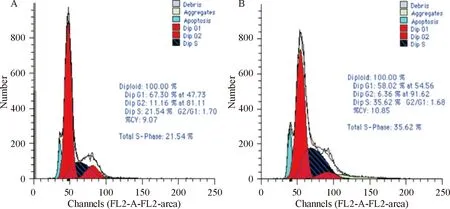
Figure 2. The effect of LBH gene silencing on the 16HBE cell cycle.A:control;B:siRNA.
3LBH表达下调对细胞周期素E1和E2表达的影响
50 nmol/L siRNA转染16HBE细胞48 h后,荧光定量RT-PCR检测显示,以对照组细胞中细胞周期素E1和E2的表达水平为100%,转染组细胞中细胞周期素E1相对表达量为106%,而细胞周期素E2表达达到对照组的1.89倍,见图3。对蛋白表达的检测显示:50 nmol/L siRNA转染48 h的16HBE细胞,其细胞周期素E2相对表达水平为对照组2.06倍(P<0.05);细胞周期素E1蛋白的表达水平在沉默组和对照组之间差异不显著(P>0.05),见图4。
讨 论
鼻咽癌组织中的低水平表达LBH蛋白,因其在鼻咽癌组织和细胞系中呈现普遍表达下调,并且在鼻咽癌细胞中表达LBH后能抑制鼻咽癌细胞的生长和裸鼠致瘤,从而推测LBH为鼻咽癌易感基因的候选者[1,2,6]。因此通过构建LBH表达下调的上皮细胞模型,确定LBH表达下调对上皮细胞的影响,能够有效揭示LBH表达缺失在鼻咽癌中的作用。目前RNAi(RNA interference)是最有效的基因沉默技术,能特异性抑制靶基因的转录,进而下调相应蛋白表达[7,8]。
我们以LBH基因正常表达的人支气管上皮细胞16HBE为模型,采用体外合成的靶向于LBH基因的siRNA,在转染16HBE细胞后,通过LBHmRNA表达水平的检测确定了沉默LBH基因的条件,藉此成功建立了LBH表达下调的16HBE的细胞模型。由于前期结果证实对细胞周期的影响与LBH基因的抑瘤功能有关[6],而且基因芯片检测提示表达LBH鼻咽癌细胞中的细胞周期素E2的表达显著下调[9],因此在LBH基因沉默后,对细胞周期进行了观察。结果显示16HBE细胞在LBH沉默后表现为细胞周期G1/S期进展的加速,确定了LBH基因在细胞周期调控中的作用。
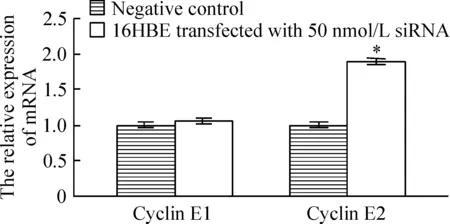
Figure 3. The relative expression of cyclin E1 and E2 mRNA examined by real-time RT-PCR after siRNA transfection for 48 h.±s.n=6.*P<0.05 vs negative control.
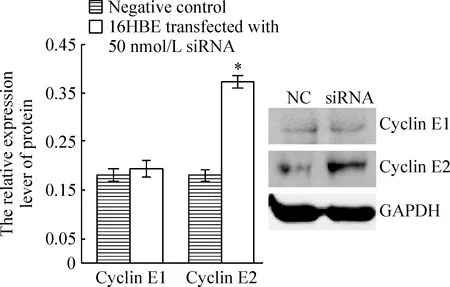
Figure 4. The expression of protein cyclin E1 and E2 after siRNA transfection for 48 h.±s. n=6. *P<0.05 vs negative control.
通常认为在细胞周期的进展中,当细胞通过G1期后就会到达受CDK2控制的G1/S期检测点,在此检测点,细胞周期素E1和E2与CDK2结合形成的复合物通过诱导RB蛋白的磷酸化推动细胞进入S期,因此细胞周期素E1和E2在细胞周期G1/S期进展中起重要作用[10]。16HBE细胞中的LBH基因沉默后,实际上仅仅表现为细胞周期素E2的表达上调,而细胞周期 E1没有发生明显改变,说明LBH对细胞周期素E2的特异调控。在原发性乳腺癌、卵巢癌、子宫癌和肺癌中均发现有细胞周期素E2的表达上调,表明其在肿瘤发生中的重要作用[11,12]。因此在上皮细胞中LBH对细胞周期的负性调控一定程度地揭示了LBH下调在肿瘤发生中的作用机制。
[1] 刘启才, 方 嬿, 李晓艳,等. NP9基因的克隆及对细胞周期素D1转录活性的影响[J].癌症, 2003, 22(7):725-728.
[2] 刘启才, 李晓艳, 韦拔雄,等. NP9基因在鼻咽癌中的表达及对CNE1细胞生长的影响[J].中华医学杂志, 2004, 84(12):1009-1011.
[3] Briegel KJ, Joyner AL. Identification and characterization of Lbh, a novel conserved nuclear protein expressed during early limb and heart development[J]. Dev Biol, 2001,233(2):291-304.
[4] Briegel KJ, Baldwin HS, Joyner AL, et al. Congenital heart disease eminiscent of partial trisomy 2p syndrome in mice transgenic for the transcription factor Lbh[J].Development, 2005,132(17):3305-3316.
[5] Conen KL, Nishimori S, Kronenberg HM, et al. The transcriptional cofactor Lbh regulates angiogenesis and endochondral bone formation during fetal bone development[J]. Dev Biol, 2009,333(2):348-358.
[6] 刘启才, 李晓艳, 韦拔雄,等. NP9基因抑制鼻咽癌细胞成瘤的实验研究[J].中华肿瘤杂志,2005, 27(11):641-644.
[7] Hannon GJ. RNA interference [J]. Nature, 2002, 418(6894):244 -251.
[8] 贾明旺,黄文杰.Caspase-3基因沉默对肺炎链球菌感染的肺泡上皮细胞凋亡的影响[J].中国病理生理杂志,2010,26(1):132-136.
[9] 刘启才,李晓艳,彭 燕,等.NP9基因对鼻咽癌细胞系CNE1基因表达谱的影响[J].中国病理生理杂志,2008,24(5):982-985.
[10]Müller-Tidow C, Metzger R, Kügler K, et al. Cyclin E is the only cyclin-dependent kinase 2-associated cyclin that predicts metastasis and survival in early stage non-small cell lung cancer[J].Cancer Res,2001,61(2):647-653.
[11]Moroy T, Geisen C. Cyclin E[J]. Int J Biochem Cell Biol, 2004,36(8):1424-1439.
[12]Payton M, Scully S, Chung G, et al.Deregulation of cyclin E2 expression and associated kinase activity in primary breast tumors[J]. Oncogene, 2002, 21(55): 8529-8534.
RNAi-mediatedknocking-downofLBHgenepromotescellcycleprogressin16HBEcells
LIU Qi-cai1, WANG Ying-feng1, YANG Chun-xiang2, LI Xiao-yan3, PENG Yan1, PENG Jie1, LI Bing1, LI Li4
(1ExperimentMedicalResearchCenter,GuangzhouMedicalCollege,Guangzhou510182,China;2DepartmentofNeurology,TheSecondHospitalofJingmenCity,Jingmen448000,China;3DepartmentofNephrology,TheFirstAffiliatedHospital,4StateKeyLaboratoryofOncologyinSouthernChina,ImagingDiagnosisandInterventionalCenter,CancerCenter,SunYat-senUniversity,Guangzhou510060,China.E-mail:liuqicai968@yahoo.com.cn;li2@mail.sysu.edu.cn)
AIM: To investigate the effect of small interfering RNA(siRNA) on limb-bud and heart(LBH) gene expression in 16HBE cells, and further to observe the change of 16HBE cell cycle after knocking down ofLBHgene.METHODSSynthetical siRNA targetingLBHgene was transfected into 16HBE cells by the method of lipofectamine 2000. The mRNA expression ofLBHwas examined by real time RT-PCR. The cell cycle was assayed by flow cytometry. The expression of cyclin E1 and E2 was also detected by real time RT-PCR and Western blotting.RESULTSThe expression ofLBHgene decreased by 86% in 16HBE cells transfected with 50 nmol/L of siRNA for 48 h. After transfected with siRNA for 48 h, 16HBE cells in G1phase decreased by 9.28% and the cells in S phase increased by 14.08%. The expression level of cyclin E2 in 16HBE cells transfected with siRNA was twice higher than that of the negative control cells.CONCLUSIONSequence-specific siRNA targetingLBHis capable of suppressingLBHgene expression in 16HBE cells. Down-regulation ofLBHexpression in 16HBE cells may promote the progress of cell cycle, and up-regulation of cyclin E2 expression plays a role in the process of G1/S phase.
RNA interference; Genes,LBH; 16HBE cells; Cell cycle
R363
A
10.3969/j.issn.1000-4718.2011.02-027
1000-4718(2011)02-0357-04
2010-09-01
2010-11-30
广东省自然科学基金资助项目(No.06301124);广州市属高校科技计划资助项目(No.61093);国家自然科学基金资助项目(No.81071207)
△通讯作者 Tel:020-81340204;E-mail:liuqicai968@yahoo.com.cn;Tel:020-87343476;E-mail:li2@mail.sysu.edu.cn

