食管鳞状细胞癌中SFRP基因家族启动子区甲基化状态的检测*
郭艳丽, 郭 炜, 邝 钢, 杨植彬, 董稚明
(河北医科大学第四医院河北省肿瘤研究所病理研究室,河北 石家庄 050011)
食管鳞状细胞癌中SFRP基因家族启动子区甲基化状态的检测*
郭艳丽, 郭 炜, 邝 钢, 杨植彬, 董稚明△
(河北医科大学第四医院河北省肿瘤研究所病理研究室,河北 石家庄 050011)
目的检测食管鳞状细胞癌(ESCC)中Wnt通路拮抗基因家族分泌型卷曲相关蛋白(SFRP)基因的甲基化状态,探讨其与食管鳞癌发生的关系。方法应用甲基化特异性PCR(MS-PCR)及RT-PCR的方法检测78例食管鳞癌及相应癌旁非肿瘤组织中SFRP1、SFRP2、SFRP4和SFRP5基因的甲基化状态及mRNA表达情况,并分析其与Wnt通路中心因子β-catenin蛋白表达的关系。结果在食管鳞癌组织中,SFRP1、SFRP2、SFRP4和SFRP5基因的甲基化率分别为65.4%(51/78)、69.2%(54/78)、62.8%(49/78)和52.6%(41/78),均明显高于癌旁非肿瘤组织(P<0.01)。这4个基因的甲基化率与肿瘤患者的组织学分级及临床分期均无关,但它们共同发生甲基化的频率则与临床分期显著相关(P<0.05)。这4个基因mRNA的阳性表达率分别为42.3%(33/78)、46.2%(36/78)、50.0%(39/78)和39.7%(31/78),均明显低于癌旁非肿瘤组织(P<0.01)。在发生甲基化的食管癌组织中这4个基因的mRNA表达阳性率及β-catenin蛋白的异质表达率均明显低于未发生甲基化的癌组织,且差异显著(P<0.05)。结论食管鳞癌组织中SFRP1、SFRP2、SFRP4和SFRP5基因均呈高甲基化状态,并有可能通过Wnt/β-catenin信号转导通路参与了食管癌的发生。联合检测SFRP基因家族甲基化状态对于食管癌的预后判断有一定指导意义。
食管肿瘤; 甲基化; 分泌型卷曲相关蛋白; Wnt通路
分泌型卷曲相关蛋白(secreted frizzled-related protein,SFRP)基因家族作为肿瘤抑制基因,是Wnt/β-catenin信号转导通路的拮抗基因,其表达的下调可减弱对通路的抑制作用,促使通路活化,被激活的Wnt信号转导通路可参与人类多种肿瘤的发生[1,2]。有研究表明,基因启动子区5′端 CpG岛甲基化可能是引起基因表达下调的重要机制。本研究检测了中国食管癌高发区78例食管癌患者的癌及癌旁组织中SFRP基因家族的甲基化状态及其mRNA表达情况,探讨其与食管癌发生的关系及可能的作用机制,以期从分子水平揭示食管癌的病因。
材 料 和 方 法
1主要试剂
蛋白酶K(Merck);氢醌(Sigma);亚硫酸氢钠(Sigma);Wizard DNA 纯化试剂盒(Promega);Trizol(Invitrogen),引物(北京赛百胜公司合成)。即用型免疫组织化学SP试剂盒(SP-9000,中衫金桥),鼠抗人单克隆抗体β-catenin(CAT-5H10, Zymed Laboratories,1∶100稀释)。
2研究对象和标本来源
研究对象选择河北医科大学第四医院胸外科及河北省磁县肿瘤医院2004年-2006年收治的食管癌患者78例,并确定患者均来自河北省太行山区的食管癌高发区,其中男性57例,女性21例,年龄范围26-78岁,平均年龄57.9岁。全部患者术前均未经化疗和放疗。每例患者均取癌组织原发灶及距癌组织2-5 cm处的癌旁组织,手术切除标本一部分-80 ℃低温冰箱保存提取DNA及RNA,另一部分标本进行石蜡包埋,常规HE染色,证实癌旁均为非肿瘤组织,并确定标本的组织学类型均为食管鳞状细胞癌。患者的临床分期及组织学分级情况见表2。本研究经所有患者知情同意。
3方法
3.1甲基化特异性PCR(methylation-specific PCR,MS-PCR)法 采用酚/氯仿抽提法,提取组织DNA,进行定量后,取适量DNA标本用亚硫酸氢盐处理。单链DNA的未甲基化胞嘧啶可被亚硫酸氢盐脱去氨基而转变成尿嘧啶,而甲基化胞嘧啶不能被修饰。根据此原理设计该基因的甲基化及非甲基化引物,分别进行扩增。PCR反应体系为20 μL,其中模板DNA 100 ng,10×PCR缓冲液2 μL,MgCl23.0mmol/L,Taq DNA聚合酶2.5 U,dNTPs 200 μmol/L;反应条件为95 ℃预变性10 min后,94 ℃变性45 s,退火50 s,72 ℃延伸45 s,40个循环后,72 ℃ 10 min。引物及退火温度见表1。用经甲基化酶(Sss I)处理以后的基因组DNA作为甲基化的阳性对照,用无消化系统肿瘤及其它系统肿瘤的正常人外周血DNA作为非甲基化的阳性对照,阴性对照则用灭菌双蒸水取代DNA模板进行PCR。另随机选取10%标本进行重复实验以验证结果的可靠性。
3.2DNA亚硫酸氢盐修饰完整性及结果的判定 同一样品DNA在亚硫酸氢盐修饰前与修饰后均用甲基化特异性引物和非甲基化特异引物扩增,如修饰前无任何目的条带扩增而修饰后有目的条带扩增,则亚硫酸氢盐修饰完全。扩增后,若甲基化引物扩增出了特异性条带,而非甲基化引物未扩增出条带,则为完全甲基化;若甲基化引物和非甲基化引物均扩增出了条带,则为不完全甲基化;若只有非甲基化引物扩增出了条带,则为非甲基化。
3.3RT-PCR检测 按Trizol试剂说明书提取组织总RNA,并参照逆转录试剂盒(reverse transcription system A3500,Promega)说明将 RNA逆转录成cDNA。PCR反应体系为20 μL,其中模板 cDNA 100 ng,10×PCR缓冲液2 μL,MgCl21.5 mmol/L,Taq DNA聚合酶2.5 U,dNTPs 200 μmol/L;反应条件为:95 ℃预变性3 min后,94 ℃ 45 s,退火45 s,72 ℃ 45 s,30个循环后,72 ℃ 5 min。PCR产物进行2%琼脂糖凝胶电泳,GAPDH作为内参照,其引物及退火温度见表1。
3.4免疫组化检测β-catenin的表达 应用常规SP法。石蜡切片常规脱蜡,梯度乙醇水化。3%甲醇过氧化氢封闭后用pH8.5的EDTA高压修复3 min,羊血清封闭,再依次加入Ⅰ抗、Ⅱ抗和Ⅲ抗,DAB显色,苏木精复染。以PBS代替Ⅰ抗作空白对照。β-catenin蛋白免疫组化染色镜下观察为胞浆/胞膜着色。将胞质的异常积聚(胞质内出现棕黄色颗粒)定义为异质表达,将胞膜着色或无着色定义为阴性表达,见图1。
4统计学处理
数据统计分析采用SPSS软件包(11.5版)进行。各组间的差异用2检验及连续性校正进行分析,双侧检验。
结 果
1食管鳞状细胞癌组织中SFRP基因甲基化状态分析
78例食管鳞癌及相应癌旁组织均成功进行了MS-PCR检测,结果共有4种情况:(1)肿瘤组织特异性甲基化,即仅肿瘤组织出现了甲基化条带;(2)肿瘤组织发生完全甲基化,非肿瘤组织发生不完全甲基化;(3)肿瘤组织及非肿瘤组织均发生了不完全甲基化;(4)肿瘤组织及非肿瘤组织均未发生甲基化,见图2。将不完全甲基化计入甲基化进行统计,则食管癌组织中SFRP1、SFRP2、SFRP4和SFRP5基因的甲基化率分别为65.4%(51/78)、69.2%(54/78)、62.8%(49/78)和52.6%(41/78),明显高于癌旁非肿瘤组织,差异显著(P<0.05),见表2。同时,实验观察到在发生甲基化的癌旁组织中其甲基化条带均表现为不完全甲基化,而相对应的肿瘤组织则表现为强甲基化状态。

表1 SFRP基因家族引物序列及PCR条件
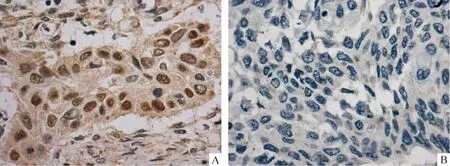
Figure 1. The expression of β-catenin in ESCC(DAB ×400).A: the ectopic expression of β-catenin in ESCC; B: the negative expression of β-catenin in ESCC.
2SFRP基因甲基化状态与临床病理参数的关系
SFRP1、SFRP2、SFRP4和SFRP5基因的甲基化频率与食管癌患者的组织学分级及TNM分期均无关(P>0.05)。在这4个基因的联合分析中发现,这些基因共同发生甲基化的频率在Ⅲ、Ⅳ期肿瘤患者中明显高于Ⅰ、Ⅱ期肿瘤患者,差异显著(P<0.05),但与肿瘤组织的组织学分级无关,见表3。
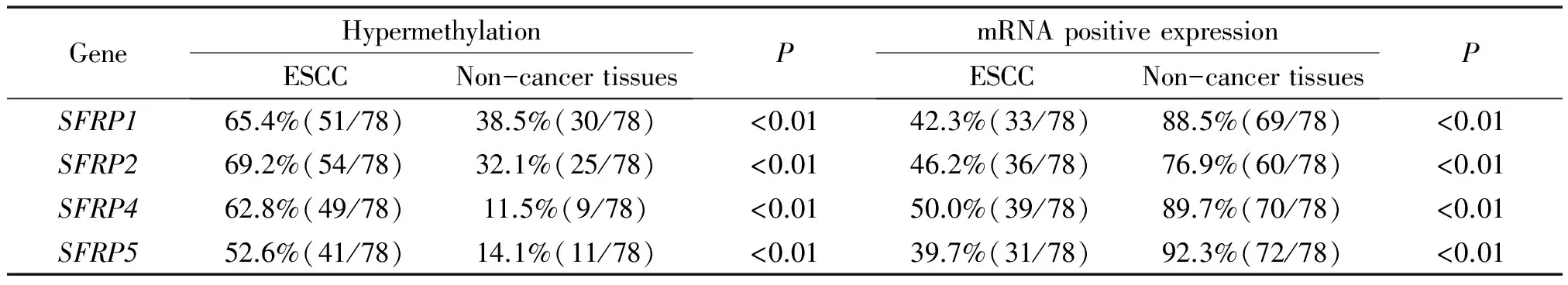
表2 食管鳞癌及癌旁非肿瘤组织中SFRP基因家族甲基化状态及mRNA表达情况
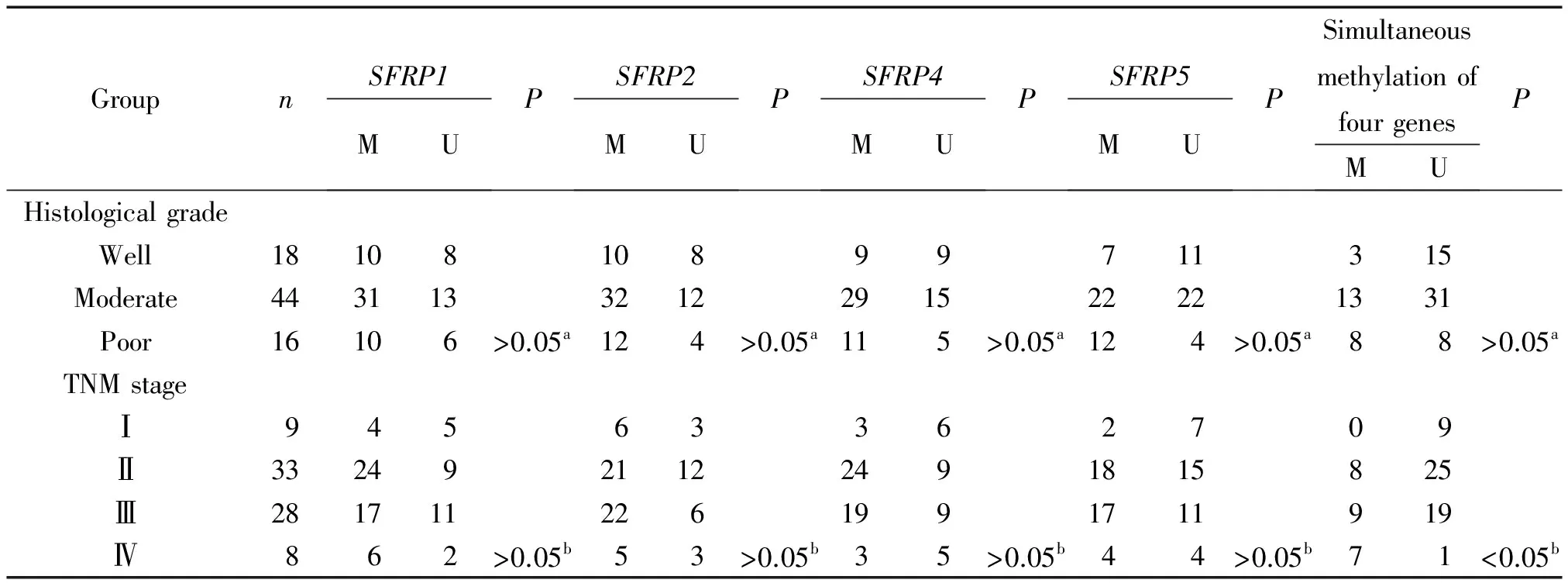
表3 食管鳞癌中SFRP基因家族甲基化状态与临床病理参数的关系
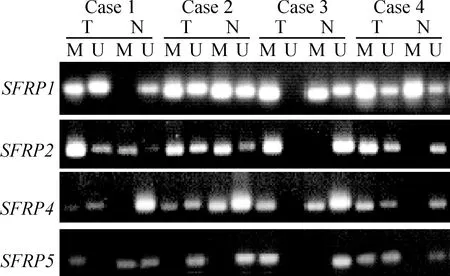
Figure 2. Methylation analysis of SFRP genes.MS-PCR results of the SFRP genes in 4 matched pairs(case 1-case 4) of tumor tissue(T) and non-cancer tissue(N). M: methylated genes; U: unmethylated genes. The tumor is fully methylated and the non-cancer tissue is incompletely methylated: case 3 of SFRP1, case 3 of SFRP4 and case 1 of SFRP5.Both tumor and non-cancer tissue are incompletely methylated: case 2,4 of SFRP1, case 1,2 of SFRP2 and case 2 of SFRP4.Both tumor and non-cancer tissue are unmethylated: case 2 of SFRP5.Other cases showed tumor-specific methylation.
3食管鳞癌SFRPmRNA表达情况及其与基因甲基化的关系
食管鳞癌中SFRP1、SFRP2、SFRP4和SFRP5的mRNA表达阳性率分别为42.3%(33/78)、46.2%(36/78)、50.0%(39/78)和39.7%(31/78),明显低于癌旁非肿瘤组织(P<0.01),见表2、图3;在发生甲基化的食管癌组织中SFRP1、SFRP2、SFRP4和SFRP5基因mRNA表达水平均明显低于未发生甲基化的癌组织,SFRP基因家族启动子区的甲基化状态和该基因在mRNA水平上的表达缺失有明显的相关性(P<0.05),见表4。
4食管鳞癌中SFRP基因家族甲基化状态与β-catenin蛋白表达的相关性分析
食管癌组织中β-catenin蛋白的异质表达率为69.2%(54/78), 而相应癌旁非肿瘤组织中其异质表达率仅为12.8%(10/78),差异显著(2=51.293,P<0.01);SFRP1、SFRP2、SFRP4和SFRP5基因在高甲基化的食管癌组织中β-catenin蛋白的异质表达率均明显高于未发生甲基化的癌组织,该拮抗基因家族启动子区的甲基化状态和β-catenin蛋白的异质表达均有明显的相关性(P<0.05),见表4。

表4 食管鳞癌中SFRP基因在高甲基化及未甲基化组中mRNA及β-catenin表达情况
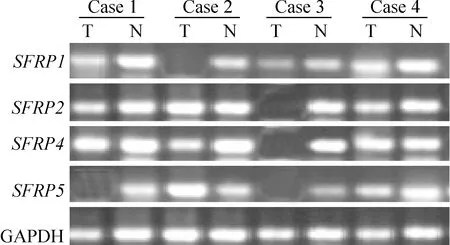
Figure 3. The mRNA expression of SFRP genes.RT-PCR results of the SFRP genes in 4 matched pairs(case 1-case 4) of tumor tissues(T) and non-cancer tissues(N). GAPDH is shown as a control. Most of the mRNA expression of SFRP genes was lower in ESCC tissues than those in non-cancer tissues.
讨 论
Wnt信号通路调节控制着细胞的增殖、分化、极化、凋亡与抗凋亡等许多生命过程[3],研究发现该通路的异常激活与多种肿瘤的发生密切相关[1]。SFRP基因家族作为肿瘤候选抑癌基因,可通过捆绑Wnt信号蛋白,抑制通路的活化。研究发现在多种肿瘤中均伴有SFRP基因的表达下调[2,4],但引起基因表达下调的机制仍未完全阐明。Nojima等[5]及齐健等[6]在对胃癌及结直肠癌细胞株的研究中发现,SFRP基因的启动子区存在高密度的甲基化,有效去除甲基化后能恢复基因转录。Takagi 等[7]在对肝细胞癌的研究中也发现SFRP基因的高甲基化与其表达的缺失有明显的相关性,提示SFRP基因的高甲基化可能是基因转录抑制的关键因素。此次实验也观察了食管鳞状细胞癌组织SFRP基因家族甲基化状态与转录水平表达的关系,发现在食管癌组织中SFRP1、SFRP2、SFRP4和SFRP5基因均呈高甲基化状态,并且,其甲基化发生率与该拮抗基因家族mRNA表达的缺失有明显相关性,提示SFRP基因的高甲基化导致的转录沉默可能是食管癌发生的机制之一。 实验中还观察到在部分发生甲基化的肿瘤组织中,其mRNA也呈阳性表达,分析原因,可能是由于肿瘤组织发生甲基化的程度不够,有研究报道CpG岛甲基化的程度与转录的抑制程度有关[8],当肿瘤组织中基因甲基化程度不足以完全抑制其转录时,即可出现上述情况。同时,研究发现在大多数样本中肿瘤组织的甲基化现象占有主导地位,具有特异性,但仍有部分癌旁非肿瘤组织中出现了SFRP基因的甲基化现象,但均表现为不完全甲基化,并且相应的肿瘤组织也同时存在该基因的高甲基化。究其原因,一是可能由于癌旁组织中混有微量的光学显微镜下难以观察到的肿瘤组织,或是由于这种检测出甲基化的癌旁组织具有癌变潜能,对Barrett’s食管的研究中发现,在正常组织中检测到p16基因高甲基化的患者随后出现了恶性转化[9]。因此,这种肿瘤相关基因的表观遗传学失活可能是肿瘤发生的早期事件。
研究表明,在多种肿瘤组织和细胞株中SFRP基因存在高频率的启动子区甲基化情况,但不同肿瘤中基因的甲基化频率与肿瘤分期及组织学类型之间的关系却存在分歧。Veeck等[10]指出,在乳腺癌中SFRP1基因的高甲基化与肿瘤组织的临床分期相关,但与组织的病理学分级及淋巴结转移无关;而此次实验与 Sogabe等[11]在对口腔鳞状细胞癌的研究结果类似,均显示SFRP1、2、4、5基因的甲基化频率与肿瘤患者的TNM分期及组织学分级无明显相关性。究其原因,肿瘤类型不同,尤其是肿瘤的病理学类型不同(如鳞癌或腺癌),可能造成基因甲基化频率的差异,再者研究对象人种的差异也可能对研究结果造成一定的影响,此外,由于抽样误差造成的研究样本中肿瘤组织的分期和组织学分级的比例不同,也可能造成研究结果的差异。在对这4个基因的联合检测中发现,它们共同发生甲基化的频率与肿瘤患者的临床分期明显相关。提示对SFRP基因家族的联合检测较单一指标的检测对于食管鳞状细胞癌的恶性生物学行为及预后的判断更有意义。
Wnt信号转导通路的激活取决于细胞内β-catenin的水平。正常情况下,β-catenin可与E-钙黏蛋白形成复合体固定于细胞膜参与调节细胞的黏附,细胞质内的β-catenin可通过由Axin、APC、GSK-3β形成的降解复合体磷酸化而降解,使胞浆内β-catenin含量保持在较低水平;但当通路激活时,Wnt 蛋白与受体结合以某种方式激活Dvl 蛋白,它可使降解复合物中GSK-3β失活,从而抑制了β-catenin的降解,导致其在胞质内稳定的累积。这种累积打破了细胞内原有的β-catenin出入核平衡,使β-catenin易位于细胞核,与LEF1/TCF转录复合体结合,调节下游靶基因的转录[12]。Urakami等[13]在对膀胱肿瘤细胞株的研究中发现,在用去甲基化药物5-Aza-dC处理后,β-catenin表达衰减,并进一步用siRNA沉默拮抗基因时,可观察到β-catenin表达的恢复,提示拮抗基因的下调表达可能增加β-catenin的胞浆积聚及经典Wnt信号通路的激活。本研究也观察了SFRP基因家族甲基化状态与β-catenin蛋白异质表达的关系,发现食管癌组织中β-catenin蛋白的异质表达明显高于癌旁组织,提示该通路在食管癌中可能处于激活状态;同时在发生SFRP基因甲基化的食管癌组织中其β-catenin的异质表达率明显高于未发生甲基化的癌组织,提示SFRP基因的高甲基化可能是引起β-catenin蛋白异质表达的机制之一,并可能通过Wnt/β-catenin信号转导通路的活化参与了食管癌的发生。
本研究结果揭示在食管鳞状细胞癌中SFRP1、SFRP2、SFRP4和SFRP5基因均呈高甲基化状态,并在转录水平引起其表达下调,且有可能通过Wnt/β-catenin信号转导通路参与了食管癌的发生,同时,结果提示了联合检测SFRP基因家族甲基化状态对于食管癌的预后判断有一定指导意义。
[1] Yamamoto H. Regulation of Wnt signaling pathway and its relationship with tumorigenesis[J]. Seikagaku, 2008, 80(12):1079-1093.
[2] Urakami S, Shiina H, Enokida H, et al. Combination analysis of hypermethylated Wnt-antagonist family genes as a novel epigenetic biomarker panel for bladder cancer detection[J]. Clin Cancer Res, 2006,12(7 Pt 1):2109-2116.
[3] 肖楚呤,潘云峰,郭兴华,等.氯化锂对人滑膜成纤维细胞增殖影响[J].中国病理生理杂志,2010,26(8):1640-1642.
[4] 赵成海,卜献民, 张 宁, 等. Wnt拮抗因子SFRP2在胃癌中的甲基化和异常表达[J]. 中国病理生理杂志,2009,25(8):1617-1620.
[5] Nojima M, Suzuki H, Toyota M, et al. Frequent epigenetic inactivation ofSFRPgenes and constitutive activation of Wnt signaling in gastric cancer[J]. Oncogene, 2007,26(32):4699-4713.
[6] 齐 健, 朱尤庆, 罗 峻, 等. 结直肠肿瘤中SFRP基因的甲基化及表达调控[J]. 中华肿瘤杂志,2007,29(11):842-845.
[7] Takagi H, Sasaki S, Suzuki H, et al. Frequent epigenetic inactivation ofSFRPgenes in hepatocellular carcinoma[J]. J Gastroenterol, 2008,43(5):378-389.
[8] Bird A. Molecular biology. Methylation talk between histones and DNA[J]. Science, 2001,294(5549):2113-2115.
[9] Guo W, Dong Z, He M, et al. Aberrant methylation of thrombospondin-1 and its association with reduced expression in gastric cardia adenocarcinoma[J]. J Biomed Biotechnol, 2010,2010:721485.
[10]Veeck J, Niederacher D, An H, et al. Aberrant methylation of the Wnt antagonistSFRP1 in breast cancer is associated with unfavourable prognosis[J]. Oncogene, 2006,25(24): 3479-3488.
[11]Sogabe Y, Suzuki H, Toyota M, et al. Epigenetic inactivation ofSFRPgenes in oral squamous cell carcinoma[J]. Int J Oncol, 2008,32(6):1253-1261.
[12]Nelson WJ, Nusse R. Convergence of Wnt, β-catenin, and cadherin pathways[J]. Science, 2004,303(5663):1483-1487.
[13]Urakami S, Shiina H, Enokida H, et al. Epigenetic inactivation of Wnt inhibitory factor-1 plays an important role in bladder cancer through aberrant canonical Wnt/β-catenin signaling pathway[J]. Clin Cancer Res, 2006,12(2):383-391.
HypermethylationofSFRPgenesinesophagealsquamouscellcancer
GUO Yan-li, GUO Wei, KUANG Gang, YANG Zhi-bin, DONG Zhi-ming
(PathologyLaboratoryofHebeiCancerInstitute,FourthHospitalofHebeiMedicalUniversity,Shijiazhuang050011,China.E-mail:dddzzzmmm@yahoo.com.cn)
AIM: To investigate the promoter methylation of secreted frizzled-related protein(SFRP) genes in esophageal squamous cell cancer(ESCC).METHODSThe methods of methylation-specific PCR(MS-PCR) and RT-PCR were applied to examine the CpG methylation of theSFRPpromoter and the mRNA expression ofSFRPgenes,respectively, in 78 samples of ESCC and corresponding adjacent non-cancer tissues. The protein expression of β-catenin was determined by immunohistochemistry.RESULTSIn the ESCC tissues, the frequencies of promoter methylation inSFRP1,SFRP2,SFRP4 andSFRP5 genes were 65.4%(51/78), 69.2%(54/78), 62.8%(49/78) and 52.6%(41/78),respectively, significantly higher than those in the adjacent tissues(P<0.01). The hypermethylation of these genes had no correlation with clinical stage and pathological classification in ESCC tissues(P>0.05). The frequency of simultaneous methylation of the 4 genes was correlated with the clinical stage(P<0.05). The positive rates of mRNA expression of the 4 genes in ESCC tissues were 42.3%(33/78), 46.2%(36/78), 50.0%(39/78) and 39.7%(31/78), respectively lower than those in the adjacent tissues(P<0.01). The mRNA expression ofSFRPgenes and the ectopic expression of β-catenin were correlated with the methylation frequency ofSFRPgenes(P<0.01).CONCLUSIONPromoter methylation ofSFRP1,SFRP2,SFRP4 andSFRP5 genes was a frequent event in ESCC, indicating a contribution to the pathogenesis of ESCC through aberrant canonical Wnt/β-catenin signaling pathway. Combination analysis of methylation status inSFRPgenes may has definite value on estimating prognosis of ESCC.
Esophageal neoplasms; Methylation; Secreted frizzled-related protein; Wnt pathway
R735.1
A
10.3969/j.issn.1000-4718.2011.02-013
1000-4718(2011)02-0278-06
2010-08-16
2010-10-18
河北省医学科学研究重点课题计划资助项目(No.20090466)
△通讯作者 Tel: 0311-86095337; E-mail:dddzzzmmm@yahoo.com.cn

