丹皮酚通过抑制NF-κB信号通路下调高脂血清诱导的人脐静脉内皮细胞黏附分子的表达*
周晓慧, 牛成伟, 曹 凯, 徐 倩
(承德医学院生物化学教研室, 河北 承德 067000)
丹皮酚通过抑制NF-κB信号通路下调高脂血清诱导的人脐静脉内皮细胞黏附分子的表达*
周晓慧△, 牛成伟, 曹 凯, 徐 倩
(承德医学院生物化学教研室, 河北 承德 067000)
目的观察丹皮酚对高脂损伤人脐静脉内皮细胞(HUVECs)核因子-κB(NF-κB)的活化及细胞黏附分子表达的影响,探讨丹皮酚抗动脉粥样硬化的分子机制。方法以培养HUVECs作为靶细胞,用高脂血清制备损伤模型。采用MTT法检测细胞活性;RT-PCR法检测NF-κB p65 mRNA的表达;Western blotting法检测κB 抑制蛋白α(IκB-α)、细胞间黏附分子-1(ICAM-1)和E-选择素的蛋白表达。结果丹皮酚能使高脂损伤的HUVECs存活率增加,形态趋于正常;降低NF-κB p65 mRNA的表达,提高IκB-α的表达;下调ICAM-1和E-选择素的蛋白表达。结论丹皮酚通过抑制血管内皮细胞NF-κB/IκB通路,下调ICAM-1和E-选择素的表达,减少炎症反应,这可能是丹皮酚抗动脉粥样硬化的机制之一。
丹皮酚; 高脂血清; 脐静脉内皮细胞; NF-κB; 胞间黏附分子1; E-选择素
动脉粥样硬化(atherosclerosis, AS)是慢性血管炎症损伤性疾病,高脂血症是导致动脉粥样硬化的独立因素。由血管细胞间黏附分子(intercellular cell adhesion molecule-1,ICAM-1)、E-选择素等介导的单核/巨噬细胞的黏附被认为是血管损伤后炎症反应的首要环节[1]。有研究证明[2],高脂可通过激活NF-κB,诱导ICAM-1与E-选择素的表达,从而在AS的发生发展中起重要作用。丹皮酚(paeonol, Pae) 又称牡丹酚,是毛茛科植物牡丹根皮和萝藦科植物徐长卿干燥根或全草的主要有效成分。研究表明,Pae具有抗炎、抗氧化、抗血栓、抗AS、抗肿瘤等广泛的药理作用[3]。 本研究采用高脂血清损伤人脐静脉内皮细胞模型,旨在观察丹皮酚是否可以阻断NF-κB/IκB通路,抑制ICAM-1、E-选择素等的表达,为丹皮酚抗AS的研究提供实验依据。
材 料 和 方 法
1材料
1.1药物与试剂 丹皮酚购自宁波天真制药有限公司,规格10 mg/2mL;DMEM培养基购自Gibco;胎牛血清(FCS)购自Clack;胰蛋白酶、Ⅰ型胶原酶、碱性成纤维细胞生长因子(bFGF)和四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)购自Sigma;胆固醇购自北京双旋微生物培养制品厂;Trizol购自Invitrogen;TaKaRa RNA PCR kit(AMV) Ver.3.0试剂盒购自大连宝生物工程有限公司;NF-κB p65和β-actin 引物购自上海生物工程有限公司;BCA蛋白浓度测定试剂盒购自上海申能博彩生物科技有限公司;ICAM-1、IκB-α兔抗人多克隆抗体、E-selectin山羊抗人多克隆抗体和β-actin小鼠抗人单克隆抗体购自Santa Cruz;Ⅱ抗山羊抗兔、兔抗山羊IgG/辣根酶标记购自北京中杉金桥生物技术有限公司;甘油三酯、胆固醇和低密度脂蛋白试剂盒购自南京建成生物工程研究所;其它试剂均为市售的分析纯。
1.2主要仪器 CO2培养箱,Heraeus; 倒置显微镜,Leica;净化工作台,上海新苗医疗器械制造有限公司;酶标仪,MK-3;紫外可见分光光度计(DU800),三洋公司 ;梯度PCR扩增仪,ABI公司; 电泳凝胶成像分析系统(ChemiDoc XRS),Bio-Rad;全自动生化分析仪AU640,Olympus。
2方法
2.1人脐静脉内皮细胞的培养 无菌条件下取承德医学院附属医院产科健康剖腹产新生儿脐带15-25 cm,于缓冲液中浸泡,用0.1%Ⅰ型胶原酶与0.25%胰蛋白酶(V/V=1∶1)的混合消化酶灌注法分离人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVECs)接种于25 cm2培养瓶中,置37 ℃、5% CO2培养箱内培养,培养基为含20%的胎牛血清的DMEM,并添加20 μg·L-1bFGF,隔天换液,待HUVECs生长至80%以上融合时,采用0.125%胰蛋白酶、0.01% EDTA消化传代,按1.0×108cells·L-1密度接种。原代及传代细胞呈典型的铺路石样形态。实验所用细胞为第2-3代。
2.2高脂血清的制备 选用健康家兔(承德医学院动物实验中心提供)10只,体重(2.0±0.5)kg,每天给予高脂饲料(1%胆固醇,5%蛋黄粉,10%炼制猪油,84%基础饲料)100 g/只,自由饮水。10周末,无菌条件下心脏取血,分离血清,其中1 mL用全自动生化分析仪AU640测得甘油三酯(5.01±2.15)mmol·L-1,胆固醇(33.50±6.87)mmol·L-1,低密度脂蛋白(11.32±5.32) mmol·L-1。将所有的高脂血清56 ℃,30 min灭活,微孔滤膜(0.22 μm) 过滤分装,-80 ℃保存备用。
2.3实验分组 将处于对数生长期的人脐静脉内皮细胞分为5组: 正常对照组:加含20 μg·L-1bFGF、20%正常兔血清的DMEM;高脂血清模型组:加含20 μg·L-1bFGF、20%兔高脂血清的DMEM;Pae低剂量组:加含20μg·L-1bFGF、20%兔高脂血清和25 mg·L-1Pae的DMEM;Pae中剂量组:加含20 μg·L-1bFGF、20%兔高脂血清和50 mg·L-1Pae的DMEM;Pae高剂量组:加含20 μg·L-1bFGF、20%兔高脂血清和100 mg·L-1Pae的DMEM。各组细胞继续培养24 h,倒置相差显微镜下观察各组细胞形态变化。
2.4MTT法检测细胞活力 将生长良好的第2代HUVECs细胞用0.25%胰蛋白酶、0.01%EDTA消化、重悬,以1.0×108cells·L-1密度接种于96孔板中,在37 ℃、5% CO2培养箱内培养至细胞达到80%融合时,按上述实验分组处理,培养24 h后,每孔加入5 g·L-1MTT溶液20 μL,37 ℃、5% CO2继续培养4 h,弃上清,每孔加入二甲基亚砜(DMSO)100 μL,振荡10 min,使结晶物完全溶解,选择490 nm波长,酶标仪检测各孔吸光度(A)值。
2.5RT-PCR检测NF-κB p65 mRNA的表达 利用Trizol试剂从各组HUVECs中提取细胞总RNA,紫外分光光度计测定A260/A280为1.8-2.2,应用RT-PCR法(试剂盒购于大连宝生物工程有限公司)检测NF-κB p65 mRNA的表达,逆转录,cDNA为PCR反应模板,β-actin为内参照。NF-κB p65的引物序列:上游5’-GCACTTACGGATTCTGGTGG-3’, 下游5’-CTCAAACGCTGGTGTTAGGC-3’,扩增片段 426 bp。β-actin引物序列:上游 5’-AGCGGGAAATCGTGCGTGAC-3’,下游5’-ACATCTGCTGGAAGGTGGAC-3’,扩增片段453 bp。反应条件:94 ℃ 预变性2 min, 94 ℃变性30 s,57 ℃(NF-κB p65)或58 ℃(β-actin)退火50 s,72 ℃延伸1 min,共计30个循环,末次循环后,72℃再延伸10 min。PCR产物5 μL于2%琼脂糖凝胶上电泳,并在凝胶成像分析仪中扫描记录图片作半定量分析,以各组HUVECs中NF-κB p65/β-actin扫描灰度值计算各组细胞NF-κB p65 mRNA的相对表达量。
2.6Western blotting检测IκB-α、ICAM-1和 E-选择素的蛋白表达 收集各组细胞,用PBS洗涤3次,加入含有PMSF的细胞裂解液,冰上作用20 min, 4 ℃、12 000 r·min-1离心20 min,取上清,采用BCA蛋白定量试剂盒进行蛋白定量。 以30 μg总蛋白上样,进行SDS-PAGE电泳,PVDF膜进行转印,5%脱脂奶粉封闭后,用IκB-α(1∶200)、ICAM-1(1∶200)、E-选择素(1∶200)Ⅰ抗4 ℃孵育过夜,TBST洗涤3次,每次10 min,再用Ⅱ抗(1∶5 000)室温孵育1 h, ECL显色剂显色,X射线胶片显影、定影,蛋白条带用Quantity One凝胶分析软件进行半定量分析。以IκB-α、ICAM-1和E选择素蛋白条带的积分吸光度值/β- actin蛋白条带的积分吸光度值表示IκB-α蛋白、ICAM-1和E选择素蛋白的相对蛋白含量。
3统计学处理
结 果
1MTT法检测各组HUVECs细胞活力
高脂血清模型组的A值明显低于正常对照组(P<0.01)。Pae低、中、高剂量组的A值显著高于高脂模型组(P<0.01),见表1。
表1 Pae对高脂血清损伤内皮细胞细胞活力的影响
2倒置显微镜观察下细胞形态变化
高脂模型组的细胞出现片状分离,脱落现象,损伤作用明显。Pae干预组使细胞间隙变窄,形态趋于正常,见图1。
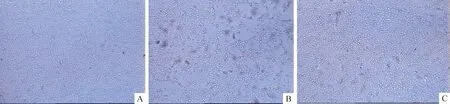
Figure 1. Morphology of HUVECs in each group (×40).A:normol control group; B:hyperlipidemic serum-treated group; C: hyperlipidemic serum+ Pae-treated group. Compared with normal control group, most cells in hyperlipidemic serum-treated group shaped like a lobe and came off.Enlarged space narrowed down among the cells and the morphology was tending to normal after intervention with Pae.
3RT-PCR检测各组HUVECsNF-κBp65mRNA的表达
高脂模型组NF-κB p65 mRNA的表达明显高于正常对照组(P<0.01)。Pae低、中、高剂量组的NF-κB p65 mRNA的表达明显低于高脂模型组(P<0.01),见表2、图2。
表2 丹皮酚对高脂血清损伤内皮细胞NF-κB p65 mRNA表达的影响

Figure 2. NF-κB p65 mRNA expression in HUVECs detected by RT-PCR. Lane 1: normal group; Lane 2: hyperlipidemic serum group;Lane 3: hyperlipidemic serum+Pae at low dose;Lane 4: hyperlipidemic serum+Pae at middle dose;Lane 5: hyperlipidemic serum+Pae at high dose.
4Westernblotting检测各组HUVECsIκB-α、ICAM-1和E-选择素的蛋白表达
高脂血清模型组IκB-α的表达明显低于正常对照组(P<0.01), Pae低、中、高剂量组IκB-α的蛋白表达显著高于高脂血清模型组(P<0.01),见表3、图3; 高脂血清模型组ICAM-1和E-选择素蛋白表达明显高于正常对照组(P<0.01),Pae低、中、高剂量组ICAM-1和E-选择素的蛋白表达显著低于高脂模型组(P<0.01),并且显示一定的剂量依赖性。见表3、图4、5。
表3 丹皮酚对高脂血清损伤内皮细胞IκB-α,、ICAM-1和E-selectin蛋白表达的影响
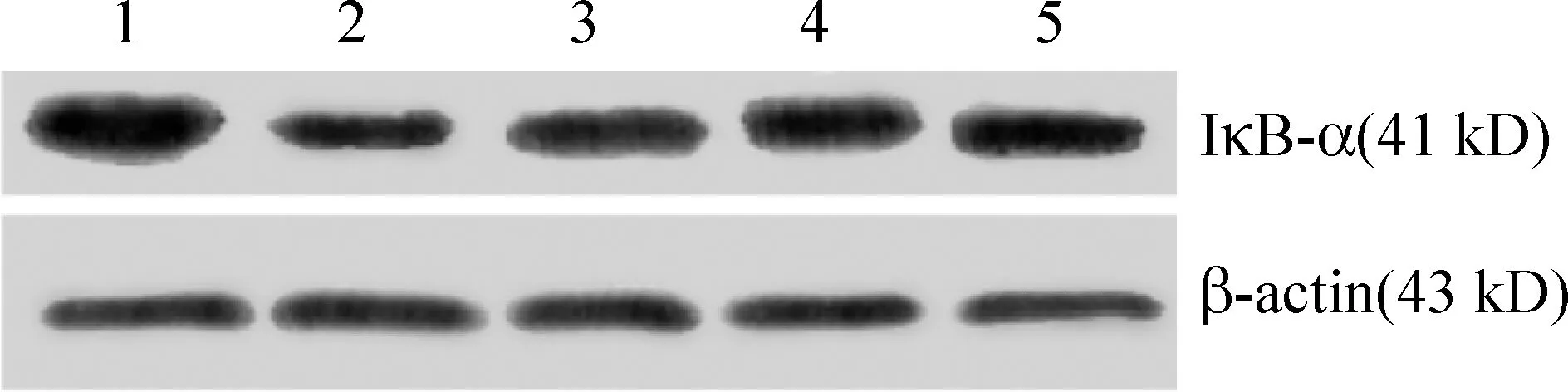
Figure 3. IκB-α protein expression in HUVECs detected by Western bloting. Lane 1: normal group; Lane 2: hyperlipidemic serum group;Lane 3: hyperlipidemic serum+Pae at low dose;Lane 4: hyperlipidemic serum+Pae at middle dose;Lane 5: hyperlipidemic serum+Pae at high dose.

Figure 4. ICAM-1 protein expression in HUVECs detected by Western bloting. Lane 1: normal group; Lane 2: hyperlipidemic serum group;Lane 3: hyperlipidemic serum+Pae at low dose;Lane 4: hyperlipidemic serum+Pae at middle dose;Lane 5; hyperlipidemic serum+Pae at high dose.
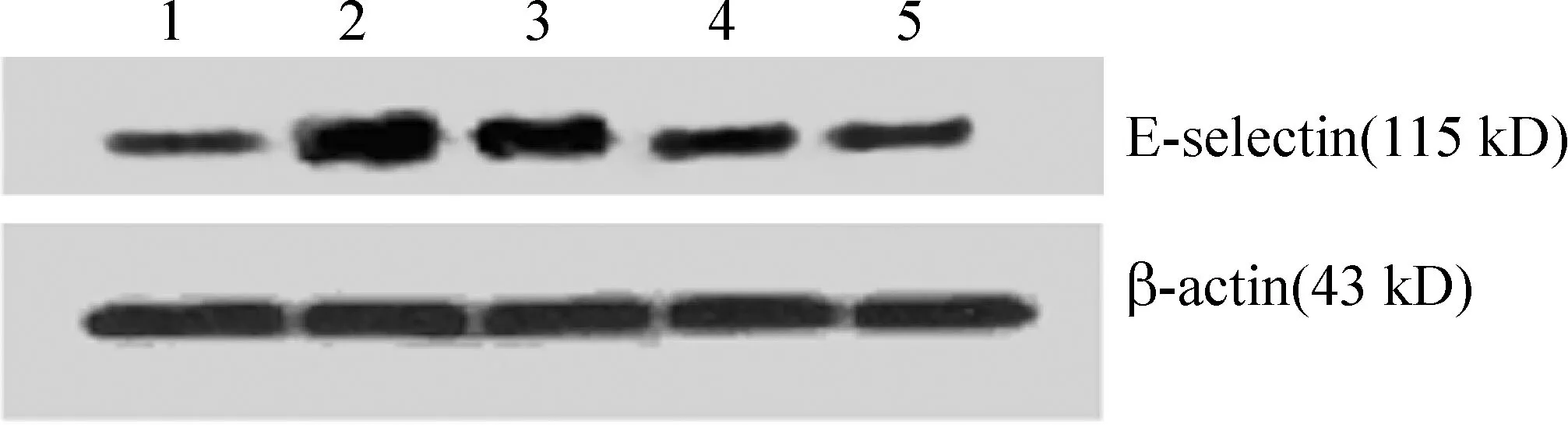
Figure 5. E-selectin protein expression in HUVECs detected by Western bloting. Lane 1: normal group; Lane 2: hyperlipidemic serum group;Lane 3: hyperlipidemic serum+Pae at low dose;Lane 4: hyperlipidemic serum+Pae at middle dose;Lane 5: hyperlipidemic serum+Pae at high dose.
讨 论
炎症过程的最早变化之一为内皮细胞表达黏附分子。人AS的斑块中有ICAM-1的表达,并在AS的病理过程中起重要作用[4]。正常情况下,动脉内皮细胞及平滑肌细胞不表达或微量表达ICAM-1黏附分子,但在各种炎症信号刺激后表达急剧增加,ICAM-1与其配体结合,介导激活的内皮细胞与循环中的白细胞相互黏附,黏附到血管内皮的白细胞迁移到内皮下, 迁移到内皮下的单核细胞摄取氧化修饰的低密度脂蛋白(ox-LDL)变为激活的巨噬细胞,最终成为充满脂质的泡沫细胞[5];ICAM-1还介导淋巴细胞聚集在损害部位,共同促进AS的慢性炎症过程;黏附到血管内皮下的白细胞又可通过一系列机制促进内皮细胞损伤,使ICAM-1表达进一步增强,进而吸附大量的白细胞,形成自我增殖的恶性循环,从而加重AS的发生发展[6]。ICAM-1在AS形成过程中,还能介导平滑肌细胞的分化与迁移。
E-选择素(E-selectin)又称为内皮-白细胞黏附分子-1(endothelial leukocyte adhesion molecule-1,ELAM-1),为一种I型跨膜糖蛋白,是黏附分子选择素家族中的一个重要成员[7]。E-selectin主要介导白细胞与血管壁黏附的第一阶段,即可逆性黏附阶段,通过与其相应配体结合介导白细胞(中性粒细胞、T、B淋巴细胞及单核细胞等)与血管壁(特别是毛细血管后静脉)接触产生微弱黏附,使白细胞在激活的内皮细胞表面滚动,为进一步黏附创造条件[8]。正常情况下血管内皮具有白细胞抵抗性,不表达或低表达E-selectin,只有在内皮细胞受到炎症因子刺激后才分泌表达E-selectin。
NF-κB是一种分布和作用均十分广泛的细胞转录因子,控制着细胞因子、黏附分子及生长因子等基因表达[9,10]。正常情况下,NF-κB与IκB结合组成异源多聚体,以无活性的潜在状态存在于胞浆中[11],最经典的NF-κB激活通路是通过丝氨酸或酪氨酸的磷酸化和蛋白酶介导的IκB蛋白降解[11,12],在多种因素(如炎症细胞因子TNF-α、IL-1β,血管活性物质AngⅡ等)的诱导下,激活IκB激酶使IκB蛋白磷酸化并被蛋白酶降解,使IκB与NF-κB解离,活化的NF-κB从胞浆转移至细胞核,与核内DNA特定区域结合,激活靶基因(细胞因子、黏附分子、生长因子),促进其转录,引起各种血管细胞间黏附分子(ICAM-1、VCAM-1、E-选择素等)和趋化蛋白在损伤的血管内皮中表达增加,导致炎症分子的募集,引发AS的形成[13]。
本研究结果显示,高脂血清损伤的HUVECs的细胞,细胞存活率明显降低,光镜下可见细胞间隙加宽,细胞收缩变圆,细胞边界模糊,部分细胞脱落,而Pae干预后,高脂血清损伤的细胞存活率显著提高,形态明显改善。表明Pae对高脂血清损伤的内皮细胞有直接保护作用。
如前所述,IκB的降解程度决定NF-κB的活化水平,所以IκB的含量与NF-κB活化水平成反比,本实验通过检测IκB的含量来反映NF-κB的活化情况,结果显示,高脂损伤的HUVECs的细胞IκB的含量明显低于正常对照组,NF-κB的表达明显升高,Pae干预后,IκB的含量较高脂损伤组明显升高,NF-κB的表达明显降低,表明丹皮酚能够降低高脂损伤的HUVECs细胞NF-κB的表达并抑制其活化。
进一步研究发现,高脂损伤的HUVECs细胞ICAM-1和E-选择素的蛋白表达较正常对照组明显增加,Pae干预后ICAM-1和E-选择素的蛋白表达较高脂损伤组明显降低,且显示明显的剂量依赖性。ICAM-1和E-选择素为NF-κB下游基因的表达产物[14],本研究结果显示,在高脂损伤模型组和Pae干预组,NF-κB的表达及活化与ICAM-1和E-选择素的蛋白表达变化是一致的,提示在高脂损伤的过程中,丹皮酚通过阻断IκB/NF-κB信号通路,从而降低ICAM-1和E-选择素的表达,减轻炎症反应,进而发挥抗动脉粥样硬化的作用。
[1] 赵慧娟,龙明智.内皮细胞功能障碍与动脉粥样硬化的研究进展[J].中西医结合心脑血管病杂志,2005,3(6):533-535.
[2] 徐自超,王淑秀.核转录因子在动脉粥样硬化形成中的作用[J].新乡医学院学报,2006,23(2):201-204.
[3] 李 骅,王四旺,张邦乐.丹皮酚的药理活性和药物动力学研究进展[J].亚太传统医药,2010,6(2):110-112.
[4] Hajilooi M, Sanati A, Ahmadieh A, et al. Circulating ICAM-1,VCAM-1,E-selectin,P-selectin,and TNF-αⅡin patients with coronary artery disease[J]. Immunol Invest,2003,32(4):245-257.
[5] Deam TL,CooK-Mills JM.Vascular cell adhesionmolecule-1(VCAM-1)activation of endothelial cell matrix metalloproteinases role of reactive oxygen species[J].Blood,2004, 104(8):2385-2393.
[6] 王建湘,程丑夫,尹树忠.舒冠滴丸对高脂血清内皮细胞ICAM-1 mRNA表达影响的研究[J].中西医结合心脑血管病杂志,2008,6(5):536-537.
[7] Garcí-Criado FJ, Lozano FS, Barros MB, et al. P- and E-selectin blockade can control bacterial translocation and modulate systemic inflammatory response[J].J Invest Surg, 2005, 18(4):167-176.
[8] Takei A, Huang Y, Lopes-Virella MF. Expression of adhesion molecules by human endothelial cells exposed to oxidized low density lipoprotein. Influences of degree of oxidation and location of oxidized LDL[J].Atherosclerosis,2001,154(1):79-86.
[9] 徐 峰,夏靖燕,杨 燕,等.不可分型流感嗜血杆菌通过p38 MAPK和NF-κB依赖的方式上调IL-8的表达[J].中国病理生理杂志,2009,25(1):18-21.
[10]柴婵娟,杨志明,康玉明,等.NF-κB信号通路介导AngⅡ诱导THP-1巨噬细胞表达MMP-9[J].中国病理生理杂志,2009,25(12):2334-2337.
[11]Dawn B,Xuan YT, Marian M, et al. Cardiac-specific abrogation of NF-κB activation in mice by transdominant expression of a mutant IκB a[J]. J Mol Cell Cardiol, 2001,33(1):161-173.
[12]Li C, Kao RL, Ha T,et al. Early activation of IKKβ duringinvivomyocardial ischemia[J].Am J Physiol Heart Circ Physiol, 2001,280(3):H1264-H1271.
[13]Zerfaoui M, Suzuki Y, Naura AS, et al. Nuclear translocation of p65 NF-κB is sufficient for VCAM-1, but not ICAM-1, expression in TNF-stimulated smooth muscle cells: Differential requirement for PARP-1 expression and interaction[J]. Cell Signal, 2008, 20(1): 186-194.
[14]石翠格,胡 刚,汪 海. NF-κB在动脉粥样硬化中的始动作用.[J].中国药理学通报,2004,20(4):382-385.
PaeonolreducesexpressionofadhesionmoleculesinHUVECsinducedbyhyperlipidemicserumviainhibitingthepathwayofNF-κBsignaling
ZHOU Xiao-hui, NIU Cheng-wei, CAO Kai, XU Qian
(DepartmentofBiochemistry,ChengdeMedicalCollege,Chengde067000,China.E-mail:zxh5055@sina.com)
AIM: To observe the anti-atherosclerosis effect of paeonal(Pae) on the activation of NF-κB and the expression of cell adhesion molecules in human umbilical vein endothelial cells(HUVECs) induced by hyperlipidemic serum.METHODSCultured HUVECs were used as target cells. Hyperlipidemic serum was added to the culture medium to establish the injury mode of HUVECs. Methyl thiazolyl tetrazolium(MTT) method was used to examine the cell viability. The mRNA expression of NF-κB p65 was determined by RT-PCR. The protein levels of IκB-α, intercellular cell adhesion molecule-1(ICAM-1)and E-selectin were detected by Western blotting.RESULTSAfter treated with Pae, the cell viability was increased and the morphological changes of HUVECs injured by hyperlipidemic serum trended to normal. The expression of IκB-α in HUVECs injured by hyperlipidemic serum increased, while the expression of NF-κB p65 mRNA, ICAM-1 and E-selectin protein was decreased.CONCLUSIONThe anti-atherosclerosis mechanism of paeonal may be related to the inhibitory effect of the natural compound on the pathway of NF-κB/IκB, thereby reducing the expression of ICAM-1 and E-selectin and attenuating the inflammatory reaction in vascellum.
Paeonal; Hyperlipidemic serum; Umbilical vein endothelial cells; NF-kappa B; Intercellular adhesion molecule-1; E-selectin
R285.5
A
10.3969/j.issn.1000-4718.2011.02-008
1000-4718(2011)02-0249-05
2010-08-23
2010-11-16
河北省科技厅基金资助项目(No.07276101D-47)
△通讯作者 Tel:0314-2291158; E-mail: zxh5055@sina.com

