缺血后处理对离体大鼠心肌线粒体功能的影响*
刘兴奎, 段忠心 , 喻 田
(遵义医学院麻醉系,贵州 遵义 563003)
缺血后处理对离体大鼠心肌线粒体功能的影响*
刘兴奎△, 段忠心#, 喻 田
(遵义医学院麻醉系,贵州 遵义 563003)
目的建立离体大鼠心肌缺血/再灌注损伤模型,观察缺血后处理对大鼠心肌线粒体功能的影响,并探讨线粒体ATP敏感性钾通道(mitoKATP)在缺血后处理心肌保护中的作用。方法采用Langendorff装置建立离体大鼠心肌缺血/再灌注损伤模型。将SD大鼠随机分为对照组(C)、模型组(M)、缺血后处理组(IPO)、5-羟癸酸拮抗缺血后处理组(5-HD+IPO),每组8只。各组均先灌注平衡20 min,C组:续灌70 min;M组:缺血前灌注4 ℃ St.Thomas停跳液(10 mL/kg),全心缺血40 min,复灌30 min;IPO组:全心缺血40 min,复灌前先开放10 s,缺血10 s,反复6次,时间为2 min,复灌28 min;5-HD+IPO组:缺血后处理前给予含5-羟癸酸(100 μmol/L)的K-H液灌注5 min,余同IPO组,复灌23 min。观察各组平衡末与再灌注末心肌线粒体膜电位、氧自由基及呼吸功能的变化。结果(1)各组再灌注末心肌线粒体膜电位较平衡末显著降低,而C组显著高于其它3组,IPO组明显高于5-HD +IPO与M组,5-HD +IPO组高于M组。(2)各组再灌注末与平衡末比较,心肌线粒体氧自由基含量显著升高,其中M组显著高于其它3组,5-HD +IPO组高于IPO及C组,IPO组高于C组。(3)各组再灌注末较平衡末线粒体呼吸功能明显受损,且C组优于其它3组,IPO组优于5-HD +IPO与M组,5-HD +IPO组优于M组。结论(1)缺血后处理通过维护线粒体膜电位稳定、减少线粒体氧自由基的产生、保护线粒体呼吸链及功能,减轻心肌的再灌注损伤。(2)5-HD不能完全阻断缺血后处理的心肌保护作用。 (3)缺血后处理的心肌保护效应可通过激活心肌mitoKATP实现,同时还有其它因素参与了缺血后处理的心肌保护。
线粒体功能; 缺血后处理; 再灌注损伤; 心肌
减轻心肌缺血/再灌注损伤一直是心肌保护研究的重点[1,2]。Zhao等[3]在研究中发现并首先提出了缺血后处理(ischemic post-conditioning,IPO)的概念:即在再灌注早期,重复给予几次短暂冠脉闭塞与再通,可明显减轻心肌再灌注损伤。Staat等[4]多次将缺血后处理用于临床并发现可使心肌梗死程度减轻。Yang等[5]在兔心模型研究中证实IPO与ATP敏感性钾通道(KATP)有关。本实验用线粒体KATP(mitoKATP)抑制剂5-羟癸酸(5-hydroxydecanoate,5-HD)作为拮抗剂,观察缺血后处理对离体大鼠缺血再灌注心肌线粒体功能的影响。
材 料 和 方 法
1材料
1.1动物及分组 健康清洁级雄性SD大鼠64只,年龄16-20周,体重250-350 g,第三军医大学大坪医院实验动物中心提供。随机分为4组:对照组(control group, C组)、模型组(model group, M组)、缺血后处理组(ischemic postconditioning group, IPO组)、5-HD拮抗缺血后处理组(5-HD+IPO组)。
1.2主要试剂 四甲基对苯二胺(tetramethyl-p-phenylene diamine,TMPD)、羰基氰酯-3-氯苯基腙(carbonyl cyanide-3-chlorophenylhydrazone,FCCP)、谷氨酸(glutamic acid,GAA)、罗丹明123(rhodamine 123)、苹果酸、琥珀酸、鱼藤酮、抗霉素A及5-羟癸酸(Sigma);Amplex Red(Invitrogen);Bradford 蛋白浓度测定试剂盒(碧云天生物技术研究所);其余试剂为国产分析纯。
1.3主要仪器 Langendorff离体心脏灌注装置(PanLab);Powerlab/8SP实验数据采集系统(ADInstrument);内切式高速均质器(T8,IKA);荧光分光光度计(Eclipse,Varian)。
2方法
2.1离体大鼠心脏模型的建立 腹腔注射戊巴比妥钠(40 mg·kg-1)、肝素(250 U·kg-1),麻醉后迅速固定置于Langendorff灌注管口。用37 ℃预先氧平衡的K-H液心脏逆行灌注(灌注压力75-85 mmHg),将带有乳胶水囊的测压管经二尖瓣插入左心室,连接Powerlab/8SP生物机能试验压力换能器系统,调节水囊使左室舒张末压为4-8 mmHg。上述步骤均在2 min内完成。离体心脏37 ℃的K-H液平衡灌注20 min,平衡后心率>250次/min、左室收缩压>85 mmHg、室性早搏<2个/min,未达条件者舍弃。
2.2灌注方案 C组平衡20 min后,续灌70 min;M组平衡20 min, 灌注4 ℃St.Thomas停跳液10 mL/kg,常温下缺血40 min,再次灌注37 ℃含氧的K-H液30 min;IPO组于再灌注前先开放10 s,缺血10 s,反复6次,时间为2 min,再次灌注37 ℃含氧的K-H液28 min;5-HD+IPO组于缺血后主动脉逆灌含5-HD(100 μmol/L)的K-H液持续5 min,余同IPO组,再灌注37 ℃的K-H液23 min。并分别于平衡末(the end of equilibrium,T1)与续灌末或再灌注末(the end of reperfusion,T2)取心肌标本行线粒体各项指标测定。
2.3线粒体膜电位(mitochondrial membrane potential,MMP)测定 心肌线粒体提取参照Yamaguchi等[6]的方法:于T1、T2取心脏标本后立即剪碎、匀浆、离心后,取沉淀,分散于适量分离液中。线粒体蛋白定量方法参照Bradford 蛋白浓度测定试剂盒说明书,用酶标仪测定A595,根据标准曲线计算出样品中的蛋白浓度。参照Huang等[7]的方法进行MMP测定:测定介质预热至37 ℃,取2 mL移至反应体系,调零;加入rhodamine 123至终浓度约50 nmol/L,测定其荧光强度,根据标准曲线,计算反应体系中rhodamine 123的总量;加入线粒体,终浓度为0.2 g/L,荧光强度稳定后,加入FCCP,膜电位消失,线粒体内rhodamine 123重回反应介质后稳定。根据Nerst方程:Δψ=-59.5lgXin/Xout(Xin和Xout分别为线粒体内、外的rhodamine 123浓度)可计算出MMP。
2.4线粒体活性氧(reactive oxygen species,ROS)测定 依照Mueller等[8]方法:测定介质预热至37 ℃,取2 mL移至反应体系,记录30 min内的荧光强度变化,在不加入线粒体的条件下重复1次,作为背景荧光扣除,标准曲线采用在测定介质中加入已知量的H2O2绘制,根据标准曲线转换为ROS含量,计算ROS的生成速率。
2.5线粒体呼吸功能测定 参考Roussel等[9]方法:反应液1 mL,温度30 ℃。加入测定介质0.9 mL,平衡5 min,再加入0.05 mL线粒体,记录氧耗曲线,加入底物,启动2态呼吸,记录1 min,再加入ADP,启动3态呼吸,记录氧分压变化情况;全部ADP均磷酸化为ATP后,线粒体进入4态呼吸;最后加入FCCP终浓度100 nmol/L,进入氧化磷酸化解偶联状态。分别以苹果酸/谷氨酸、琥珀酸以及维生素C/TMPD为底物,测定相应的氧耗速率,并计算线粒体活性常数呼吸控制比(respiration control ration, RCR)及磷氧比(P/O)。
3统计学处理
结 果
1MMP的变化
各组T1时点MMP无明显差异。而在T2时点MMP均较T1显著降低(P<0.05,P<0.01);T2时点C组显著高于其它3组(P<0.01),IPO组明显高于5-HD +IPO组与M组(P<0.05,P<0.01),5-HD +IPO组高于M组(P<0.05),见表1。
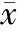
表1 各组心肌线粒体膜电位(MMP)的变化
2心肌线粒体ROS的变化
各组T1时点ROS无明显差异。T2时点各组ROS均较T1时点明显升高(P<0.05或P<0.01),其中M组显著高于其它3组(P<0.01),而5-HD +IPO组高于IPO组和C组(P<0.05或P<0.01),IPO组高于C组(P<0.01),见表2。
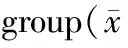
表2 各组心肌线粒体ROS的变化
3线粒体呼吸功能的变化
各组T2时点线粒体呼吸功能均较T1时点明显降低(P<0.05或P<0.01),T2时点C组呼吸功能优于其它3组(P<0.05或P<0.01),IPO组优于5-HD+IPO组与M组(P<0.05或P<0.01),5-HD+IPO组优于M组(P<0.05或P<0.01),见表3。
讨 论
线粒体是细胞中非常重要的细胞器, 是真核生物能量代谢的中心。MMP 是由于线粒体内膜的质子泵将基质内质子泵入外室而形成的。MMP的稳定有利于维持线粒体的正常生理功能,是反映线粒体内膜通透性的最佳指标之一和衡量线粒体功能的一个重要指标,也是线粒体进行氧化磷酸化、产生ATP的先决条件。MMP的大小直接反映线粒体功能的变化,通过抑制MMP的下降,可阻止细胞凋亡的发生,即MMP的降低是细胞凋亡特异性改变[10]。本实验结果显示缺血后处理可稳定心肌MMP,保护线粒体的功能,减轻心肌的缺血再灌注损伤。
线粒体是细胞产生氧自由基的重要场所,正常生理条件下线粒体以98%的耗氧量用来制造ATP,其余2%的耗氧量却用来产生ROS。线粒体呼吸链在产生ATP的同时,有少量氧接受单电子,产生ROS,呼吸链的复合体I和Ⅲ是产生ROS的主要位点[11]。缺血缺氧可使线粒体受损,并使呼吸链处于高还原状态,再灌注使呼吸链电子爆发而产生大量ROS,并通过受损线粒体漏出,同时可使氧化磷酸化解偶联、ATP合成减少。ROS的增多一方面可使线粒体膜磷脂、呼吸链蛋白产生氧化损伤,加重氧化磷酸化障碍,损害线粒体功能;另一方面漏出的ROS可攻击细胞中其它成分,使细胞发生不可逆的损伤[12]。本研究结果显示缺血后处理能够减少再灌注末线粒体ROS的产生,减轻心肌的线粒体及缺血再灌注损伤,产生心肌保护作用。
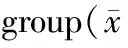
表3 各组心肌线粒体呼吸功能的变化
线粒体氧化磷酸化是两个紧密联系的过程,氧化是底物脱氢或失电子的过程,磷酸化是指ADP与Pi结合生成ATP,氧化的能量用于ATP的合成。线粒体呼吸活性常用呼吸控制比(RCR)和磷氧比(P/O)表示。3态呼吸代表的是ADP对线粒体氧化呼吸的刺激效应,4态呼吸主要反映的是无ADP时呼吸链氧化功能,此时无ATP的合成,是一个无效氧耗过程。P/O指消耗氧与所消耗无机磷的比例,反映线粒体氧化磷酸化效率,RCR指3态呼吸速率与4态呼吸速率之比,两者是评价线粒体完整性和氧化磷酸化偶联程度的灵敏指标。本实验4态呼吸各组之间比较没有明显差别,提示缺血再灌注主要损伤呼吸链的氧化磷酸化偶联,即ATP的合成过程。3态呼吸和RCR下降说明ADP对呼吸链电子传递速率的刺激效应降低,反映氧化磷酸化在一定程度上的脱联。本研究结果显示,缺血后处理可能通过开放特异性mitoKATP通道,使线粒体内膜去极化,减轻线粒体内钙超载[13],对呼吸链复合物有一定保护作用,从而较好地保护了线粒体呼吸功能。
总之,缺血后处理通过维持MMP稳定、减少心肌线粒体ROS的产生、保护线粒体呼吸链及呼吸功能,产生心肌保护作用。该作用可能与缺血后处理激活mitoKATP通道有关,而mitoKATP阻断剂5-HD仅能部分阻断缺血后处理对心肌线粒体的保护作用,因此,还有其它因素共同参与了缺血后处理的心肌保护。
[1] 王 静,李东野,夏 勇,等.转染Akt1基因对缺血再灌注大鼠心肌线粒体通透性转换的影响[J].中国病理生理杂志,2010,26(1):80-85.
[2] 戚仁斌,熊 怡,陆大祥,等.甘氨酰谷氨酰胺在大鼠离体心脏缺血/再灌注损伤中的保护作用研究[J].中国病理生理杂志,2009,25(5):853-858.
[3] Zhao ZQ, Corvera JS, Halkos ME, et al. Inhibition of myocardial injury by ischemic postconditioning during reperfusion: comparison with ischemic preconditioning[J]. Am J Physiol Heart Circ Physiol ,2003,285(2):H579-H588.
[4] Staat P, Rioufol G, Piot C, et al. Postconditioning the human heart[J]. Circulation,2005,112(14):2143-2148.
[5] Yang XM,Proctor JB, Cui L, et al. Multiple, brief coronary occlusions during early reperfusion protect rabbit hearts by targeting cell signaling pathways[J]. J Am Coll Cardiol,2004,44(5):1103-1110.
[6] Yamaguchi R, Andreyev A, Murphy AN, et al. Mitochondria frozen with trehalose retain a number of biological functions and preserve outer membrane integrity[J]. Cell Death Differ, 2007, 14(3):616-624.
[7] Huang M, Camara AK, Stowe DF, et al. Mitochondrial inner membrane electrophysiology assessed by rhodamine-123 transport and fluorescence[J]. Ann Biomed Eng, 2007, 35(7):1276-1285.
[8] Mueller S, Riedel HD, Stremmel W. Determination of catalase activity at physiological hydrogen peroxide concentrations[J]. Anal Biochem, 1997, 245(1):55-60.
[9] Roussel D, Lhenry F, Ecochard L, et al. Differential effects of endurance training and creatine depletion on regional mitochondrial adaptations in rat skeletal muscle[J]. Biochem J, 2000, 350(Pt 2):547-553.
[10]Green DR,Reed JC. Mitochondria and apoptosis[J]. Science,1998, 281(5381):1309-1312.
[11]Sun Y, Wang P, Kerendi F, et al. Hypoxic posteonditioning reduces cardiomyocyte loss by inhibiting ROS generation and intraeellular Ca2+overload[J]. Am J Physiol Heart Circ Physiol,2005, 288(4):H1900-H1908.
[12]Kin H, Zhao ZQ, Sun HY, et al. Postconditioning attenuates myocardial ischemia reperfusion injury by inhibiting events in the early minutes of reperfusion[J]. Cardiovasc Res, 2004, 62(1):74-85.
[13]DuchenMR. Roles of mitochondria in health and disease[J]. Diabetes, 2004, 53(Suppl 1):S96-S102.
Effectofischemicpost-conditioningonmyocardialmitochondrialfunctioninisolatedratheart
LIU Xing-kui, DUAN Zhong-xin, YU Tian
(DepartmentofAnesthesiology,ZunyiMedicalCollege,Zunyi563003,China.E-mail:xkliu@zmc.edu.cn)
AIM: To investigate the protective effect of ischemic post-conditioning on isolated rat myocardial mitochondrial function during ischemia/reperfusion, and to study the role of mitochondrial ATP-sensitive potassium channel(mitoKATP) in myocardial protection.METHODSSprague-Dawley male rats were randomized into 4 groups(n=8 in each group): control group(C), model group(M), ischemic post-conditioning group(IPO) and 5-hydroxydecanoate plus IPO group(5-HD+IPO). The hearts isolated from the SD rats were mounted on a Langendorff apparatus and started with a 20-minute perfusion for equilibration. In C group, the hearts went on perfusion for another 70 min after equilibration. In M group, 4 ℃ St. Thomas cardioplegic solution was administered prior to ischemia, followed by ischemia for 40-minute, and reperfusion for another 30 min. In IPO group, the hearts underwent 40-minute global ischemia after equilibration, then perfusion for 10 s and ischemia for another 10 s. The procedure was repeated 6 times before 28-minute reperfusion. In 5-HD+IPO group, the hearts were perfused with 5-HD(100 μmol/L in K-H solution) and treated as that in IPO group, then reperfusion for 23 min. The reactive oxygen species(ROS), mitochondrial membrane potential(MMP) and respiratory function of myocardial mitochondria were measured at the ends of equilibration and reperfusion.RESULTS(1) Compared with the data collected at the end of equilibrium, the MMP was obviously decreased at the end of reperfusion in all groups, The highest in C group. MMP in 5-HD+IPO group was markedly higher than that in IPO group and M group. MMP in IPO group was higher than that in M group.(2) In contrast to that at the end of equilibrium, ROS was obviously increased at the end of reperfusion in all groups. However, ROS was observably higher in M group than that in the other 3 groups, and ROS in 5-HD+IPO group was markedly higher than that in IPO group and C group. ROS in IPO group was higher than that in C group.(3) The respiratory function of mitochondria was obviously injured at the end of reperfusion in all groups. The arrangement of the mitochondrial respiratory function from the best to the worse was C group > IPO group > 5-HD+IPO group > M group.CONCLUSIONIschemic post-conditioning attenuates myocardial reperfusion injury by maintaining the stability of MMP, decreasing the generation of ROS and preserving the respiratory chain function of mitochondria. The mitoKATPantagonist 5-HD can not completely block the myocardial protective effect of ischemic post-conditioning. Myocardial protective effect of ischemic post-conditioning may achieve by activating mitoKATP, meanwhile the other factors may also take part in the myocardial protective processes.
Mitochondrial function; Ischemic postconditioning; Reperfusion injury; Myocardium
R363
A
10.3969/j.issn.1000-4718.2011.02-004
1000-4718(2011)02-0229-05
2010-06-25
2010-11-29
国家自然科学基金资助项目(No.30740044);贵州省科技基金资助项目[No.(2007)2121号]
△通讯作者Tel:0852-8608567;E-mail:xkliu@zmc.edu.cn

