KAI1对人胰腺癌MiaPaCa-2细胞自噬的影响
吴春燕 郭晓钟 王华
·论著·
KAI1对人胰腺癌MiaPaCa-2细胞自噬的影响
吴春燕 郭晓钟 王华
目的观察感染Ad5-KAI1前后人胰腺癌细胞MiaPaCa-2自噬水平的变化,并初步探讨其机制。方法应用无KAI1表达的人胰腺癌细胞MiaPaCa2,通过感染带有KAI1目的基因的复制缺陷型腺病毒Ad5-KAI1使细胞表达KAI1,以Ad5-null感染作为阴性对照,亲本细胞为空白对照。用透射电镜观察细胞自噬小体,共聚焦显微镜观察自噬标志LC3颗粒。应用阻断剂PD98059和LY294002干预细胞,蛋白质印迹法检测自噬相关蛋白beclin 1、LC3-Ⅱ、LC3-Ⅰ及ERK-1/2、磷酸化ERK-1/2(p- ERK-1/2)、AKT、p-AKT的表达。结果以100 MOI Ad5-KAI1感染细胞24 h,表达KAI1蛋白的细胞达(84.97±8.56)%;LC3颗粒从4个左右增加到20个以上;细胞线粒体肿胀、变性,胞质内双层膜样结构增加;Beclin1表达增加(1.4±0.3)倍,LC3-Ⅱ/LC3-Ⅰ表达增加(8.00±2.78)倍。PI3K阻断剂LY294002预处理细胞后可以有效地抑制MiaPaCa-2细胞AKT的磷酸化(2.756降至1.516),但不能抑制LC3-Ⅱ/LC3-Ⅰ比值的增加(0.770增加到1.403)。ERK阻断剂PD98059预处理细胞后不仅可以有效地抑制MiaPaCa-2细胞ERK的磷酸化(1.637降至0.403),而且可以抑制beclin 1蛋白表达的上调(2.377降至1.150)和LC3-Ⅱ/LC3-Ⅰ比值的增加(2.225降至0.680)。结论KAI1明显促进 MiaPaCa2细胞内自噬,它是通过ERK而不是AKT磷酸化途径促进自噬的。
胰腺肿瘤; 基因,肿瘤抑制; 自噬; KAI1
体外实验显示,KAI1通过抑制胰腺癌细胞的运动、迁移来抑制癌细胞的转移,同时抑制癌细胞的增殖[1-2]。但体内实验提示KAI1对荷瘤裸鼠的原位瘤形成无影响[3]。近来体内实验发现KAI1是缺氧的目的基因。缺氧不仅诱导自噬,而且诱导KAI1的表达[4];缺氧和自噬的增加可以提高胰腺癌的恶性程度[5-6]。因此,本研究观察KAI1对人胰腺癌细胞株MiaPaCa-2自噬的影响,探讨其作用机制。
材料与方法
一、细胞培养及腺病毒感染
人胰腺癌细胞MiaPaCa-2由本实验室保存。应用含10%胎牛血清的高糖DMEM常规培养,2~3 d传代1次。取对数生长期细胞,用无血清培养液培养1 h,分别加入终浓度为10 μmol/ml 的阻断剂PD98059和LY294002(Sigma公司)继续培养12 h。
带有人KAI1目的基因的重组腺病毒载体Ad5-KAI1和对照腺病毒Ad5-null由本实验室前期构建[7]。Ad5-KAI1和Ad5-null滴度分别为8×109和1×1011pfu/ml,以25、50、100、200 MOI的Ad5-KAI1感染应用各阻断剂及未应用阻断剂的MiaPaCa-2细胞24 h,以未感染病毒的细胞作为对照。以100 MOI的Ad5-KAI1感染细胞0、6、12、24、48 h。
二、KAI1蛋白表达分析
收集上述各组各时间点MiaPaCa-2细胞,PBS洗涤及重悬细胞,加入抗人-CD82FITC抗体避光室温孵育30 min,PBS洗后上流式细胞仪分析。
三、细胞自噬水平检测
取1×106/ml细胞悬液200 μl和1 μl质粒EGFP-LC3(3 μg/μl,Yoshimori惠赠),用NeonTM电转仪(Invitrogen公司)转染,G418筛选,获得表达EGFP-LC3 的细胞,应用100 MOI的Ad5-KAI1和Ad5-null感染细胞24 h,4%多聚甲醛固定,DAPI(KeyGEN公司)染色,共聚焦显微镜计数每个细胞内GFP标记的LC3颗粒数。
四、细胞自噬泡小体的超微结构观察
从培养皿内直接刮下细胞并收集,PBS洗2遍后悬浮于含2%多聚甲醛、2%戊二醛和0.2 mol/L二甲基胂酸钠的缓冲液(pH 7.4)中。用含1%(v/v)锇酸的二甲基胂酸钠固定,1%乙酸双氧铀染色,脱水后用Durcopan(Sigma公司)包埋,超薄切片,在透射电镜(HITACHI H-7650)下观察细胞超微结构。
五、自噬相关蛋白beclin 1、LC3-Ⅱ/LC3-Ⅰ及ERK-1/2、磷酸化ERK-1/2(p-ERK-1/2)、AKT、磷酸化AKT(p-AKT)的检测
常规提取各组细胞蛋白,采用蛋白质印迹法检测beclin 1、LC3-Ⅱ、LC3-Ⅰ表达。抗LC3、抗beclin1、抗p-ERK1/2、抗ERK-1/2、抗β-actin、抗p-AKT和抗AKT 抗体均1∶1000稀释。最后用ECL进行化学发光,扫描,以目的条带与内参β-actin条带灰度值比表示目的蛋白的表达量,以对照组的蛋白表达量为1,计算感染组蛋白表达量的倍数。
六、统计学分析
结 果
一、KAI1蛋白的表达
0、25、50、100、200 MOI的Ad5-KAI感染细胞24 h后,表达KAI1的细胞分别为(0.55±0.05)%、(63.75±6.46)%、(71.52±6.11)%、(81.84±5.69)%、(83.33±4.38)%;100 MOI Ad5-KAI感染细胞0、6、12、24、48 h,表达KAI1的细胞分别为0.20%、(15.57±5.68)%、(47.59±10.92)%、(84.97±8.56)%、(81.88±2.02)%。KAI1蛋白的表达均随感染病毒的滴度增高和感染时间的延长而增加,但以100 MOI Ad5-KAI1感染24 h为最高。
二、细胞自噬颗粒数的变化
对照组、Ad5-null组、Ad5-KAI1组细胞的自噬颗粒平均数在6 h时分别为3.4±1.5、2.8±1.1、17.0±1.7;12 h时为4.7±1.6、4.6±1.8、21.3±2.5;24 h时为4.2±2.1、4.4±1.5、21.6±5.8。Ad5-KAI1组细胞的自噬颗粒随感染时间的延长而增加,且较Ad5-null组和对照组显著增加(P值均<0.01,图1)。对照组与Ad5-null组间差异无统计学意义。
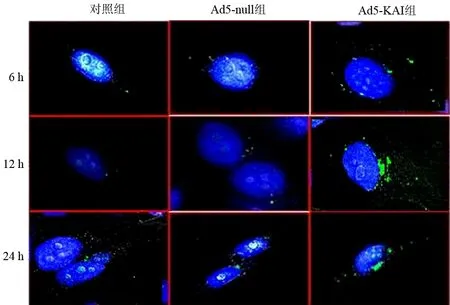
图1 各组细胞内的GFP-LC3颗粒
三、细胞超微结构的变化
Ad5-KAI1组细胞在感染24 h后细胞线粒体肿胀、变性,胞质内双层膜样结构增加。而Ad5-null组细胞未见明显变化(图2)。
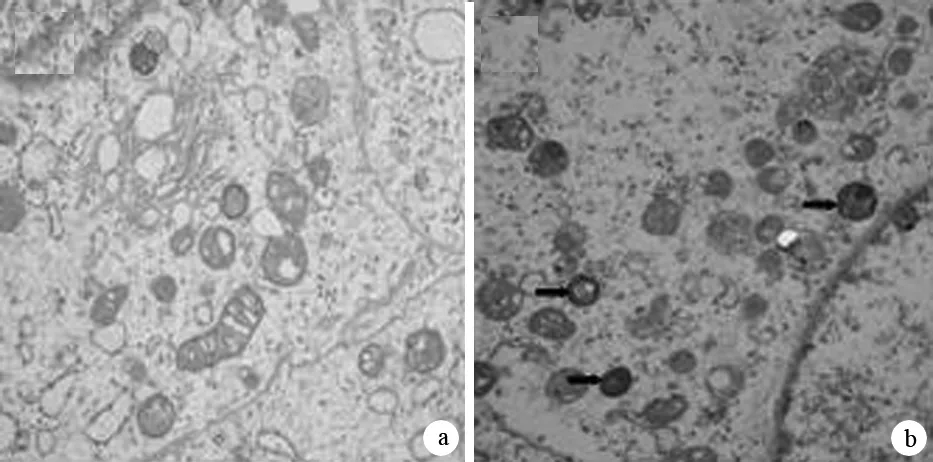
图2Ad5-null组(a)和Ad5-KAI1组(b)MiaPaCa-2细胞的自噬小体(×4000)
四、Beclin 1、LC3-Ⅱ/LC3-Ⅰ蛋白表达的变化
Ad5-null组、Ad5-KAI1组细胞在感染6 h时beclin 1表达量为对照组的(1.2±0.1)、(1.8±0.1)倍,12 h时为(1.4±0.4)、(2.7±0.3)倍,24 h时为(1.1±0.1)、(1.4±0.3)倍;LC3-Ⅱ/LC3-Ⅰ蛋白表达在6 h时为对照组的(0.94±0.06)、(1.63±0.21)倍,12 h时为(1.14±0.06)、(4.03±1.56)倍,24 h时为(1.24±0.21)、(8.00±2.78)倍。Ad5-KAI1组较Ad5-null组均显著增加(P值均<0.05)。
五、ERK-1/2、p-ERK-1/2、AKT、p-AKT表达的变化
Ad5-KAI1组细胞AKT和ERK的磷酸化水平及LC3-Ⅱ/LC3-Ⅰ比值由对照组的0.256、0.787、0.545提高到2.756、1.637和2.225。PI3K阻断剂LY294002预处理后,细胞AKT的磷酸化水平降至1.516,但LC3-Ⅱ/LC3-Ⅰ比值却增加到1.403。ERK阻断剂PD98059预处理后,细胞ERK的磷酸化水平从1.637降至0.403,beclin1蛋白表达从2.377降到1.150,LC3-Ⅱ/LC3-Ⅰ比值从2.225降到0.680(P值均<0.01,图3)。
讨 论
自噬是实体瘤抵抗缺氧、缺血微环境,适应恶劣环境生存的机制之一[5]。自噬既具有抗肿瘤也具有促肿瘤作用[6-7]。一方面,抑制肿瘤细胞中的自噬有利于肿瘤的治疗;另一方面促进自噬通过减少基因突变有利于肿瘤的预防[8],所以自噬调节是一种有前景的治疗和预防肿瘤的新途径。
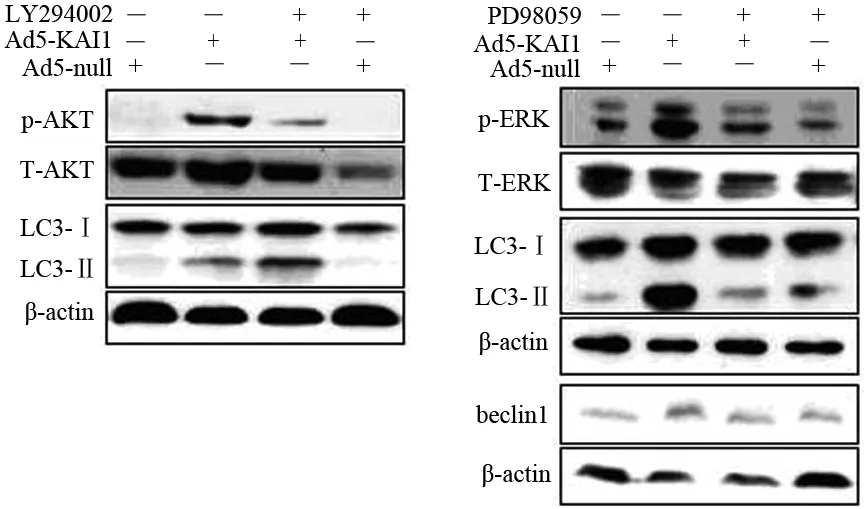
图3应用阻断剂前后ERK和AKT磷酸化及LC3和beclin1的表达
KAI1是肿瘤转移抑制基因,目前尚未见有关KAI1与自噬关系的研究。本研究将携带KAI1基因的重组腺病毒Ad5-KAI1感染高转移性、无KAI1表达、且自噬水平低下的人胰腺癌细胞MiaPaCa-2。结果显示,AD5-KAI1感染的细胞表达KAI1、beclin1蛋白,LC3-Ⅱ/LC3-Ⅰ比值增加,LC3颗粒增多,细胞内形成更多的自噬小泡,证实KAI1能促进MiaPaCa-2细胞的自噬,其机制主要是通过增加beclin 1蛋白表达和LC3-Ⅰ向LC3-Ⅱ的转化来促进自噬的。
自噬与细胞增殖、凋亡共用许多信号通路,PI3K/AKT/PKB途径在自噬的调节中起重要的作用。许多抑癌基因如PTEN、TSC1/2和p53均是通过PI3K mTOR信号途径促进自噬的,许多癌基因也是通过PI3K途径抑制自噬的[9]。本结果显示,感染Ad5-KAI1的细胞促进AKT/PKB和ERK的磷酸化。AKT阻断剂LY294002干预后能有效阻断KAI1引起的AKT磷酸化,但未能阻断KAI1诱导的LC3-Ⅰ向LC3-Ⅱ转化;而ERK阻断剂PD98059不仅可以有效阻断KAI1引起的ERK磷酸化,同时也阻断KAI1引起的beclin 1表达上调和LC3-Ⅰ向LC3-Ⅱ转化,表明KIA1不是通过PI3K/AKT/PKB途径促进自噬的,而可能是通过Ras/Raf/MEK/ERK信号通路促进自噬的。
[1] 郭晓钟,徐建华,刘民培,等. KAI1基因抑制胰腺癌细胞转移机制的探讨.中华内科杂志,2004,43:360-362.
[2] Guo XZ, Xu JH,Liu MP,et al. KAI1 inhibits anchorage-dependent and -independent pancreatic cancer cell growth. Oncol Rep,2005,14:59-63.
[3] Yang X,Wei LL,Tang C, et al. Overexpression of KAI1 suppresses in vitro invasiveness and in vivo metastasis in breast cancer cells. Cancer Res,2001,61:5284-5288.
[4] Kim B, Boo K, Lee JS, et al.Identification of the KAI1 metastasis suppressor gene as a hypoxia target gene. Biochem Biophys Res Commun,2010,393:179-184.
[5] Fujii S,Mitsunaga S, Yamazaki M, et al. Autophagy is activated in pancreatic cancer cells and correlates with poor patient outcome. Cancer Sci,2008,99:1813-1819.
[6] Mathew R, Karantza-Wadsworth V, White E. Role of autophagy in cancer. Nat Rev Cancer,2007,7:961-967.
[7] Yang JM, Peng ZH, Si SH, et al.KAI1 gene suppresses invasion and metastasis of hepatocellular carcinoma MHCC97-H cells in vitro and in animal models. Liver Int,2008,28:132-139.
[8] Li J,Hou N, Faried A, et al. Inhibition of autophagy augments 5-fluorouracil chemotherapy in human colon cancer in vitro and in vivo model. Eur J Cancer,2010,46:1900-1909.
[9] Meley D,Pattingre S, Codogno P. PI3 kinases and the control of autophagia. Bull Cancer,2006,93:439-444.
2011-01-26)
(本文编辑:吕芳萍)
EffectofKAI1onautophagyofhumanpancreaticcancercelllineMiaPaCa-2
WUChun-yan,GUOXiao-zhong,WANGHua.
DepartmentofGastroenterology,ShenyangGeneralHospitalofPLA,Shenyang110016,China
GUOXiao-zhong,Email:Guoxiaozhong1962@163.com
ObjectiveTo study the change of autophagy of human pancreatic cancer cell MiaPaCa-2 before and after Ad5-KAI1 tranfection, and to investigate the possible mechanism.MethodsThe MiaPaCa-2 cells without KAI1 expression were infected with Ad5-KAI1 with KAI1 target gene, and Ad5-null was used as negative control, and parental cell was used as blank control. The formation of autophagosomes was observed by electromicroscopy. The green fluorescent protein-labeled light chain 3 (LC3) associations with autophagosome membranes was detected by confocal microscopy. PD98059, LY294002 were applied to pre-treat the cells. The expression levels of beclin 1, AKT, ERK, the phosphorylation of AKT and ERK protein and the ratio of LC3-Ⅱ to LC3-Ⅰ were detected by Western blotting.ResultsAfter 100 MOI Ad5-KAI1 infections for 24 h, the rate of cell expressing KAI1 protein reached (84.97±8.56)%, number of LC3 increased from 4 to 20; and swelling, degeneration of mitochondria was observed, and bilayer-like structure in cytoplasm was found. The expression of beclin1 increased (1.4±0.3) folds, and the expression of LC3-Ⅱ/LC3-Ⅰincreased (8.00±2.78)folds. PI3K blockade LY294002 pretreatment significantly suppressed the phosphorylation of AKT of MiaPaCa-2 (2.756vs1.516), but it did not inhibit the increase of ratio of LC3-Ⅱ to LC3-Ⅰ (0.770vs1.403). ERK blockade PD98059 pretreatment not only significantly suppressed the phosphorylation of ERK of MiaPaCa-2 (1.637vs0.403), but also inhibit the up-regulation of beclin 1 protein expression (2.377vs1.150) and increase of ratio of LC3-Ⅱ to LC3-Ⅰ(2.225vs0.680).ConclusionsKAI1 can significantly induce autophagy of human pancreatic cell line MiaPaCa-2 through phosphorylation of ERK rather than AKT.
Pancreatic neoplasms; Genes, tumor suppressor; Autophagy; KAI1
10.3760/cma.j.issn.1674-1935.2011.06.006
国家自然科学基金(81071982、30470798)
110015 沈阳,沈阳军区总医院消化内科(吴春燕、郭晓钟);北京军事医学科学放射与辐射医学研究所(王华)
郭晓钟,Email:Guoxiaozhong1962@163.com

