Artemin及其受体GFRα3在胰腺导管癌组织中的表达及意义
孟令新 丁兆军 陈希平 费立升 张红 王晓芳
·论著·
Artemin及其受体GFRα3在胰腺导管癌组织中的表达及意义
孟令新 丁兆军 陈希平 费立升 张红 王晓芳
目的探讨Artemin及其受体GFRα3(glial cell line-derived neurotrophic factor receptor α3)在胰腺导管癌组织中的表达及意义。方法采用免疫组化、PCR、荧光定量RT-PCR和基因测序等方法检测100例人胰腺导管癌组织标本和40例正常胰腺组织的Artemin、GFRα3表达,分析它们与临床病理学特征,尤其与嗜神经转移的关系。结果100例标本中64例存在神经转移,转移率为64%。Artemin、GFRα3蛋白在胰腺癌组织中的表达量分别为正常胰腺组织的(2.697±0.231)倍和(2.599±0.588)倍;mRNA的表达量分别为正常胰腺组织的7.01和4.63倍。胰腺癌组织Artemin、GFRα3蛋白表达与肿瘤部位、分化程度、TNM分期、神经侵犯、淋巴结转移相关(P<0.01),与患者年龄、性别、肿瘤大小均无关。且靠近神经组织的癌细胞Artemin、GFRα3阳性程度高于远离神经组织癌细胞。结论Artemin、GFRα3参与胰腺癌的发生,两者在胰腺癌组织中的高表达和胰腺癌嗜神经性关系密切。
胰腺肿瘤; Artemin; GFRα3; 肿瘤转移; 疼痛; 嗜神经浸润
胰腺癌神经转移率高,且与顽固性腹痛密切相关,但胰腺癌嗜神经性确切分子机制尚不清楚。作为胶质源性神经营养因子(GDNF)家族成员之一,Artemin及其受体GFRα1~4/RET的主要生理功能是促进各种神经性疾病的修复,影响细胞的生长、分化和凋亡,但它们在人胰腺癌组织中的表达及与肿瘤神经转移的关系研究甚少。本研究检测Artemin及受体GFRα3在胰腺癌组织中的表达,分析其与肿瘤临床病理特征的关系,探讨其临床意义。
资料与方法
一、临床资料
收集日照市人民医院病理科2001年10月至2009年10月手术切除的胰腺癌组织标本100例,均经病理确诊为胰腺导管癌。其中男性57例,女性43例,年龄34~72岁,平均(50±10)岁;按2002年UICC(第6版)胰腺癌TNM分期方法分期,Ⅰ期12例,Ⅱ期35例,Ⅲ期31例,Ⅳ期22例;胰头癌48例,胰体尾癌52例;术前均未行任何放、化疗等治疗。正常胰腺标本取自因胃肠道、胆管或胆囊病变行胰十二指肠联合切除术患者,共40例,男性27例,女性13例,年龄33~68岁,平均(47±9)岁。
二、病理学检查
胰腺组织常规固定、包埋、切片、HE染色,光镜下观察神经外膜、束膜或内膜下神经周围间隙有无癌细胞存在和(或)沿神经周围间隙扩散。神经浸润类型分为:侵入型(癌细胞侵入神经束膜内);围神经型(癌细胞围绕神经纤维生长);近神经型(神经组织内见癌细胞,其数量尚不足以围绕神经组织);混合型(两种或两种以上)[1]。
三、Artemin、GFRα3蛋白检测
采用常规免疫组化法。SABC免疫组化试剂盒及DAB显色试剂盒均购自北京中杉生物工程技术有限公司,抗Artemin、GFRα3单克隆抗体分别购自史瑞可生物(上海)有限公司和北京友谊中联生物科技有限公司。胞质、胞膜着棕黄色为阳性表达。结果判断:40×10倍视野下随机选5个视野,计数着色强度和阳性细胞百分数。着色强度按染色深度分:阴性0分、浅黄色1分、棕黄色2分、棕褐色3分。每例分值按文献[2]计算,为阳性百分数×着色强度+1。
四、Artemin、GFRα3 mRNA检测
Trizol(Invitrogen公司)提取标本总RNA,取2 μg总RNA用M-MLV逆转录酶(Promega公司)逆转录为cDNA。Artemin上游5′-TGGCCGCTCTGG-CTCTGCTGA-3′,下游5′-TGAGGTCTCTGG-TGTCTTTTAGG-3′,产物382 bp;GFRα3上游5′-ATT-GGCACAGTCATGACTCCCAAC-3′,下游5′-GAGGAGCAGCCATTGATTTTGTGG-3′,产物260 bp;内参β-actin上游5′-ACCCCCACTGAAAAAGATGA-3′,下游5′-ATCTTCAAACCTCCATGATG-3′,产物136 bp。引物均由北京奥科生物技术有限责任公司合成。PCR反应条件:95℃ 2 min,95℃ 30 s,69℃(Artemin)或65℃(GFRα3)或57℃(β-actin)30 s、72℃ 1 min,35个循环,最后72℃ 5 min。PCR产物经琼脂糖凝胶电泳,回收,送上海基康生物技术有限公司测序。另外,在ABI GeneAmp 5700仪上行实时PCR,反应条件同上。通过仪器所带软件获得相应Ct值。mRNA 表达量通过公式2-△Ct计算,△Ct=Ct目的基因-Ctβ-actin。以正常胰腺组织的mRNA表达量为1,计算胰腺癌mRNA表达的倍数。
五、统计学处理
结 果
一、胰腺癌组织标本神经转移情况
100例标本中64例存在神经转移,转移率为64%,其中侵入型36例,围神经型12例,近神经型4例,混合型12例(图1)。
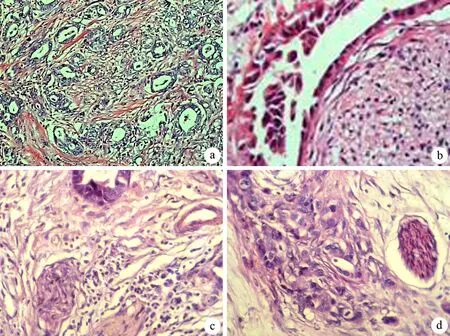
a:侵入型(×200);b:围神经型(×400);c:围神经组织并侵入神经束膜(×200);d:近神经型(×200)
图1胰腺癌的不同类型神经转移(HE)
二、胰腺癌组织Artemin、GFRα3蛋白表达及其与临床病理特征的关系
Artemin、GFRα3蛋白阳性物质呈棕黄色颗粒,主要定位于胰腺癌细胞的胞质,胞膜少量着色,部分神经鞘膜呈GFRα3阳性表达(图2)。Artemin、GFRα3在胰腺癌组织中的表达量分别为正常胰腺组织的(2.697±0.231)倍和(2.599±0.588)倍。在胰腺癌组织中,Artemin与GFRα3的表达呈正相关(r=0.848,P<0.01)。
胰腺癌组织Artemin、GFRα3蛋白表达与肿瘤部位、分化程度、TNM分期、神经侵犯、淋巴结转移相关(P<0.01),与患者年龄、性别、肿瘤大小均无关(表1)。此外,靠近神经组织的癌细胞Artemin、GFRα3阳性程度高于远离神经组织癌细胞。

图2胰腺癌组织中Artemin(a)、GFRα3(b)表达(SABC ×200)

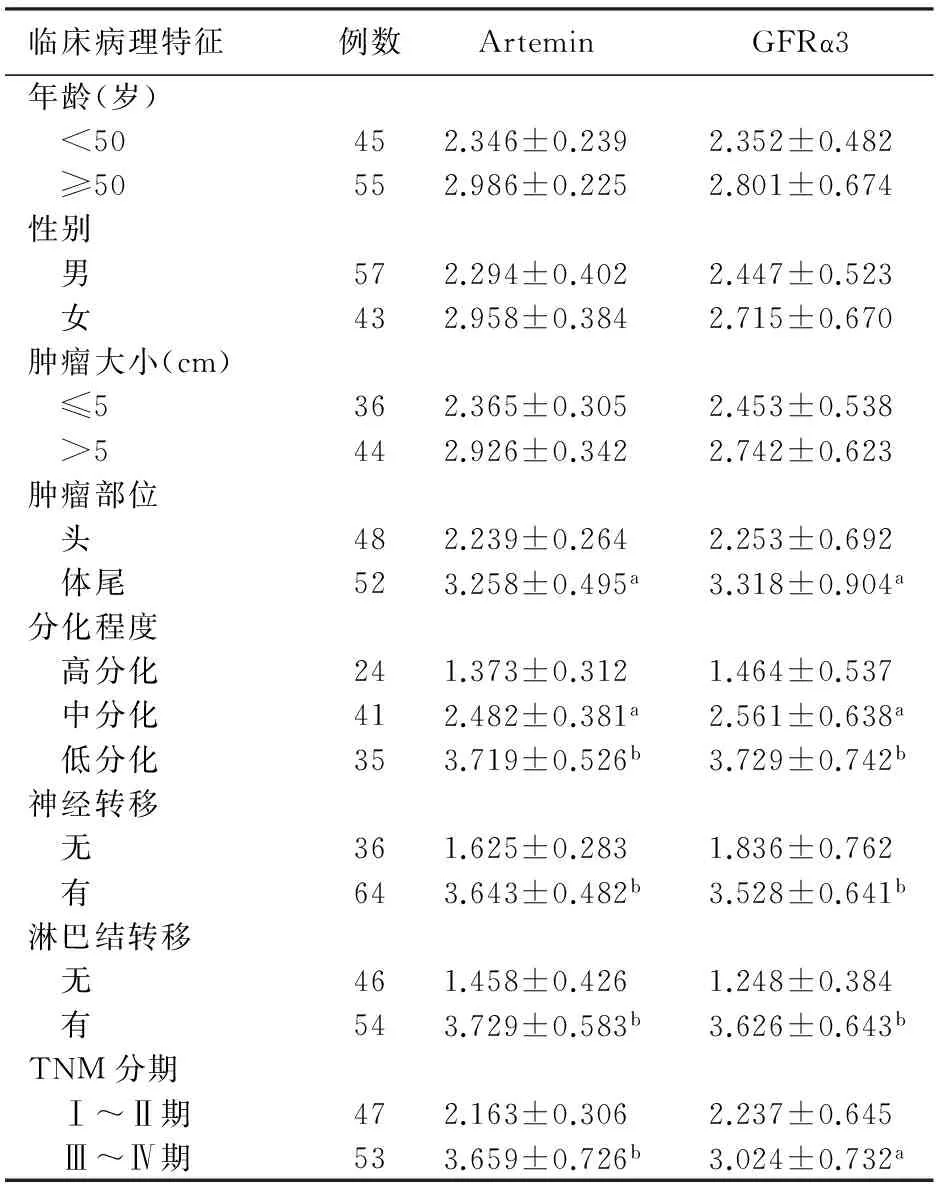
临床病理特征例数ArteminGFRα3年龄(岁) <50452.346±0.2392.352±0.482 ≥50552.986±0.2252.801±0.674性别 男572.294±0.4022.447±0.523 女432.958±0.3842.715±0.670肿瘤大小(cm) ≤5362.365±0.3052.453±0.538 >5442.926±0.3422.742±0.623肿瘤部位 头482.239±0.2642.253±0.692 体尾523.258±0.495a3.318±0.904a分化程度 高分化241.373±0.3121.464±0.537 中分化412.482±0.381a2.561±0.638a 低分化353.719±0.526b3.729±0.742b神经转移 无361.625±0.2831.836±0.762 有643.643±0.482b3.528±0.641b淋巴结转移 无461.458±0.4261.248±0.384 有543.729±0.583b3.626±0.643bTNM分期 Ⅰ~Ⅱ期472.163±0.3062.237±0.645 Ⅲ~Ⅳ期533.659±0.726b3.024±0.732a
注:aP<0.05,bP<0.01
三、 Artemin、GFRα3 mRNA的表达
Artemin和GFRα3测序结果见图3和图4。应用NCBI Blast 2.2.16:Nucleotide sequence(BLAST Basic Local Alignment Search Tool)进行基因比对, Artemin序列与GenBank提供的定位于染色体1p32~p33区已知序列(N:AF115765)完全一致。GFRα3基因序列与GenBank提供的定位于染色体5q31.2~q32的已知序列(N:AF051767)亦完全一致。

图3 Artemin基因测序图(Forward)
图4 GFRα3基因测序图(Forward)
在Rn=0.01水平,Artemin、GFRα3 mRNA在胰腺癌组织中表达的数据见表2,癌组织的Artemin、GFRα3 mRNA表达量分别为正常胰腺组织的7.01和4.63倍。
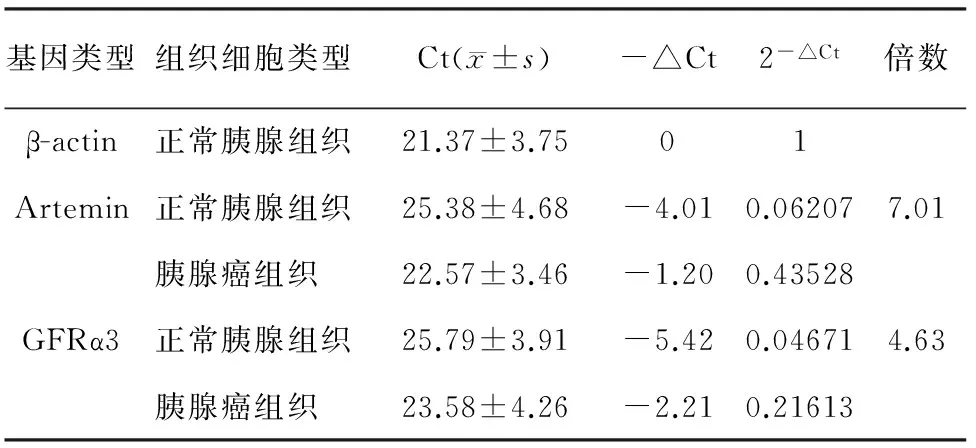
表2 正常及胰腺癌组织细胞中各基因表达的比较
注:△Ct为循环数差值
讨 论
Artemin是GDNF 家族最晚被发现的成员,由113个氨基酸和7个保守的半胱氨酸残基组成。Artemin与neurtuin(NTN)及persephin(PSP)有45%同源性,与GDNF 有大约30%的同源性。Artemin倾向于结合GFRα3受体,形成配基/受体复合物,通过糖基-磷脂酰肌醇(GPI) 锚定于细胞质膜,激活Ret,从而传递信号。在胚胎发育中,肾、胃肠道、神经系统、软骨和肌肉细胞高水平表达Artemin。Artemin亦广泛表达于多种肿瘤组织中,参与肿瘤发生、发展。文献报道[3],GDNF可通过增加金属蛋白酶9的活性而促进胰腺癌细胞的侵袭性。体外实验证明[4],将表达GDNF mRNA 并分泌GDNF的恶性胶质瘤细胞系与胰腺癌细胞系共同培养,胰腺癌细胞向胶质和神经性肿瘤细胞迁移能力大幅提高,且这种迁移与GDNF 的浓度明显相关,用抗GDNF 抗体干预可明显减弱这种迁移作用。神经转移与临床分期、淋巴管浸润密切相关,造成顽固性腹痛,严重影响生活质量[5-6]。
Ito等[7]报道,Artermin在胰内神经丛高表达。Ceyhan等[8]研究发现,Artemin和GFRα3/Ret主要定位于原发灶及转移灶癌细胞、神经束和动脉壁上,在胰腺导管癌中的表达比正常胰腺组织明显增加。Artemin的高表达可增加癌细胞的浸润侵袭能力高达5倍,但与胰腺癌性疼痛无相关性。
本实验结果显示,胰腺导管癌组织的神经浸润率高达64%。Artemin、GFRα3的mRNA和蛋白的表达在胰腺癌中明显高于正常胰腺组织,提示它们参与胰腺癌发生。Artemin表达在有神经浸润组明显高于无神经浸润组,且靠近神经组织的癌细胞阳性程度高于远离神经组织的癌细胞,提示Artemin与胰腺癌神经转移关系密切。而胰体尾部癌Artemin表达水平明显高于胰头癌,部分解释了临床上胰体尾癌患者往往以腹部疼痛为主诉的原因。此外,Artemin表达水平与癌细胞分化程度、TNM分期、淋巴结转移有关,提示它有可能作为预测预后的靶标之一。在胰腺癌组织中,GFRα3与Artemin表达呈正相关,推测由胰腺癌细胞分泌的Artemin,一方面可能通过旁分泌途径,与神经鞘膜上的GFRα3受体结合,作用于神经细胞,为神经细胞轴突的生长提供适宜的微环境和化学趋化性,促进神经轴突向肿瘤方向生长,进而造成癌细胞侵犯神经纤维;另一方面,可能通过自分泌途径,作用于癌细胞自身表面的GFRα3受体,通过Artemin-GFRα3生物轴系统,激活细胞内信号转导通路,促进癌细胞增殖。
[1] 徐东波,孙保存.腺样囊性癌的临床病理分析及神经浸润机制研究.2006年中国博士学位论文全文数据库,2006,57.
[2] Zhigang Z,Wenlv S.Prostate stem cell antigen (PSCA) expression in human prostate cancer tissues:implications for prostate carcinogenesis and progression of prostate cancer.Jpn J Clin Oncol,2006,36:121.
[3] Funahashi H,Takeyama H,Sawai H,et al.Alteration of integrin expression by glial cell line-derived neurotrophic factor (GDNF) in human pancreatic cancer cells.Pancreas,2003,27:190-196.
[4] Bockman DE,Buchler M,Beger HG.Interation of pancreatic ductal carcinoma with nerve damage.Gastroenterology,1994,107:219-230.
[5] Hirai I,Kimura W,Ozawa K,et al.Perineural invasion in pancreatic cancer.Pancreas,2002,24:15-25.
[6] 程鹏,金钢,胡先贵,等.新生淋巴管在胰腺导管腺癌周围神经丛微转移过程中的机制研究.中华胰腺病杂志,2009,9:363-366.
[7] Ito Y, Okada Y, Sato M,et al.Expression of glial cell line-derived neurotrophic factor family members and their receptors in pancreatic cancers.Surgery,2005,138:788-794.
[8] Ceyhan GO,Giese NA,Erkan M,et al.The neurotrophic factor artemin promotes pancreatic cancer invasion.Ann Surg,2006,244:274-281.
2010-01-20)
(本文编辑:屠振兴)
ExpressionandsignificanceofarteminanditsreceptorsGFRα3inpancreaticductaladenocarcinoma
MENGLing-xin,DINGZhao-jun,CHENXi-ping,FEILi-sheng,ZHANGHong,WANGXiao-fang.
DepartmentofOncological,RizhaoPeopleHospital,JiningMedicalCollege;RizhaoCancerTherapyCenter,Rizhao276826,China
MENGLing-xin,Email:menglx001623@163.com
ObjectiveTo investigate artemin and its receptors GFRα3 expression in human pancreatic ductal adenocarcinoma and its significance.MethodsExpression and distribution of artemin and GFRα3 in 100 cases of human pancreatic ductal adenocarcinoma(PDAC) and 40 cases of normal pancreatic tissue were detected by immunohistochemistry and RT-PCR, quantitative RT PCR. Relations of artemin and GFRα3 with clinicopathological characteristics, especially nerve invasion were analyzed.ResultsNerve invasion was detected in 64 out of 100 cases of PDAC, and the rate of nerve invasion was 64%. The ratio of expression of Artemin, GFRα3 protein in PDAC/ normal pancreatic tissue was 2.697±0.231 and 2.599±0.588; the ratio of expression of Artemin, GFRα3 mRNA was 7.01 and 4.63. Artemin and GFRα3 expression were associated with tumor location, differentiation degree, TNM staging, nerve invasion node metastasis, but it was not associated with age, sex and tumor size. Artemin and GFRα3 expression was more positively expressed in cancer cells close to nerve tissue than cells far from nerve tissue.ConclusionsArtemin and GFRα3 were involved in the development of pancreatic cancer and their high expression was closely related to perineural invasion.
Pancreatic neoplasms; Artemin; GFRα3; Neoplasm metastasis; Pain; Perineural invasion
10.3760/cma.j.issn.1674-1935.2010.06.009
山东省自然科学基金(ZR2010 HL053)
276826 山东省日照市,济宁医学院附属日照市人民医院肿瘤科,日照市肿瘤治疗中心(孟令新、丁兆军、陈希平、费立升、张红);天津医科大学附属肿瘤医院国家“211工程”中心实验室(王晓芳)
孟令新,Email:menglx001623@163.com

