单核细胞趋化蛋白1在重症急性胰腺炎相关肺损伤中的作用
许永春 李兆申 龚燕芳 金晶
·论著·
单核细胞趋化蛋白1在重症急性胰腺炎相关肺损伤中的作用
许永春 李兆申 龚燕芳 金晶
目的探讨单核细胞趋化蛋白1(MCP-1)在急性坏死性胰腺炎(ANP)早期并发急性肺损伤(ALI)发病机制中的作用。方法按数字表法将40只SD大鼠随机分为对照组和ANP 3、6、12 h组,每组10只。采用15%左旋盐酸精氨酸2.0 mg/g体重腹腔注射方法制作大鼠ANP模型,观察胰腺及肺组织病理学改变,检测肺湿/干重比,RT-PCR检测肺组织MCP-1 mRNA的表达。结果腹腔注射左旋盐酸精氨酸后大鼠胰腺发生出血、坏死,符合ANP病理改变。ANP组肺组织明显水肿,3、6、12 h的病理评分分别为3.75±0.58、5.50±0.63、5.86±0.54;肺湿/干重比为4.85±0.38、4.97±0.47、5.03±0.46;肺组织MCP-1 mRNA表达量为0.36±0.08、0.56±0.15、0.72±0.21。均较对照组的0.12±0.05、4.32±0.33、0.21±0.05显著升高(P<0.05或<0.01),且MCP-1 mRNA表达与肺湿/干重比及肺组织损害程度均呈正相关(r=0.75,r=0.89,P<0.05)。结论ANP早期肺组织MCP-1 mRNA表达上调,并在ANP并发的ALI中发挥重要作用。
胰腺炎,急性坏死性; 单核细胞趋化蛋白1; 肺组织; 基因表达
重症急性胰腺炎(severe acute pancreatitis,SAP)易并发急性肺损伤(acute lung injury,ALT),继续发展甚至导致急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)。 目前认为,炎细胞的激活、迁移、聚集以及激活炎细胞所释放的细胞因子,如单核细胞趋化蛋白1(monocyte chemotactic protein-1,MCP-1)等参与了此过程[1]。本研究检测急性坏死性胰腺炎(ANP)大鼠肺组织MCP-1的表达,探讨其在ANP早期肺损伤中所起的作用。
材料与方法
一、材料
健康雄性SD大鼠,体重200~250 g,上海第二军医大学实验动物中心提供;左旋盐酸精氨酸(L-arginine),分析纯级 (上海华美生物工程公司提供),灭菌生理盐水配置成15%溶液(pH7.0)。宝生物工程(大连)有限公司的一步反应法RT-PCR试剂盒;MCP-1及内参照β-actin引物根据GenBank中基因序列自行设计,由上海生工生物工程公司合成。
二、方法
1.动物模型制作与分组:按数字表法将大鼠随机分为对照组和ANP 3、6、12 h组,每组10只。采用腹腔注射15%左旋盐酸精氨酸2.0 mg/g体重两次、间隔1 h的方法制备ANP模型。对照组腹腔注射等体积无菌生理盐水。按各时间点处死大鼠,股静脉采血1 ml,离心取上清置-20℃冰箱保存。
2.血清生化指标的检测:采用酶法(麦芽6糖)检测血淀粉酶,葡萄糖氧化酶法检测血糖,化学比色法检测血钙,酶法检测肌酐,速率法检测谷丙转氨酶,在HITACHI 7600型全自动生化分析仪(日本)上按标准规程操作。
3.肺湿/干重比测定:取肺组织置于60℃干燥箱内烤48 h至恒重,计算肺组织湿/干重比。
4.胰腺及肺组织病理学评价:取胰腺和部分左肺组织常规甲醛固定,脱水,石蜡包埋,HE染色,由专业病理医师阅片。肺组织切片每张随机选10个高倍镜视野。肺组织损伤评分标准[2]见表1。
5.肺组织MCP-1 mRNA表达检测:按Trizol液说明抽提新鲜肺组织总RNA。MCP-1引物(扩增片段290 bp)序列:上游5′-TTCACTGGCAAGATGATCCC-3′,下游5′-TGCTTGAGGTGGTTGTGGAA-3′;β-actin引物(扩增片段600 bp)序列:上游5′-AGGGTG-TGATGGTGGGTATG-3′,下游5′-CATAGC-TCTTCTCCAGGGAG-3′。RT-PCR反应条件:50℃ 60 min,95℃ 5 min;94℃ 30 s、60℃(MCP-1)或55℃(β-actin)30 s、70℃ 30 s, 35个循环,最后72℃延伸10 min。PCR产物经1.5%琼脂糖凝胶电泳,凝胶图像扫描仪扫描,以MCP-1 mRNA条带/β-actin条带的灰度值比表示MCP-1 mRNA相对表达量。
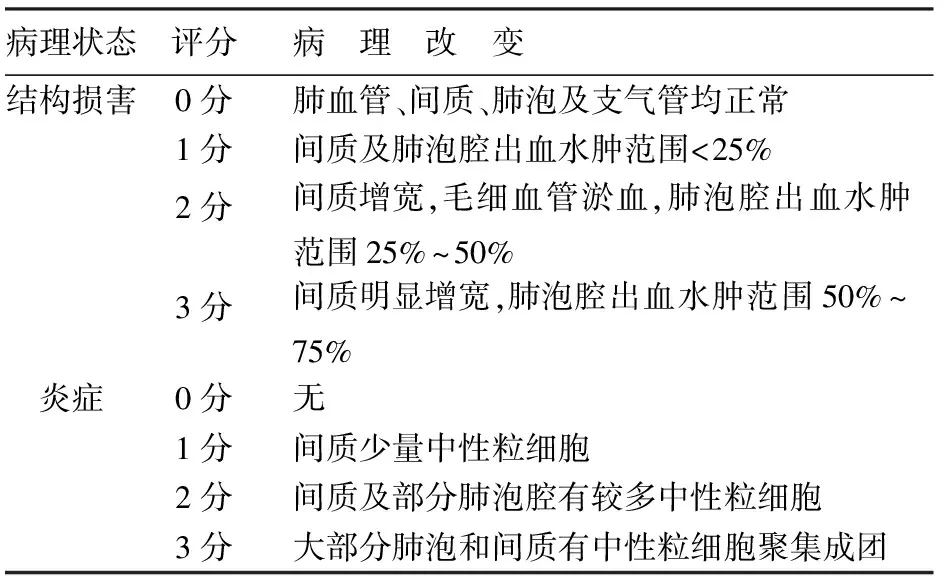
表1 肺组织学评分标准
三、统计学处理
结 果
一、血清生化指标的变化
与对照组相比,ANP各组血淀粉酶、谷丙转氨酶、血糖及肌酐水平显著升高(P<0.05或<0.01),且随时间延长呈上升趋势,而血钙水平逐渐降低(P<0.05或<0.01,表2)。
二、胰腺、肺组织病理改变及肺湿/干重比
对照组胰腺外观正常;ANP组大鼠胰腺肿胀明显,质地较硬,有大片黄色坏死灶,大网膜、肠系膜上见大量皂化斑,腹腔有中至大量血性腹水。显微镜下,对照组胰腺腺泡和导管未见异常;ANP各组胰腺组织见大片出血、凝固性坏死及脂肪坏死,坏死区见大量中性粒细胞和单核细胞浸润,血管破裂出血。
对照组肺组织正常;ANP 3 h组大鼠肺组织轻度水肿,6 h组水肿明显、少量血性胸水,12 h组高度水肿,肺表面散在出血点,血性胸水。显微镜下,对照组肺组织结构清晰,肺泡壁完整,间质无水肿渗出;ANP 3 h组间质增宽、充血水肿,见中性粒细胞浸润, 6 h组间质充血水肿、炎细胞浸润,偶见间质出血,12 h组间质及肺泡腔均有较多中性粒细胞,部分聚集成团,间质、肺泡腔出血。ANP各组肺组织病理评分显著高于对照组(P<0.01,表2)。对照组肺湿/干重比为4.32±0.33,ANP 3、6、12 h的肺湿/干重比分别为4.85±0.38、4.97±0.47、5.03±0.46,较对照组显著增加(P<0.05或<0.01)。
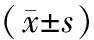
表2 各组血清淀粉酶、血糖、血钙、肌酐、谷丙转氨酶以及肺组织病理评分的变化
注:与对照组比较,aP<0.05,bP<0.01
三、肺组织MCP-1 mRNA表达的变化
对照组肺组织MCP-1 mRNA有轻度表达,表达量为0.21±0.05;ANP组肺组织MCP-1 mRNA表达明显高于对照组(P<0.05或<0.01),3、6、12 h的表达量分别为0.36±0.08、0.56±0.15、0.72±0.21(图1)。肺组织MCP-1 mRNA的表达与肺组织湿/干重比以及肺组织病理变化相关,相关系数分别为0.75和0.89(P<0.05)。
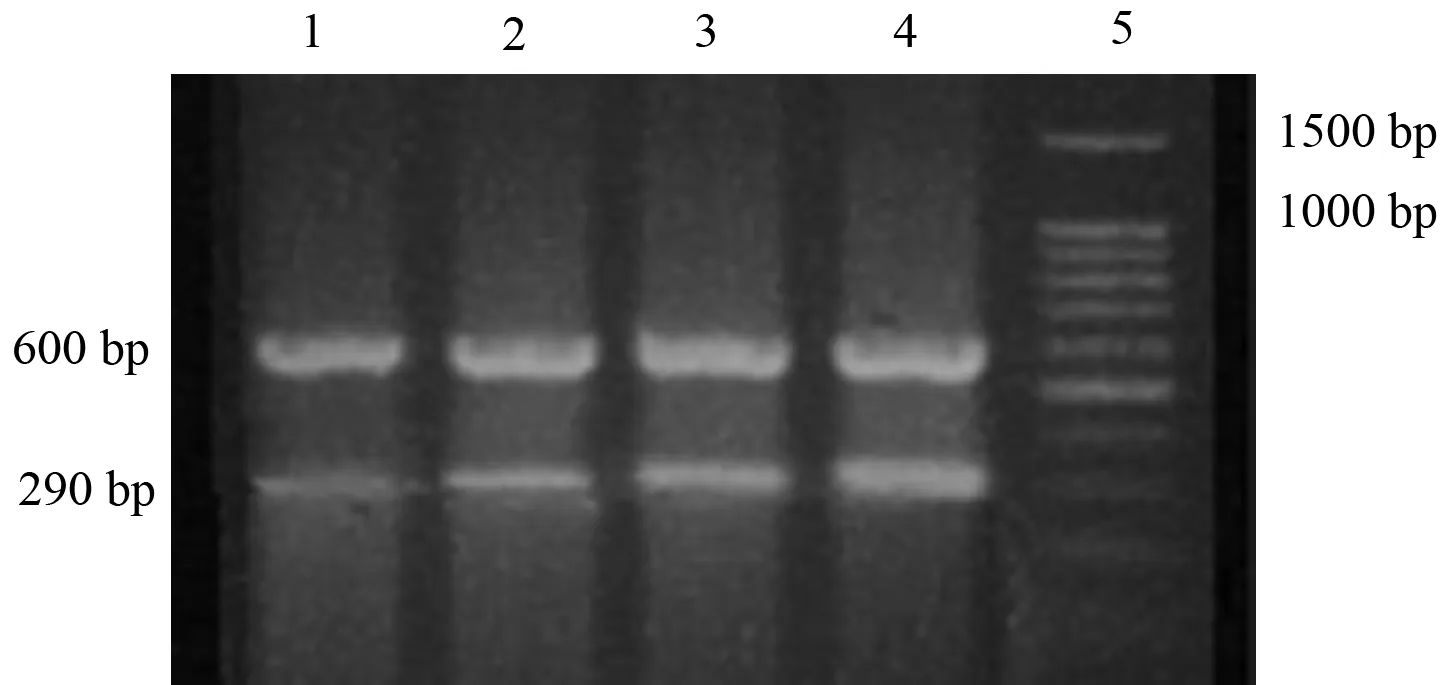
图1对照组(1)及ANP 3(2)、6(3)、12 h(4)组大鼠肺组织MCP-1 mRNA的表达
讨 论
SAP早期事件发生在腺泡内,一系列炎症介质的级联反应促使炎症介质大量释放进入血循环,导致重症患者发生全身炎症反应综合征(systemic inflammatory response syndrome,SIRS),而肺往往是最易受累的靶器官。研究表明,中性粒细胞、单核-巨噬细胞系统激活所释放的细胞因子,如肿瘤坏死因子、白介素家族成员和血小板活化因子等是SAP并发ALI的重要始动和促进因素[1]。
趋化因子是一族低分子量、具有化学趋化作用的细胞因子,在生理和一些病理情况下起着促进细胞迁移,诱导整合蛋白活化、细胞呼吸爆发和其他细胞因子转录,促使多种淋巴因子释放等作用[3-4]。MCP-1可由体内单核细胞、巨噬细胞、内皮细胞等多种细胞产生,受各种炎症因素刺激后合成增加,与受体结合激活细胞内信号转导通路,导致胞质内Ca2+释放,蛋白激酶C活化,趋化激活单核巨噬细胞向炎症部位聚集参与炎症反应,在败血症和其他一些炎症反应中起关键作用。离体胰腺腺泡细胞培养研究表明,胰腺腺泡细胞能持续合成MCP-1,大剂量雨蛙肽或CCK刺激后可导致MCP-1的合成显著增加,支持腺泡细胞自身合成的趋化因子可能是急性胰腺炎(AP)早期的炎症介质之一[4-5]。在AP早期阶段, MCP-1即在腺泡细胞中产生,同时在血清中MCP-1显著升高[6],拮抗MCP-1活性能减轻实验性AP严重程度[7-8]。在AP的局部并发症和远处脏器损害的发病机制中,MCP-1较其他成员如MIP-1α、MIP-1β等起着更为关键的作用。
本实验结果显示,在大鼠ANP早期即有ALI的发生,诱发ANP 3 h后即可见大鼠肺损伤,12 h更严重,肺湿/干重比显著增加,肺组织MCP-1 mRNA表达明显上调,且肺MCP-1 mRNA表达与肺组织病理损伤程度及湿/干重比均成正相关,推测MCP-1可能是ANP早期并发ALI重要的前炎症介质。
[1] Papachristou GI.Prediction of severe acute pancreatitis:current knowledge and novel insights.World J Gastroenterol,2008,14:6273-6275.
[2] Schmidt J,Rattner DW,Lewandrowshi K.A better model of acute pancreatitis for eraluation therapy.Ann Surg,1992,215:44-56.
[3] Brady M,Bhatia M,Christmas S,et al.Expression of the chemokines MCP-1/JE and cytokine-induced neutrophil chemoattractant in early acute pancreatitis.Pancreas,2002,25:260-269.
[4] Bhatia M,Brady M,Kang YK,et al.MCP-1 but not CINC synthesis is increased in rat pancreatic acini in response to cerulein hyperstimulation.Am J Physiol Gastrointest Liver Physiol,2002, 282:G77-G85.
[5] Rau B,Baumgart K,Kruger CM,et al.CC-chemokine activation in acute pancreatitis:enhanced release of monoeyte chemoattractant protein-1 in patients with local and systemic complications. Intensive Care Med,2003,29:622-629.
[6] Regnér S,Appelros S,Hjalmarsson C,et al.Monocyte chemoattractant protein 1,active carboxypeptidase B and CAPAP at hospital admission are predictive markers for severe acute pancreatitis.Pancreatology,2008,8:42-49.
[7] Ishibashi T,Zhao H,Kawabe K,et al.Blocking of monocyte chemoattractant protein-1(MCP-1) activity attenuates the severity of acute pancreatitis in rats.J Gastroenterol,2008,43:79-85.
[8] Sun J,Bhatia M.Blockade of neurokinin-1 receptor attenuates CC and CXC chemokine production in experimental acute pancreatitis and associated lung injury.Am J Physiol Gastrointest Liver Physiol,2007,292:G143-G153.
2010-12-30)
(本文编辑:吕芳萍)
Roleofmonocytechemotacticprotein-1geneinacutelunginjuryduringacutenecrotizingpancreatitis
XUYong-chun,LIZhao-shen,GONGYan-fang,JINJing.
DepartmentofGastroenterology,ChanghaiHospital,SecondMilitaryMedicalUniversity,Shanghai200433,China
LIZhao-shen,Email:zhaoshenli56@gmail.com
ObjectiveTo explore the potential role of monocyte chemotactic protein-1 (MCP-1) gene in the pathogenesis of acute lung injury (ALI) in early acute necrotizing pancreatitis (ANP).MethodsForty SD rats were randomly divided into control group, ANP 3, 6, 12 h group with 10 rats in each group according to a number table. ANP was induced by intraperitoneal injection of 15% L-arginine solution at a dose of 2.0 mg/g body weight. Pathological changes of pancreases and lungs were observed. Lung wet/dry weight ratio was measured. Intrapulmonary expression of MCP-1 mRNA was evaluated by RT-PCR.ResultsAfter intraperitoneal injection of 15% L-arginine solution, the rat′s pancreas presented with bleeding, necrosis comparable with pathological changes of ANP. Pulmonary tissue edema was obvious. At ANP 3, 6, 12 h group, the pathological scores of the lung were 3.75±0.58,5.50±0.63,5.86±0.54, the wet/dry weight ratios were 4.85±0.38,4.97±0.47,5.03±0.46, the MCP-1 mRNA expressions were 0.36±0.08,0.56±0.15,0.72±0.21, which were significantly higher than those in the control group (0.12±0.05,4.32±0.33,0.21±0.05,P<0.05 or <0.01). The MCP-1 mRNA expression in lungs was significantly correlated with the degree of lung damage and wet/dry weight ratio of lungs (r=0.75,r=0.89,P<0.05).ConclusionsMCP-1 mRNA expression was up-regulated in the early phase of ANP in the lungs, and it may play an important role in ALI during ANP.
Pancreatitis,acute necrotizing; Monocyte chemoattractant protein-1; Lung; Gene expression
10.3760/cma.j.issn.1674-1935.2011.02.015
全军医药卫生科研基金资助(08MA064)
200433 上海,第二军医大学附属长海医院消化科(许永春,现在南昌解放军第九四医院消化内科)
李兆申,Email:zhaoshenli56@gmail.com

